
В органической химии перициклическая реакция — это тип органической реакции , в которой переходное состояние молекулы имеет циклическую геометрию, реакция протекает согласованно , а орбитали связей , участвующие в реакции, перекрываются в непрерывном цикле в переходном состоянии. . Перициклические реакции отличаются от линейных реакций , охватывающих большинство органических превращений и протекающих через ациклическое переходное состояние, с одной стороны, и коарктатных реакций , протекающих через двоякоциклическое согласованное переходное состояние, с другой стороны. Перициклические реакции обычно представляют собой реакции перегруппировки или присоединения . Основные классы перициклических реакций приведены в таблице ниже (три наиболее важных класса выделены жирным шрифтом). Еновые реакции и хелетропные реакции часто относят к реакциям переноса группы и циклоприсоединения/циклоэлиминирования соответственно, тогда как диотропные реакции и реакции переноса группы (если исключить еновые реакции) встречаются редко.
В целом эти процессы считаются равновесными , хотя можно направить реакцию в одном направлении, разработав реакцию, в которой продукт находится на значительно более низком энергетическом уровне; это связано с мономолекулярной интерпретацией принципа Ле Шателье . Таким образом, существует набор «ретро» перициклических реакций.
По определению, перициклические реакции протекают по согласованному механизму, включающему одно циклическое переходное состояние. По этой причине до систематического понимания перициклических процессов на основе принципа сохранения орбитальной симметрии их в шутку называли «реакциями без механизма». Однако реакции, для которых можно выделить перициклические механизмы, часто имеют родственные ступенчатые механизмы, протекающие через радикальные или диполярные промежуточные соединения, которые также являются жизнеспособными. Некоторые классы перициклических реакций, такие как реакции циклоприсоединения [2+2] кетена , могут быть «спорными», поскольку их механизм иногда точно не известен (или может зависеть от реакционноспособной системы). Более того, перициклические реакции также часто имеют аналоги, катализируемые металлами, хотя обычно они также технически не являются перициклическими, поскольку протекают через стабилизированные металлами интермедиаты и, следовательно, не являются согласованными.
Несмотря на эти оговорки, теоретическое понимание перициклических реакций, вероятно, является одним из самых сложных и хорошо разработанных во всей органической химии. Понимание того, как орбитали взаимодействуют в ходе перициклического процесса, привело к появлению правил Вудворда-Гоффмана — простого набора критериев, позволяющих предсказать, является ли перициклический механизм реакции вероятным или благоприятным. Например, эти правила предсказывают, что [4+2]-циклоприсоединение бутадиена и этилена в термических условиях, вероятно, является перициклическим процессом, а [2+2]-циклоприсоединение двух молекул этилена - нет. Это согласуется с экспериментальными данными, подтверждающими упорядоченное, согласованное переходное состояние для первого и многоступенчатый радикальный процесс для второго. Несколько эквивалентных подходов, изложенных ниже, приводят к одним и тем же предсказаниям.
Теория ароматического переходного состояния предполагает, что переходное состояние с минимальной энергией для перициклического процесса является ароматическим , а выбор топологии реакции определяется количеством участвующих электронов. Для реакций с участием (4 n + 2)-электронных систем (2, 6, 10, ... электронов; нечетное число электронных пар) предложены переходные состояния топологии Хюккеля , в которых реакционноспособная часть реагирующей молекулы или молекул имеет орбитали, взаимодействующие в непрерывном цикле с четным числом узлов. В 4 -электронных системах (4, 8, 12, ... электронов; четное число электронных пар) предложены переходные состояния топологии Мёбиуса , в которых реагирующие молекулы имеют орбитали, взаимодействующие в закрученном непрерывном цикле с нечетным числом узлов. . Соответствующие переходные состояния Мёбиуса (4 n + 2)-электронов и переходные состояния Хюккеля с 4 n -электронами являются антиароматическими и поэтому им крайне нежелательны. Теория ароматического переходного состояния приводит к особенно простой формулировке обобщенных правил Вудворда-Хоффмана: перициклическая реакция с участием нечетного числа электронных пар будет протекать через переходное состояние Хюккеля (четное количество антарафациальных компонентов в терминологии Вудворда-Хоффмана) [1 ] в то время как перициклическая реакция с участием четного числа электронных пар будет протекать через переходное состояние Мёбиуса (нечетное число антарафациальных компонентов).
Аналогично, перициклические реакции анализировались с помощью корреляционных диаграмм , которые отслеживают эволюцию молекулярных орбиталей (известных как «коррелирующие» молекулярные орбитали) реагирующих молекул по мере их перехода от реагентов к продуктам через переходное состояние на основе их свойств симметрии. . Реакции благоприятны («разрешены»), если основное состояние реагентов коррелируют с основным состоянием продуктов, и неблагоприятны («запрещены»), если основное состояние реагентов коррелирует с возбужденным состоянием продуктов. Эта идея известна как сохранение орбитальной симметрии . Рассмотрение взаимодействий высших занятых и низших незанятых молекулярных орбиталей ( граничный орбитальный анализ ) — еще один подход к анализу переходного состояния перициклической реакции.
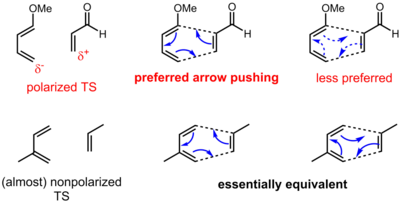
Соглашение о стрелке для перициклических реакций имеет несколько иной смысл по сравнению с полярными (и радикальными) реакциями. В перициклических реакциях часто не наблюдается очевидного движения электронов от источника, богатого электронами, к стоку с низким содержанием электронов. Скорее, электроны перераспределяются вокруг циклического переходного состояния. Таким образом, электроны могут толкаться в любом из двух направлений перициклической реакции. Однако для некоторых перициклических реакций в переходном состоянии существует определенная поляризация заряда из-за асинхронности (образование и разрыв связи в переходном состоянии не происходят в одинаковой степени). Таким образом, одно направление может быть предпочтительнее другого, хотя, возможно, оба изображения формально верны. В случае реакции Дильса-Альдера, показанной ниже, резонансные аргументы проясняют направление поляризации. Однако в более сложных ситуациях могут потребоваться детальные расчеты для определения направления и степени поляризации.
С перициклическими процессами тесно связаны реакции, являющиеся псевдоперициклическими . Хотя псевдоперициклическая реакция протекает через циклическое переходное состояние, две вовлеченные орбитали вынуждены быть ортогональными и не могут взаимодействовать. Пожалуй, самым известным примером является гидроборирование олефина . Хотя это выглядит как процесс переноса запрещенной группы в 4-электронной топологии Хюккеля, пустая p-орбиталь и sp 2- гибридизованная связь B–H ортогональны и не взаимодействуют. Следовательно, правила Вудворда-Хоффмана неприменимы. (Тот факт, что гидроборирование, как полагают, происходит через первоначальное образование π-комплекса, также может иметь значение.)
Перициклические реакции также происходят в нескольких биологических процессах: