Биомолекулярная структура — это сложная складчатая трехмерная форма, образованная молекулой белка , ДНК или РНК , и которая важна для ее функции. Структуру этих молекул можно рассматривать в любом из нескольких масштабов длины, начиная от уровня отдельных атомов до взаимосвязей между целыми белковыми субъединицами . Это полезное различие между масштабами часто выражается как разложение молекулярной структуры на четыре уровня: первичный, вторичный, третичный и четвертичный. Каркас для этой многомасштабной организации молекулы возникает на вторичном уровне, где фундаментальными структурными элементами являются различные водородные связи молекулы . Это приводит к нескольким узнаваемым доменам структуры белка и структуры нуклеиновой кислоты , включая такие особенности вторичной структуры, как альфа-спирали и бета-слои для белков, а также петли шпилек , выпуклости и внутренние петли для нуклеиновых кислот. Термины «первичная» , «вторичная» , «третичная» и «четвертичная» структуры были введены Каем Ульриком Линдерстрём-Лангом в его медицинских лекциях 1951 года в Стэнфордском университете .
Первичная структура биополимера — это точное описание его атомного состава и химических связей, соединяющих эти атомы (включая стереохимию ). Для типичного неразветвленного, не сшитого биополимера (такого как молекула типичного внутриклеточного белка , ДНК или РНК ), первичная структура эквивалентна описанию последовательности его мономерных субъединиц, таких как аминокислоты или нуклеотиды .
Первичная структура белка описывается, начиная с амино N-конца до карбоксильного C-конца , в то время как первичная структура молекулы ДНК или РНК известна как последовательность нуклеиновой кислоты , описывается от 5' конца до 3' конца . Последовательность нуклеиновой кислоты относится к точной последовательности нуклеотидов, которые составляют всю молекулу. Часто первичная структура кодирует мотивы последовательности , которые имеют функциональное значение. Вот некоторые примеры таких мотивов: C/D [1] и H/ACA-боксы [2] snoRNA , сайт связывания LSm , обнаруженный в сплайсосомных РНК, таких как U1 , U2 , U4 , U5 , U6 , U12 и U3 , последовательность Шайна-Дальгарно , [3] консенсусная последовательность Козака [4] и терминатор РНК-полимеразы III . [5]
Вторичная структура белка — это схема водородных связей в биополимере. Они определяют общую трехмерную форму локальных сегментов биополимеров, но не описывают глобальную структуру конкретных атомных позиций в трехмерном пространстве, которые считаются третичной структурой . Вторичная структура формально определяется водородными связями биополимера, как это наблюдается в структуре с атомным разрешением. В белках вторичная структура определяется схемами водородных связей между аминогруппами основной цепи и карбоксильными группами (водородные связи боковая цепь–главная цепь и боковая цепь–боковая цепь не имеют значения), где используется определение водородной связи DSSP .
Вторичная структура нуклеиновой кислоты определяется водородными связями между азотистыми основаниями.
Однако для белков водородная связь коррелирует с другими структурными особенностями, что привело к появлению менее формальных определений вторичной структуры. Например, спирали могут принимать двугранные углы остова в некоторых областях диаграммы Рамачандрана ; таким образом, сегмент остатков с такими двугранными углами часто называют спиралью , независимо от того, имеет ли он правильные водородные связи. Было предложено много других менее формальных определений, часто применяющих концепции из дифференциальной геометрии кривых, такие как кривизна и кручение . Структурные биологи, решающие новую структуру с атомным разрешением, иногда назначают ее вторичную структуру на глаз и записывают свои назначения в соответствующий файл Protein Data Bank (PDB).
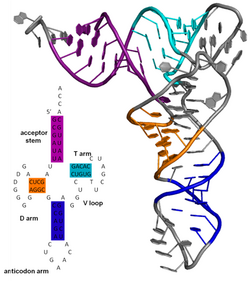
Вторичная структура молекулы нуклеиновой кислоты относится к парным взаимодействиям оснований внутри одной молекулы или набора взаимодействующих молекул. Вторичная структура биологических РНК часто может быть однозначно разложена на стебли и петли. Часто эти элементы или их комбинации могут быть далее классифицированы, например, тетрапетли , псевдоузлы и петли стебля . Существует много элементов вторичной структуры, имеющих функциональное значение для биологической РНК. Известные примеры включают Rho-независимые петли стебля терминатора и клеверный лист транспортной РНК (тРНК). Существует небольшая отрасль исследователей, пытающихся определить вторичную структуру молекул РНК. Подходы включают как экспериментальные , так и вычислительные методы (см. также Список программного обеспечения для прогнозирования структуры РНК ).
Третичная структура белка или любой другой макромолекулы — это ее трехмерная структура, определяемая атомными координатами. [6] Белки и нуклеиновые кислоты складываются в сложные трехмерные структуры, которые приводят к функциям молекул. Хотя такие структуры разнообразны и сложны, они часто состоят из повторяющихся, узнаваемых мотивов и доменов третичной структуры, которые служат молекулярными строительными блоками. Считается, что третичная структура в значительной степени определяется первичной структурой биомолекулы (ее последовательностью аминокислот или нуклеотидов ).
Четвертичная структура белка [ а] относится к числу и расположению множественных молекул белка в многосубъединичном комплексе.
Для нуклеиновых кислот этот термин менее распространен, но может относиться к более высокому уровню организации ДНК в хроматине [7], включая ее взаимодействие с гистонами , или к взаимодействиям между отдельными единицами РНК в рибосоме [8] [9] или сплайсосоме .
Вирусы , в целом, можно рассматривать как молекулярные машины. Бактериофаг Т4 является особенно хорошо изученным вирусом, и его четвертичная структура белка относительно хорошо определена. [10] Исследование, проведенное Флором (1970) [11], показало, что во время in vivo построения вируса специфическими морфогенетическими белками эти белки должны производиться в сбалансированных пропорциях для правильной сборки вируса. Недостаточность (из-за мутации ) в производстве одного конкретного морфогенетического белка (например, критического белка хвостового волокна) может привести к производству потомства вирусов, почти все из которых имеют слишком мало определенного белкового компонента для правильного функционирования, т. е. для заражения клеток-хозяев. [11] Однако вторая мутация, которая уменьшает другой морфогенетический компонент (например, в базовой пластинке или головке фага), может в некоторых случаях восстановить баланс таким образом, что более высокая доля произведенных вирусных частиц сможет функционировать. [11] Таким образом, было обнаружено, что мутация, которая снижает экспрессию одного гена, продукт которого используется в морфогенезе, может быть частично подавлена мутацией, которая снижает экспрессию второго морфогенетического гена, что приводит к более сбалансированному производству продуктов вирусного гена. Концепция, что in vivo сбалансированная доступность компонентов необходима для надлежащего молекулярного морфогенеза, может иметь общую применимость для понимания сборки белковых молекулярных машин.
Структурное зондирование — это процесс, при котором биохимические методы используются для определения биомолекулярной структуры. [12] Этот анализ может быть использован для определения шаблонов, которые могут быть использованы для вывода молекулярной структуры, экспериментального анализа молекулярной структуры и функции, а также дальнейшего понимания разработки более мелких молекул для дальнейших биологических исследований. [13] Анализ структурного зондирования может быть выполнен с помощью многих различных методов, которые включают химическое зондирование, зондирование гидроксильных радикалов, картирование интерференции аналоговых нуклеотидов (NAIM) и линейное зондирование. [12]
Структуры белков и нуклеиновых кислот можно определить с помощью ядерной магнитно-резонансной спектроскопии ( ЯМР ), рентгеновской кристаллографии или одночастичной криоэлектронной микроскопии ( криоЭМ ). Первые опубликованные отчеты для ДНК ( Розалинд Франклин и Рэймонда Гослинга в 1953 году) рентгеновских дифракционных картин A-ДНК — а также B-ДНК — использовали анализы, основанные на преобразованиях функций Паттерсона , которые предоставляли лишь ограниченное количество структурной информации для ориентированных волокон ДНК, выделенных из тимуса теленка . [14] [15] Затем в 1953 году Уилкинс и др. предложили альтернативный анализ для рентгеновской дифракции B-ДНК и картин рассеяния гидратированных, бактериально-ориентированных волокон ДНК и головок сперматозоидов форели в терминах квадратов функций Бесселя . [16] Хотя форма B-ДНК наиболее распространена в условиях, обнаруженных в клетках, [17] она не является четко определенной конформацией, а представляет собой семейство или нечеткий набор конформаций ДНК, которые возникают при высоких уровнях гидратации, присутствующих в самых разных живых клетках. [18] Соответствующие им картины рентгеновской дифракции и рассеяния характерны для молекулярных паракристаллов со значительной степенью беспорядка (более 20%), [19] [20] и структура не поддается изучению с использованием только стандартного анализа.
Напротив, стандартный анализ, включающий только преобразования Фурье функций Бесселя [ 21] и молекулярные модели ДНК , по-прежнему обычно используется для анализа рентгеновских дифракционных картин A-ДНК и Z-ДНК. [22]

Прогнозирование биомолекулярной структуры — это прогнозирование трехмерной структуры белка по его аминокислотной последовательности или нуклеиновой кислоты по ее нуклеоосновной (основной) последовательности. Другими словами, это прогнозирование вторичной и третичной структуры по ее первичной структуре. Прогнозирование структуры — это обратная сторона биомолекулярного дизайна, как в рациональном дизайне , дизайне белков , дизайне нуклеиновых кислот и биомолекулярной инженерии .
Предсказание структуры белка является одной из важнейших целей биоинформатики и теоретической химии . Предсказание структуры белка имеет большое значение в медицине (например, при разработке лекарств ) и биотехнологии (например, при разработке новых ферментов ). Каждые два года эффективность текущих методов оценивается в эксперименте по критической оценке предсказания структуры белка ( CASP ).
Также было проведено значительное количество исследований в области биоинформатики, направленных на проблему предсказания структуры РНК. Распространенной проблемой для исследователей, работающих с РНК, является определение трехмерной структуры молекулы, имея только последовательность нуклеиновой кислоты. Однако в случае РНК большая часть окончательной структуры определяется вторичной структурой или внутримолекулярными взаимодействиями пар оснований молекулы. Это подтверждается высокой консервативностью пар оснований у различных видов.
Вторичная структура малых молекул нуклеиновых кислот определяется в основном сильными локальными взаимодействиями, такими как водородные связи и укладка оснований . Суммирование свободной энергии для таких взаимодействий, обычно с использованием метода ближайшего соседа , дает приближение для стабильности данной структуры. [23] Самый простой способ найти структуру с самой низкой свободной энергией — это сгенерировать все возможные структуры и рассчитать для них свободную энергию, но количество возможных структур для последовательности экспоненциально увеличивается с длиной молекулы. [24] Для более длинных молекул количество возможных вторичных структур огромно. [23]
Методы ковариации последовательностей основаны на существовании набора данных, состоящего из нескольких гомологичных последовательностей РНК с родственными, но непохожими последовательностями. Эти методы анализируют ковариацию отдельных участков оснований в эволюции ; сохранение на двух широко разнесенных участках пары нуклеотидов , спаривающихся с основаниями , указывает на наличие структурно необходимой водородной связи между этими позициями. Было показано, что общая проблема предсказания псевдоузла является NP-полной . [25]
Биомолекулярный дизайн можно считать обратным предсказанию структуры. При предсказании структуры структура определяется из известной последовательности, тогда как при проектировании белков или нуклеиновых кислот генерируется последовательность, которая сформирует желаемую структуру.
Другие биомолекулы, такие как полисахариды , полифенолы и липиды , также могут иметь структуру более высокого порядка биологического значения.