Короткая шпилечная РНК или малая шпилечная РНК ( shRNA / Hairpin Vector) представляет собой искусственную молекулу РНК с плотным шпилечным поворотом, которая может использоваться для подавления экспрессии целевого гена с помощью РНК-интерференции (РНКi). [1] [2] Экспрессия shRNA в клетках обычно осуществляется путем доставки плазмид или через вирусные или бактериальные векторы . shRNA является выгодным медиатором РНКi, поскольку имеет относительно низкую скорость деградации и оборота. Однако для этого требуется использование вектора экспрессии , который может вызывать побочные эффекты в медицинских приложениях. [3]
Выбор промотора имеет важное значение для достижения надежной экспрессии shRNA. Сначала использовались промоторы полимеразы III , такие как U6 и H1; однако эти промоторы не имеют пространственного и временного контроля. [3] Таким образом, произошел сдвиг в сторону использования промоутеров полимеразы II , которые являются индуцируемыми, для регулирования экспрессии shRNA.
Экспрессия shRNA в клетках может быть достигнута путем доставки плазмид или с помощью вирусных или бактериальных векторов .
Доставка плазмид в клетки посредством трансфекции для получения экспрессии shRNA может быть осуществлена с использованием коммерчески доступных реагентов in vitro . Однако этот метод неприменим in vivo и, таким образом, имеет ограниченную полезность.
Использование бактериального вектора для получения экспрессии shRNA в клетках является относительно новым подходом. Он основан на исследованиях, показывающих, что рекомбинантная Escherichia coli , содержащая плазмиду с shRNA, скармливаемая мышам, может подавлять экспрессию целевого гена в эпителии кишечника. [4] Этот подход использовался в 2012 году в клинических испытаниях, чтобы попытаться лечить пациентов с семейным аденоматозным полипозом. [5]
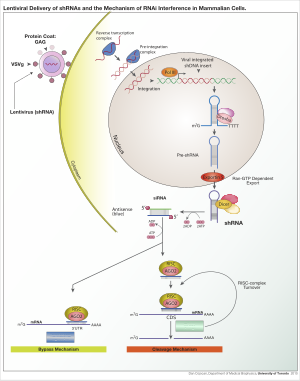
Для получения экспрессии shRNA в клетках можно использовать различные вирусные векторы, включая аденоассоциированные вирусы (AAV), аденовирусы и лентивирусы . В случае аденоассоциированных вирусов и аденовирусов геномы остаются эписомальными. Это выгодно, так как избегается инсерционный мутагенез. Это невыгодно, так как потомство клетки быстро потеряет вирус через деление клетки, если только клетка не делится очень медленно. AAV отличаются от аденовирусов тем, что вирусные гены были удалены, и они имеют сниженную упаковочную емкость. Лентивирусы интегрируются в участки транскрипционно активного хроматина и, таким образом, передаются клеткам-потомкам. При таком подходе повышается риск инсерционного мутагенеза; однако, риск можно снизить, используя лентивирус с дефицитом интегразы. [6]

После того, как вектор интегрируется в геном хозяина, shRNA затем транскрибируется в ядре полимеразой II или полимеразой III в зависимости от выбора промотора. Продукт имитирует pri-microRNA (pri-miRNA) и обрабатывается Drosha . Полученная pre-shRNA экспортируется из ядра Exportin 5. Затем этот продукт обрабатывается Dicer и загружается в комплекс РНК-индуцированного сайленсинга (RISC). Смысловая (пассажирская) цепь деградирует. Антисмысловая (направляющая) цепь направляет RISC к мРНК, которая имеет комплементарную последовательность. В случае идеальной комплементарности RISC расщепляет мРНК. В случае несовершенной комплементарности RISC подавляет трансляцию мРНК. В обоих этих случаях shRNA приводит к сайленсингу целевого гена.
Благодаря способности shRNA обеспечивать специфическое, долгосрочное подавление генов, возник большой интерес к использованию shRNA для генной терапии. Ниже обсуждаются три примера терапии на основе shRNA.
Gradalis, Inc. разработала вакцину FANG, которая используется для лечения запущенных форм рака. FANG использует бифункциональную shRNA (bi-shRNA) против иммуносупрессивных трансформирующих факторов роста (TGF) β1 и β2. [8] Аутологичные опухолевые клетки были собраны у пациентов, и плазмида, кодирующая бифункциональную shRNA и гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), была введена ex vivo посредством электропорации. Эти клетки были позже облучены и введены обратно пациенту.
Компания Marina Biotech разработала препарат CEQ508, который используется для лечения семейного аденоматозного полипоза. CEQ508 использует бактериальный вектор для доставки shRNA против β-катенина.
Gradalis, Inc. разработала бифункциональную shRNA-STMN1 (pbi-shRNA STMN1), которая используется для лечения запущенных и/или метастатических видов рака. Эта pbi-shRNA STMN1 направлена против статмина 1 и доставляется внутрь опухоли с помощью технологии липоплекса (LP) биламеллярных инвагинированных везикул (BIV) .
Терапия на основе shRNA обычно сталкивается с несколькими проблемами. Наиболее существенной проблемой является доставка. shRNA обычно доставляется с помощью вектора, и хотя они, как правило, эффективны, они представляют значительную угрозу безопасности. В частности, подходы на основе вирусной генной терапии оказались опасными в прошлых клинических испытаниях. В первом поколении ретровирусной генной терапии у некоторых пациентов, лечившихся вирусными векторами от синдрома Вискотта-Олдрича , развился острый Т-клеточный лейкоз. Было установлено, что это было вызвано местом вставки вирусного вектора. [9] Потенциальное перенасыщение RISC также является проблемой. Если shRNA экспрессируется на слишком высоких уровнях, клетка может не иметь возможности правильно обрабатывать эндогенную РНК, что может вызвать значительные проблемы. Еще одной проблемой является вероятность того, что у пациента может возникнуть иммунный ответ на терапию. [10] Наконец, могут быть нецелевые эффекты, и shRNA может подавить другие непреднамеренные гены. При разработке успешных новых терапевтических средств на основе shRNA необходимо учитывать все эти проблемы.