



Арбускулярная микориза ( AM ) (множественное число микориза ) — это тип микоризы , в которой симбионтный гриб ( AM-грибы или AMF) проникает в корковые клетки корней сосудистого растения, образуя арбускулы . Арбускулярная микориза — это тип эндомикоризы наряду с эрикоидной микоризой и орхидейной микоризой (не путать с эктомикоризой ). Для них характерно образование уникальных древовидных структур — арбускул. [1] Кроме того, часто встречаются шаровидные структуры хранения, называемые везикулами.
Арбускулярная микориза образована грибами подтипа Glomeromycotina . Этот подтип вместе с Mortierellomycotina и Mucoromycotina образуют тип Mucoromycota , родственную кладу более известных и разнообразных дикариевых грибов. [2]
Грибы AM помогают растениям извлекать из почвы питательные вещества, такие как фосфор , серу , азот и микроэлементы . Считается, что развитие арбускулярного микоризного симбиоза сыграло решающую роль в первоначальной колонизации земли растениями и в эволюции сосудистых растений. [3] Было сказано, что быстрее перечислить растения, которые не образуют эндомикоризу, чем те, которые ее образуют. [4] Этот симбиоз представляет собой высокоразвитые мутуалистические отношения, обнаруженные между грибами и растениями, наиболее распространенный из известных симбиозов растений, [5] и AMF обнаружен в 80% семейств сосудистых растений, существующих сегодня. [6]
Ранее этот тип микоризных ассоциаций назывался «везикулярно-арбускулярной микоризой (ВАМ)», но поскольку некоторые представители этих грибов не производят никаких везикул, например, представители семейства Gigasporaceae , термин был изменен на «арбускулярная микориза», чтобы включить их. [7] [8]
Достижения в исследованиях микоризной физиологии и экологии с 1970-х годов привели к более глубокому пониманию множественных ролей AMF в экосистеме. Примером является важный вклад клееподобного белка гломалина в структуру почвы (см. ниже). Эти знания применимы к человеческим усилиям по управлению экосистемами , восстановлению экосистем и сельскому хозяйству .
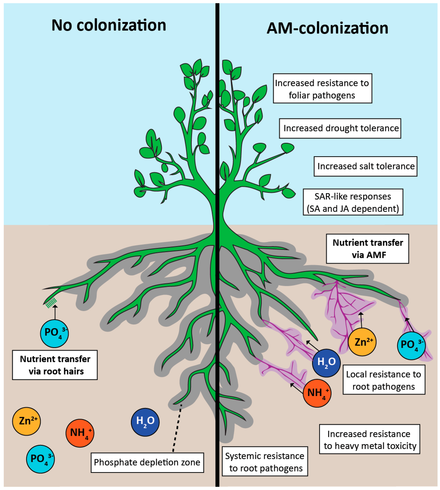
Как палеобиологические , так и молекулярные данные указывают на то, что АМ — это древний симбиоз, возникший по меньшей мере 460 миллионов лет назад. Симбиоз АМ повсеместно распространен среди наземных растений, что предполагает, что микориза присутствовала у ранних предков современных наземных растений. Эта положительная связь с растениями могла способствовать развитию наземных растений. [5]
В райнийском кремне нижнего девона были обнаружены окаменелости древнейших наземных растений, в которых были обнаружены микоризные грибы. [10] Окаменелые растения, содержащие микоризные грибы, сохранились в кремнеземе.
В раннем девоне развивалась наземная флора. Было обнаружено, что растения райниевского кремня из нижнего девона (400 млн. лет назад) содержат структуры, напоминающие пузырьки и споры современных видов Glomus . Колонизированные ископаемые корни были обнаружены у Aglaophyton major и Rhynia , которые являются древними растениями, обладающими характеристиками сосудистых растений и мохообразных с примитивными протостелическими корневищами . [10]
Внутрикорневой мицелий наблюдался в межклеточных пространствах корня, а арбускулы наблюдались в тонкостенных клетках слоя, похожих на палисадную паренхиму . Ископаемые арбускулы кажутся очень похожими на те, что существуют у AMF. [10] Клетки, содержащие арбускулы, имеют утолщенные стенки, которые также наблюдаются в сохранившихся колонизированных клетках.
Микоризы из миоцена демонстрируют везикулярную морфологию, очень похожую на морфологию современных Glomerales . Эта сохранившаяся морфология может отражать доступность питательных веществ, предоставляемых растениями-хозяевами как в современных, так и в миоценовых мутуализмах. [11] Однако можно утверждать, что эффективность сигнальных процессов, вероятно, эволюционировала со времен миоцена, и это не может быть обнаружено в ископаемой летописи. Тонкая настройка сигнальных процессов улучшила бы координацию и обмен питательными веществами между симбионтами , одновременно повышая приспособленность как грибов, так и симбионтов растений.
Природа взаимоотношений между растениями и предками арбускулярных микоризных грибов является спорной. Существуют две гипотезы:
В райни-черте были обнаружены как сапротрофы, так и биотрофы, но доказательств, подтверждающих какую-либо из этих гипотез, мало.
Существуют некоторые ископаемые свидетельства, которые предполагают, что паразитические грибы не убивали клетки хозяина сразу после вторжения, хотя реакция на вторжение наблюдалась в клетках хозяина. Эта реакция могла развиться в химические сигнальные процессы, необходимые для симбиоза. [10]
В обоих случаях считается, что симбиотическое взаимодействие растений и грибов развилось из отношений, при которых грибы получали питательные вещества из растений, в симбиотические отношения, при которых растение и грибы обмениваются питательными веществами.
Древние растения не имели настоящих корней. Струллу-Дерриен и Струллу предложили термин «парамикориза» для микоризы, которая заражает корневище, побег или слоевище, и «эумикориза», которая заражает настоящие корни. [12] [13] [14] Эти структуры были описаны как в спорофитах, так и в гаметофитах ранних наземных растений. [13]
Повышенный интерес к микоризному симбиозу и разработка сложных молекулярных методов привели к быстрому развитию генетических доказательств. Ван и др. (2010) исследовали гены растений, участвующие в коммуникации с партнерами-грибами порядка Glomales (DMI1, DMI3, IPD3). [15] [16] Эти три гена могли быть секвенированы из всех основных клад современных наземных растений, включая печеночники , самую базальную группу, и филогения трех генов, как было доказано, согласуется с тогдашней филогенией наземных растений. Это подразумевает, что микоризные гены должны были присутствовать у общего предка наземных растений, и что они должны были вертикально наследоваться с тех пор, как растения колонизировали сушу. [15]
Было обнаружено, что грибы AM имеют основной фермент бактериального типа (рибонуклеаза III) механизма обработки sRNA, вероятно, в процессе горизонтального переноса генов от цианобактериального предка, и, возможно, связанного с симбиозом. [17] Эта находка генетического ископаемого внутри грибов AM повышает вероятность тесной связи между грибами AM и цианобактериальными предками. Ранее сообщалось о похожем симбиозе Geosiphon – Nostoc . [18]
Удивительно, но, несмотря на свою длительную эволюцию в качестве подземного партнера корней растений, чья среда далека от света или колебаний температуры, AMF все еще имеют консервативные циркадные часы, чей грибковый циркадный осциллятор ( frq ) активируется синим светом, подобно модельному циркадному грибку Neurospora crassa . [19] Доказанное сохранение циркадных часов и выходных генов у R. irregulare открывает дверь к изучению циркадных часов у грибкового партнера симбиоза AM. То же исследование охарактеризовало ген frq AMF , [19] который является первым идентифицированным геном frq внешней группы Dikarya, и предполагает, что эволюция гена frq в грибковом царстве намного старше, чем считалось ранее.
Развитие АМ-грибов до колонизации корней, известное как пресимбиоз, состоит из трех стадий: прорастание спор, рост гиф, распознавание хозяина и образование аппрессория .
Споры грибов AM представляют собой толстостенные многоядерные покоящиеся структуры. [21] Прорастание спор не зависит от растения, поскольку споры прорастали в экспериментальных условиях в отсутствие растений как in vitro , так и в почве. Однако скорость прорастания может быть увеличена за счет корневых выделений хозяина . [22] Споры грибов AM прорастают при наличии подходящих условий почвенной матрицы, температуры, концентрации углекислого газа, pH и концентрации фосфора. [21]
Рост гиф АМ через почву контролируется корневыми выделениями хозяина, известными как стриголактоны , и концентрацией фосфора в почве. [23] Низкие концентрации фосфора в почве усиливают рост и ветвление гиф, а также вызывают выделение растениями соединений, которые контролируют интенсивность ветвления гиф. [22] [24]
Ветвление грибковых гиф AM, выращенных в фосфорной среде 1 мМ, значительно снижается, но длина ростковой трубки и общий рост гиф не были затронуты. Концентрация фосфора 10 мМ подавляла как рост гиф, так и ветвление. Такая концентрация фосфора встречается в естественных почвенных условиях и, таким образом, может способствовать снижению микоризной колонизации. [24]
Было показано, что корневые экссудаты растений-хозяев AMF, выращенных в жидкой среде с фосфором и без него, влияют на рост гиф. Споры Gigaspora margarita выращивались в экссудатах растений-хозяев. Гифы грибов, выращенных в экссудатах корней, лишенных фосфора, росли больше и образовывали третичные ветви по сравнению с гифами, выращенными в экссудатах растений, которым давали достаточно фосфора. Когда стимулирующие рост корневые экссудаты добавлялись в низкой концентрации, грибы AM образовывали разбросанные длинные ветви. По мере увеличения концентрации экссудатов грибы образовывали более плотно сгруппированные ветви. В арбускулах с самой высокой концентрацией формировались структуры обмена фосфора AMF. [24]
Считается, что эта хемотаксическая реакция грибов на экссудаты растений-хозяев повышает эффективность колонизации корней хозяина в почвах с низким содержанием фосфора. [22] Это адаптация грибов для эффективного исследования почвы в поисках подходящего растения-хозяина. [24]
Еще одно доказательство того, что арбускулярные микоризные грибы проявляют специфичный для хозяина хемотаксис , который обеспечивает рост гиф в направлении корней потенциального растения-хозяина: споры Glomus mosseae были отделены от корней растения-хозяина, растений-нехозяев и мертвого растения-хозяина мембраной, проницаемой только для гиф. При обработке растением-хозяином грибы пересекали мембрану и всегда появлялись в пределах 800 мкм от корня, но не при обработке растениями-нехозяевами и мертвыми растениями. [25]
Молекулярные методы использовались для понимания сигнальных путей между арбускулярной микоризой и корнями растений. В 2003 году было показано, как AM претерпевает физиологические изменения в присутствии экссудатов из потенциальных корней растения-хозяина, чтобы колонизировать его. Экссудаты корней растения-хозяина запускают и включают гены грибов AM, необходимые для дыхания углеродных соединений спор. В экспериментах скорость транскрипции 10 генов увеличивалась через полчаса после воздействия и еще больше через 1 час. после 4 часов воздействия AM реагируют морфологическим ростом. Гены, выделенные в это время, участвуют в митохондриальной активности и выработке ферментов. Скорость дыхания грибов, измеряемая по скорости потребления O 2 , увеличивалась на 30% через 3 часа после воздействия корневых экссудатов, что указывает на то, что экссудаты корней растения-хозяина стимулируют митохондриальную активность спор AMF. Это может быть частью регуляторного механизма грибка, который сохраняет энергию спор для эффективного роста и ветвления гиф при получении сигналов от потенциального растения-хозяина. [26]
Когда гифы грибов арбускулярной микоризы сталкиваются с корнем растения-хозяина, на эпидермисе корня образуется аппрессорий или «структура инфекции». Из этой структуры гифы могут проникать в паренхимный кортекс хозяина. [27] AM не нуждаются в химических сигналах от растения для образования аппрессориев. Грибы AM могли образовывать аппрессории на клеточных стенках «призрачных» клеток, в которых был удален протопласт для устранения сигнализации между грибами и растением-хозяином. Однако гифы не проникали дальше в клетки и не росли в направлении корневой кортекса, что указывает на то, что для дальнейшего роста после образования аппрессориев необходима сигнализация между симбионтами. [22]
Попав внутрь паренхимы, гриб образует сильно разветвленные структуры для обмена питательными веществами с растением, называемые арбускулами . [27] Это отличительные структуры арбускулярного микоризного гриба. Арбускулы являются местами обмена фосфором, углеродом, водой и другими питательными веществами. [21] Существует две формы: тип Paris характеризуется ростом гиф от одной клетки к другой; а тип Arum характеризуется ростом гиф в пространстве между растительными клетками. [28] Выбор между типом Paris и типом Arum в первую очередь определяется семейством растения-хозяина, хотя некоторые семейства или виды способны к любому типу. [29] [30]
Растение-хозяин контролирует межклеточную пролиферацию гиф и образование арбускул. Происходит деконденсация хроматина растения , что указывает на повышенную транскрипцию ДНК растения в клетках, содержащих арбускулы. [27] Для размещения арбускул в клетке-хозяине требуются серьезные изменения. Вакуоли сжимаются, а другие клеточные органеллы размножаются. Цитоскелет растительной клетки реорганизуется вокруг арбускул.
Есть два других типа гиф, которые происходят из колонизированного корня растения-хозяина. После того, как колонизация произошла, короткоживущие побеговые гифы вырастают из корня растения в почву. Это гифы, которые поглощают фосфор и микроэлементы, которые передаются растению. Гифы грибов AM имеют высокое отношение поверхности к объему, что делает их поглощающую способность большей, чем у корней растений. [31] Гифы AMF также тоньше корней и могут проникать в поры почвы, недоступные для корней. [32] Четвертый тип гиф AMF вырастает из корней и колонизирует другие корни растения-хозяина. Четыре типа гиф морфологически различны. [21]
Грибы AM являются облигатными симбионтами . Они имеют ограниченную сапробную способность и зависят от растения в плане углеродного питания. [33] Грибы AM усваивают продукты фотосинтеза растения-хозяина в виде гексоз .
Перенос углерода от растения к грибам может происходить через арбускулы или внутрирадикальные гифы. [34] Вторичный синтез из гексоз АМ происходит в внутрирадикальном мицелии . Внутри мицелия гексоза превращается в трегалозу и гликоген . Трегалоза и гликоген являются формами хранения углерода, которые могут быстро синтезироваться и расщепляться и могут буферизировать внутриклеточные концентрации сахара. [34] Внутрирадикальная гексоза входит в окислительный пентозофосфатный путь , который производит пентозу для нуклеиновых кислот.
Биосинтез липидов также происходит в внутрирадикальном мицелии. Затем липиды хранятся или экспортируются в внерадикальные гифы, где они могут храниться или метаболизироваться. Распад липидов на гексозы, известный как глюконеогенез , происходит в внерадикальном мицелии. [34] Примерно 25% углерода, перемещенного из растения в грибы, хранится в внерадикальных гифах. [35] До 20% углерода растения-хозяина может быть передано грибам AM. [34] Это представляет собой значительные инвестиции углерода растения-хозяина в микоризную сеть и вклад в подземный органический пул углерода.
Увеличение поступления углерода от растений к грибам AM увеличивает поглощение и перенос фосфора от грибов к растению. [36] Аналогичным образом, поглощение и перенос фосфора снижаются, когда уменьшается количество фотосинтата , поставляемого грибам. Виды AMF различаются по своей способности снабжать растение фосфором. [37] В некоторых случаях арбускулярные микоризы являются плохими симбионтами, обеспечивая мало фосфора, забирая относительно большое количество углерода. [37]
Основное преимущество микоризы для растений заключается в повышенном усвоении питательных веществ, особенно фосфора. Это может быть связано с увеличенной площадью поверхности, контактирующей с почвой, повышенным перемещением питательных веществ в микоризу, измененной корневой средой и увеличенным хранением. [32] Микориза может быть намного более эффективной, чем корни растений, в усвоении фосфора. Фосфор перемещается к корню или через диффузию, а гифы сокращают расстояние, необходимое для диффузии, тем самым увеличивая усвоение. Скорость поступления фосфора в микоризу может быть в шесть раз выше, чем у корневых волосков. [32] В некоторых случаях роль усвоения фосфора может быть полностью взята на себя микоризной сетью, и весь фосфор растения может иметь гифальное происхождение. [37] Меньше известно о роли азотного питания в арбускулярной микоризной системе и его влиянии на симбиоз и сообщество. Несмотря на значительные успехи в выяснении механизмов этого сложного взаимодействия, предстоит еще провести много исследований.
Активность микоризы увеличивает концентрацию фосфора, доступного в ризосфере . Микориза снижает pH корневой зоны путем избирательного поглощения NH 4 + ( ионов аммония ) и высвобождения ионов H + . Снижение pH почвы увеличивает растворимость осадков фосфора. Поглощение гифами NH 4 + также увеличивает поток азота к растению, поскольку внутренние поверхности почвы поглощают аммоний и распределяют его путем диффузии. [35]
Грибы AM считались бесполыми , поскольку у них отсутствуют наблюдаемые половые структуры. [38] Однако было обнаружено, что гомологи 51 гена, функционирующего в мейозе , включая семь специфичных для мейоза генов, сохраняются в геномах нескольких видов AMF, что позволяет предположить, что эти предположительно древние бесполые грибы могут быть способны к обычному мейозу. [39] Кроме того, у Rhizophagus irregularis был обнаружен генетический обмен, включающий взаимную рекомбинацию , в дикарионах между гаплоидными геномами. [38]
Недавние исследования показали, что грибы AM выделяют диффузионный фактор, известный как фактор myc , который активирует индуцируемый ген фактора клубенькового образования MtEnod11. Это тот же ген, который участвует в установлении симбиоза с азотфиксирующими ризобиальными бактериями ( Kosuta et al. 2003). Фактор был впервые идентифицирован Фабьеной Майе и ее коллегами [40] в новаторской работе, опубликованной в Nature, где они извлекли триста литров микоризированных корней моркови и экссудатов из 40 миллионов прорастающих спор Rhizophagus irregularis и очистили активную фракцию. Они продемонстрировали, что этот активный принцип по своей природе является липохитоолигосахаридом.
Распознавание факторов Myc запускает общий симбиотический сигнальный путь (CSSP), который в конечном итоге приводит к программе адаптации растения, которая позволяет ему стать заложником арбускулярной микоризы.

Общий симбиотический сигнальный путь (CSSP) — это каскад сигналов в растениях, который, как было замечено, активируется как при восприятии NOD-фактора ( для клубеньковых ризобий ), так и при восприятии MYC-фактора, который высвобождается из грибов арбускулярной микоризы. Путь отличается от путей распознавания патогенов , но может иметь некоторые общие рецепторы, участвующие как в распознавании патогенов, так и в CSSP. Недавняя работа [41] Кевина Коупа и коллег показала, что, возможно, другой тип микоризы может включать компоненты CSSP, такие как распознавание Myc-фактора.
Колонизация AMF требует следующей цепочки [42] событий, которую можно грубо разделить на следующие этапы:
Грибы арбускулярной микоризы чаще всего встречаются в растениях, растущих на минеральных почвах, и имеют чрезвычайно важное значение для растений, растущих на субстратах с дефицитом питательных веществ, таких как вулканическая почва и песчаные дюны . Популяции грибов AM наиболее велики в растительных сообществах с высоким разнообразием, таких как тропические леса и луга умеренного климата, где у них много потенциальных растений-хозяев, и они могут воспользоваться своей способностью колонизировать широкий спектр хозяев. [43] В очень засушливых или богатых питательными веществами почвах частота микоризной колонизации ниже. Микоризы наблюдались в водных местообитаниях ; однако было показано, что заболоченные почвы снижают колонизацию у некоторых видов. [43] Грибы арбускулярной микоризы встречаются в 80% видов растений [44] и были обследованы на всех континентах, кроме Антарктиды. [45] [46] Биогеография гломеромицетов зависит от ограничений распространения, [47] факторов окружающей среды, таких как климат, [45] почвенные серии и pH почвы, [46] питательные вещества почвы [48] и растительное сообщество. [45] [49] Хотя данные 2000 года свидетельствуют о том, что грибы AM не являются специалистами по видам своих хозяев, [50] исследования 2002 года показали, что по крайней мере некоторые таксоны грибов являются специалистами по видам хозяев. [51] Экология грибов мукоромикотиниевых, которые образуют арбускулярные микоризы с «тонкими корневыми эндофитами», в значительной степени неизвестна.
Специфичность, диапазон хозяев и степень колонизации микоризных грибов трудно анализировать в полевых условиях из-за сложности взаимодействий между грибами в корне и в системе. Нет четких доказательств того, что арбускулярные микоризные грибы проявляют специфичность к колонизации потенциальных видов растений-хозяев AM, как это делают грибковые патогены к своим растениям-хозяевам. [43] Это может быть связано с противоположным селективным давлением.
В патогенных отношениях растение-хозяин извлекает выгоду из мутаций, которые предотвращают колонизацию, тогда как в мутуалистических симбиотических отношениях растение извлекает выгоду из мутаций, которые допускают колонизацию AMF. [43] Однако виды растений различаются по степени и зависимости от колонизации определенными AM-грибами, и некоторые растения могут быть факультативными микотрофами , в то время как другие могут быть облигатными микотрофами. [43] Недавно микоризный статус был связан с распространением растений, [52] при этом облигатные микоризные растения занимают более теплые и сухие местообитания, в то время как факультативные микоризные растения занимают более широкие диапазоны местообитаний.
Способность одних и тех же АМ-грибов колонизировать многие виды растений имеет экологические последствия. Растения разных видов могут быть связаны под землей с общей мицелиальной сетью. [43] Одно растение может предоставлять фотосинтезированный углерод для создания мицелиальной сети, которую другое растение другого вида может использовать для поглощения минералов. Это подразумевает, что арбускулярные микоризы способны уравновешивать подземные внутри- и межвидовые взаимодействия растений. [43]
Поскольку грибы Glomeromycota живут внутри корней растений, они могут существенно зависеть от своего хозяина-растения и в свою очередь также влиять на растительные сообщества. Растения могут выделять до 30% углерода фотосинтеза грибам AM [53] , а грибы AM в свою очередь могут получать до 80% растительного фосфора и азота. [44] Разнообразие грибковых сообществ AM положительно связано с разнообразием растений, [54] производительностью растений [55] и травоядностью. [56] На грибы арбускулярной микоризы могут влиять мелкомасштабные взаимодействия с местным растительным сообществом. Например, растительное соседство вокруг фокального растения может изменять грибковые сообщества AM [57] , как и порядок установления растений на участках. [58]
Во время вторжений видов растений сообщество и биомасса грибов AM могут кардинально измениться. В большинстве случаев биомасса и разнообразие грибов AM уменьшаются при вторжениях. [59] [60] [61] Однако некоторые виды микотрофных растений могут фактически увеличить разнообразие грибов AM во время вторжения. [62]
Микоризный статус инвазивных видов растений часто варьируется в зависимости от региона. Например, в Соединенном Королевстве и Центральной Европе в последнее время инвазивные растения чаще оказываются облигатно микоризными, чем ожидалось, [52] [63], в то время как инвазивные растения в Калифорнии оказались менее часто микоризными, чем ожидалось. [64]
Все симбионты в пределах растения-хозяина взаимодействуют, часто непредсказуемым образом. Метаанализ 2010 года показал, что растения, колонизированные как грибами AM, так и вертикально переданными эндофитами, часто крупнее растений, колонизированных этими симбионтами независимо. [65] Однако эта связь зависит от контекста, поскольку грибы AM могут взаимодействовать синергически с грибковыми эндофитами, населяющими листья их растения-хозяина, [66] [67] или антагонистически. [68] [69] [70] Аналогичные диапазоны взаимодействий могут происходить между грибами AM и эктомикоризными грибами и темными септированными эндофитами . [71]
Грибы арбускулярной микоризы различаются в зависимости от многих градиентов окружающей среды . Известно, что их толерантность к замораживанию и высыханию меняется между таксонами грибов AM. [72] Грибы AM становятся менее распространенными и разнообразными при более высоких концентрациях питательных веществ и влаги в почве, [73] предположительно потому, что и растения выделяют меньше углерода грибам AM, и грибы AM перераспределяют свои ресурсы во внутрикорневые гифы в этих условиях окружающей среды. [74] В долгосрочной перспективе эти условия окружающей среды могут даже создавать локальную адаптацию между растениями-хозяевами, грибами AM и местной концентрацией питательных веществ в почве. [75] Состав AM часто становится менее разнообразным на вершинах гор, чем на более низких высотах, что обусловлено составом видов растений. [76]
Было показано, что грибы AM улучшают устойчивость растений к абиотическим факторам окружающей среды, таким как соленость . Они смягчают солевой стресс и способствуют росту и продуктивности растений. [77]
Ризосфера — это зона почвы в непосредственной близости от корневой системы.
Арбускулярный микоризный симбиоз влияет на сообщество и разнообразие других организмов в почве. Это можно увидеть напрямую по выделению экссудатов или косвенно по изменению вида растения, типа и количества растительных экссудатов. [78]
Разнообразие микоризы, как было показано, увеличивает разнообразие видов растений по мере увеличения потенциального числа ассоциаций. Доминирующие арбускулярные микоризные грибы могут предотвратить вторжение немикоризных растений на землю, где они установили симбиоз и способствуют их микоризному хозяину. [79]
Когда в почве присутствуют бактерии ризобиума, микоризная колонизация увеличивается из-за увеличения концентрации химических сигналов, участвующих в установлении симбиоза (Xie et al. 2003). Молекулы, похожие на Nod-факторы, были выделены из грибов AM и, как было показано, индуцируют MtEnod11, образование боковых корней и усиливают микоризацию. [80] Эффективная микоризная колонизация может также увеличить образование клубеньков и симбиотическую фиксацию азота в микоризных бобовых. [35]
Степень арбускулярной микоризной колонизации и виды влияют на бактериальную популяцию в ризосфере. [81] Бактериальные виды различаются по своим способностям конкурировать за углеродные соединения корневых экссудатов. Изменение количества или состава корневых экссудатов и грибковых экссудатов из-за существующей AM микоризной колонизации определяет разнообразие и численность бактериального сообщества в ризосфере. [78]
Влияние грибов AM на рост корней и побегов растений может также иметь косвенное воздействие на бактерии ризосферы. AMF вносит значительное количество углерода в ризосферу через рост и дегенерацию гифальной сети. Также есть данные, позволяющие предположить, что грибы AM могут играть важную роль в опосредовании специфического воздействия видов растений на бактериальный состав ризосферы. [78]
Глобальное изменение климата влияет на сообщества грибов AM и взаимодействие между грибами AM и их растениями-хозяевами. Хотя общепризнанно, что взаимодействие между организмами повлияет на их реакцию на глобальное изменение климата, у нас все еще нет возможности предсказать результат этих взаимодействий в будущих климатических условиях. [82] В недавних метаанализах было обнаружено, что грибы AM увеличивают биомассу растений в условиях засухи и уменьшают биомассу растений в исследованиях с имитацией осаждения азота. [83] [84] Было показано, что сами грибы арбускулярной микоризы увеличивают свою биомассу в ответ на повышенный уровень CO2 в атмосфере . [ 85]
Представители семейства крестоцветных ( Brassicaceae ), такие как капуста, цветная капуста, рапс и крамбе , не образуют на своих корнях грибы арбускулярной микоризы. [86]
За последние десять лет были достигнуты впечатляющие успехи в области молекулярно-генетических технологий и инструментов. Эти достижения позволяют микробным и микоризным экологам задавать новые и захватывающие вопросы об экологических и эволюционных ролях грибов арбускулярной микоризы (AM) как отдельных особей, в сообществах и экосистемах. Генетический анализ грибов AM использовался для изучения генетической структуры отдельных спор с использованием мультилокусного генотипирования, [87] разнообразия грибов AM и адаптации в различных сообществах лугов, [88] вплоть до глобального исследования разнообразия грибов AM, которое значительно увеличило описанное молекулярное разнообразие в пределах типа Glomeromycota. [89]
Все последние достижения в области молекулярной генетики явно позволяют анализировать микробные сообщества в гораздо более тонких и функциональных масштабах и потенциально с большей уверенностью, чем предыдущие методы. Классический метод идентификации грибов AM путем извлечения спор из почвы и дальнейшего морфологического анализа спор [90] чреват сложными проблемами из-за различных стратегий и форм грибов AM, например, отсутствие споруляции у определенных видов, сезонность, высокая некультивируемость, возможная неправильная идентификация (человеческая ошибка) и новые доказательства многоядерных спор [91] и высокой генетической изменчивости внутри клональных видов AM. [92] Из-за этих различных проблем в прошлом исследователи, вероятно, искажали истинный состав грибковых сообществ AM, присутствующих в любой момент времени или в любом месте. Кроме того, следуя традиционным методам извлечения, культивирования и микроскопической идентификации, нет способа определить активные/функционирующие популяции грибов AM, которые, вероятно, являются наиболее важными при попытке связать симбиотические взаимодействия и механизмы растений и AM с экологической или экосистемной функцией. Это особенно верно в случае анализа колонизации корней, который может определить процент корней, колонизированных грибами AM. Основная проблема с этим анализом возникает в полевых почвах, которые содержат несколько видов грибов AM в ассоциации с целевым растением одновременно (см. Экология AM). Идентификация связанных грибковых симбионтов невозможна без использования молекулярных методов. Хотя генетический анализ сообществ грибов AM значительно продвинулся за последнее десятилетие, методология еще не полностью усовершенствована. Ниже приведен обзор методов, используемых в молекулярно-генетическом анализе грибов AM, а также приложения к исследованиям, будущие направления и некоторые из их проблем.
Генетический анализ грибов AM из образцов почвы и корней варьируется по своей применимости для ответа на экологические или филогенетические вопросы. Анализ ДНК использует различные ядерные маркеры для описания грибов AM и представляет различные области ядерного рибосомного оперона ( 18S рРНК ), обнаруженного во всех эукариотических организмах. Анализ ДНК грибов AM с использованием этих маркеров начался в начале 1990-х годов [93] и продолжает развиваться сегодня. Ген малой субъединицы (SSU) рРНК, ген внутреннего транскрибируемого спейсера ( ITS ) и ген большой субъединицы (LSU) рРНК в настоящее время являются наиболее распространенными используемыми маркерами ДНК. Область SSU чаще всего использовалась в экологических исследованиях, [94] в то время как области ITS и LSU преимущественно использовались в таксономических конструкциях типа Glomeromycota. [95]
ПЦР в реальном времени или количественная ПЦР (кПЦР) становится общепризнанным методом быстрой амплификации и одновременного количественного определения целевой ДНК грибов АМ из биологических образцов (корней растений или почв). Сравнительно недавние разработки маркеров кПЦР позволяют исследователям изучать относительное обилие видов грибов АМ в корнях в тепличных экспериментах, а также в полевых условиях для идентификации локальных сообществ грибов АМ.
Маркеры qPCR для арбускулярных микоризных грибов будут состоять из специфических праймеров AM и флуоресцентно меченых гидролизных зондов. Эти специфические праймеры AM (обсуждаемые выше) могут быть выбраны исследователем, и это решение обычно принимается в зависимости от поставленного вопроса, доступных ресурсов и готовности устранять неполадки в лаборатории.
Анализ ДНК-микрочипов в настоящее время используется в исследованиях грибов AM для одновременного измерения экспрессии многих генов из целевых видов или экспериментальных образцов. Наиболее распространенным инструментом или методом является использование технологии функциональных генных массивов (FGA), специализированного микрочипа, который содержит зонды для генов, которые функционально важны в микробных процессах, таких как цикл углерода, азота или фосфора. FGA обладают способностью одновременно исследовать множество функциональных генов. [96] Этот метод обычно используется для общего анализа функциональных микробных генов, но при дополнении его генетическим секвенированием можно сделать выводы о связи между составом грибкового сообщества и микробной функциональностью.
Конкретные химические сигнатуры организмов могут быть использованы для обнаружения биомассы более скрытных организмов, таких как грибы AM или почвенные бактерии. Липиды, а точнее фосфолипиды и нейтральные липиды, содержат жирные кислоты, соединенные с глицериновым остовом. Состав жирных кислот организмов варьируется, и пропорции определенных жирных кислот могут быть специфичными для организма. Например, в грибах AM пропорция жирных кислот, 16:1ω5 и 18:1ω7, в фосфолипидной части составляет приблизительно 58% от общего состава жирных кислот. [97] Жирная кислота, 16:1ω5, является наиболее часто используемой кислотой для характеристики грибов AM в почвах и может использоваться в качестве сильного индикатора мицелиальной биомассы в образце почвы. [97]
Анализ жирных кислот нейтральных липидов грибов AM обычно рассматривается как метод определения запаса энергии, но, что наиболее важно, соотношение NLFA (16:1ω5) к PLFA (16:1ω5) может потенциально использоваться для определения пищевого статуса грибов AM в почвах. Энергия в основном хранится в грибах AM в виде нейтральных липидов в структурах хранения, таких как споры и везикулы. Благодаря этому NLFA довольно хорошо коррелирует с количеством спор в данном объеме почвы. [97] Соотношение концентрации NLFA к концентрации PLFA (активный мицелий) может затем дать долю углерода, выделенную для структур хранения (спор, измеряемых как NLFA).
Проблемы с анализом жирных кислот липидов включают неполную специфичность жирных кислот к грибам AM, видо- или родоспецифические вариации в составе жирных кислот могут усложнить анализ в системах с несколькими видами грибов AM (например, полевая почва), высокие фоновые уровни концентрации определенных жирных кислот в почвах и то, что фосфолипиды коррелируют с площадью мембраны организма, а соотношение поверхности к объему может широко варьироваться между такими организмами, как бактерии и грибы. [98] Необходимо провести дополнительную работу для определения эффективности этого метода в полевых почвах со многими родами и видами грибов AM, чтобы выявить способность метода различать множество различных составов жирных кислот.
Одной из перспектив будущего анализа грибов AM является использование зондов стабильных изотопов. Зондирование стабильных изотопов ( SIP ) — это метод, который может быть использован для определения активной метаболической функции отдельных таксонов в сложной системе микробов. Этот уровень специфичности, связывающий микробную функцию и филогенетику, ранее не был достигнут в микробной экологии. Этот метод также может быть использован независимо от классических методов культивирования в микробной экологии, позволяя проводить анализ функциональных микробов in situ . Применение секвенирования одного ядра из спор грибов AM также было недавно разработано и также обходит необходимость методов культивирования. [99]
SIP, более конкретно ДНК/РНК-основанный SIP, использует субстраты, обогащенные стабильными изотопами, такие как 13 C, 15 N или H 2 18 O, а затем анализирует «меченые» маркеры с использованием видоспецифичных ДНК или РНК-маркеров. [100] Анализ меченой ДНК выполняется путем разделения немеченой и меченой ДНК на градиенте хлорида цезия, сформированном в ультрацентрифуге. [101] Поскольку все микробные организмы способны импортировать воду в свои клетки, использование зондирования стабильным изотопом H 2 18 O является очень интересным новым методом, который может пролить свет на вопросы, на которые микробные экологи и биологи боролись в течение многих лет, в частности, какие активные микробные организмы находятся в моей системе? Метод H 2 18 O, или тяжелой воды, будет нацелен на все организмы, которые активно растут, и окажет незначительное влияние на сам рост. Это особенно актуально для большинства тепличных экспериментов с арбускулярной микоризой, поскольку растения в любом случае необходимо поливать, а вода не отбирает напрямую организмы с определенными метаболическими путями, [101] как это происходит при использовании 13 C и 15 N.
Этот метод пока мало изучен в экспериментах с арбускулярной микоризой, но если его эффективность будет доказана в контролируемом эксперименте, а также при дальнейшем совершенствовании методов анализа ДНК/РНК грибковых сообществ, он может стать жизнеспособным вариантом для очень точного определения активно растущей части видов АМ-грибов в течение вегетационных периодов, с различными растениями-хозяевами или методами обработки, а также в условиях изменения климата.
Сообщалось, что sRNAs играют решающую роль в перекрестных помехах между хозяином и симбионтом. [102] Таким образом, механизм процессинга sRNAs важен для понимания симбиоза AM. Похоже, что грибы AM обладают уникальными особенностями, такими как наличие основного фермента бактериального типа, а также большого количества белков Argonaute в их системе процессинга sRNA (или системе RNAi). [17] Исследование механизма процессинга sRNA и sRNA также является захватывающей темой для понимания симбиоза грибов AM.
Нарушение местных растительных сообществ в районах, подверженных опустыниванию , часто сопровождается деградацией физических и биологических свойств почвы, структуры почвы, доступности питательных веществ и органических веществ. При восстановлении нарушенных земель важно заменить не только надземную растительность, но и биологические и физические свойства почвы. [103]
Относительно новый подход к восстановлению земель заключается в инокуляции почвы грибами AM при повторном введении растительности в проекты по экологическому восстановлению (фиторемедиация). Это позволило растениям-хозяевам обосноваться на деградированной почве и улучшить качество и здоровье почвы . [104] Параметры качества почв значительно улучшились в долгосрочной перспективе, когда была введена смесь местных видов арбускулярных микоризных грибов по сравнению с неинокулированной почвой и почвой, инокулированной одним экзотическим видом грибов AM. [103] Преимуществами были увеличение роста растений, увеличение поглощения фосфора [105] и содержания азота в почве, более высокое содержание органических веществ в почве и агрегация почвы, приписываемая более высокому образованию клубеньков бобовых в присутствии грибов AM, лучшая инфильтрация воды и аэрация почвы из-за агрегации почвы. [103] Местные штаммы грибов AM усиливают извлечение тяжелых металлов из загрязненных почв и делают почву здоровой и пригодной для выращивания сельскохозяйственных культур. [106]
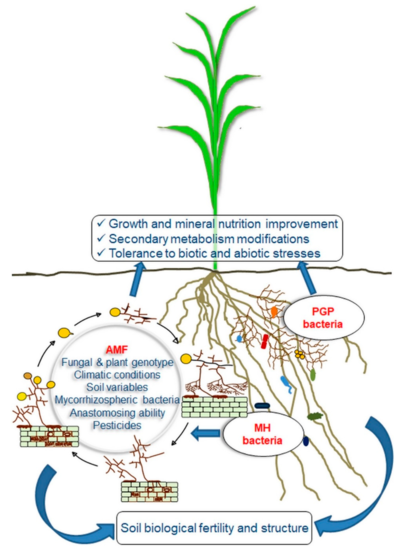
Многие современные агрономические практики нарушают микоризный симбиоз. Существует большой потенциал для сельского хозяйства с низкими затратами, чтобы управлять системой таким образом, чтобы способствовать микоризному симбиозу.
Традиционные методы ведения сельского хозяйства, такие как обработка почвы , внесение тяжелых удобрений и фунгицидов , неправильный севооборот и селекция растений, способных выживать в этих условиях, препятствуют способности растений образовывать симбиоз с грибами арбускулярной микоризы.
Большинство сельскохозяйственных культур могут давать лучшие результаты и быть более продуктивными, если они хорошо колонизированы грибами AM. Симбиоз AM увеличивает поглощение фосфора и микроэлементов, а также рост их растения-хозяина (George et al. 1992).
Борьба с АМ-грибами особенно важна для органических и малозатратных систем земледелия, где уровень фосфора в почве, как правило, низкий, хотя все агроэкосистемы могут выиграть, способствуя образованию арбускулярной микоризы.
Некоторые культуры, которые плохо ищут питательные вещества в почве, очень зависят от грибов AM для поглощения фосфора. Например, лен , который имеет плохую хемотаксическую способность, очень зависит от поглощения фосфора, опосредованного AM, при низких и средних концентрациях фосфора в почве (Thingstrup et al. 1998).
Правильное управление AMF в агроэкосистемах может улучшить качество почвы и производительность земли. Сельскохозяйственные методы, такие как уменьшенная обработка почвы, низкофосфорное использование удобрений и многолетние системы земледелия, способствуют функциональному микоризному симбиозу.
Обработка почвы снижает потенциал инокуляции и эффективность микоризы за счет разрушения внекорневой гифальной сети (Miller et al. 1995, McGonigle & Miller 1999, Mozafar et al. 2000).
Разрывая макроструктуру почвы, гифальная сеть становится неинфекционной (Miller et al. 1995, McGonigle & Miller 1999). Разрушение гифальной сети снижает абсорбционные способности микоризы, поскольку площадь поверхности, охватываемая гифами, значительно сокращается. Это, в свою очередь, снижает поступление фосфора в растения, которые связаны с гифальной сетью (рисунок 3, McGonigle & Miller 1999).
В системе с уменьшенной обработкой почвы внесение тяжелых фосфорных удобрений может не потребоваться по сравнению с системами с тяжелой обработкой почвы. Это связано с увеличением микоризной сети, что позволяет микоризе обеспечивать растение достаточным количеством фосфора (Miller et al. 1995).
Преимущества AMF наиболее выражены в системах с низкими затратами. Интенсивное использование фосфорных удобрений может подавлять микоризную колонизацию и рост.
По мере увеличения уровня фосфора в почве, доступного растениям, количество фосфора в тканях растений также увеличивается, и отток углерода из растения симбиозом АМ-грибов становится невыгодным для растения (Грант, 2005).
Снижение микоризной колонизации из-за высокого уровня фосфора в почве может привести к дефициту у растений других микроэлементов, которые усваиваются через микоризу, например, меди (Тиммер и Лейден, 1980).
Покровные культуры выращивают осенью, зимой и весной, покрывая почву в периоды, когда она обычно остается без покрова растущих растений.
Микоризные покровные культуры можно использовать для улучшения потенциала микоризного инокулята и гифальной сети (Kabir and Koide 2000, Boswell et al. 1998, Sorensen et al. 2005).
Поскольку грибы AM являются биотрофными, они зависят от растений для роста своих гифальных сетей. Выращивание покровной культуры продлевает время роста AM на осень, зиму и весну. Стимулирование роста гиф создает более обширную гифальную сеть. Увеличение микоризной колонизации, обнаруженное в системах покровных культур, может быть в значительной степени связано с увеличением внекорневой гифальной сети, которая может колонизировать корни новой культуры (Boswell et al. 1998). Внекорневой мицелий способен пережить зиму, обеспечивая быструю весеннюю колонизацию и симбиоз в начале сезона (McGonigle and Miller 1999). Этот ранний симбиоз позволяет растениям использовать хорошо налаженную гифальную сеть и получать достаточное фосфорное питание во время раннего роста, что значительно повышает урожайность.
Восстановление местных АМ-грибов повышает успешность проектов по экологической реставрации и скорость восстановления почвы. [103] АМ-грибы повышают стабильность почвенных агрегатов за счет производства внекорневых гиф и почвенного белка, известного как гломалин .
Гломалин-связанные почвенные белки (GRSP) были идентифицированы с использованием моноклонального антитела (Mab32B11), полученного против измельченных спор AMF. Он определяется условиями его экстракции и реакцией с антителом Mab32B11.
Существуют и другие косвенные доказательства того, что гломалин имеет грибковое происхождение AM. Когда грибки AM удаляются из почвы путем инкубации почвы без растений-хозяев, концентрация GRSP снижается. Аналогичное снижение GRSP также наблюдалось в инкубированных почвах лесных, облесенных и сельскохозяйственных земель [108] и лугов, обработанных фунгицидом. [109]
Предполагается, что гломалин улучшает водоустойчивость почвенных агрегатов и уменьшает эрозию почвы . Была обнаружена сильная корреляция между GRSP и водоустойчивостью почвенных агрегатов в самых разных почвах, где органический материал является основным связующим агентом, хотя механизм неизвестен. [109] Белок гломалин еще не был выделен и описан, а связь между гломалином, GRSP и грибами арбускулярной микоризы пока не ясна. [109]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )