
Размер генома — это общее количество ДНК, содержащейся в одной копии одного полного генома . Обычно он измеряется в единицах массы в пикограммах (триллионных долях (10−12 ) грамма , сокращенно пг) или реже в дальтонах , или как общее количество пар нуклеотидных оснований , обычно в мегабазах (миллионы пар оснований, сокращенно Мб или Мбп). Один пикограмм равен 978 мегабазам. [1] В диплоидных организмах размер генома часто используется взаимозаменяемо с термином C-value .
Сложность организма не прямо пропорциональна размеру его генома; общее содержание ДНК широко варьируется между биологическими таксонами. Некоторые одноклеточные организмы имеют гораздо больше ДНК, чем люди, по причинам, которые остаются неясными (см. некодирующая ДНК и загадка C-значения ).

Термин «размер генома» часто ошибочно приписывается статье Ральфа Хайнегарднера 1976 года [2], даже в обсуждениях, посвященных конкретно терминологии в этой области исследований (например, Greilhuber 2005 [3] ). Примечательно, что Хайнегарднер [2] использовал этот термин только один раз: в названии. На самом деле, термин, по-видимому, впервые появился в 1968 году, когда Хайнегарднер в последнем абзаце другой статьи задался вопросом, «действительно ли содержание клеточной ДНК отражает размер генома». [4] В этом контексте «размер генома» использовался в смысле генотипа для обозначения количества генов .
В статье, представленной всего два месяца спустя, Вольф и др. (1969) [5] использовали термин «размер генома» повсеместно и в его нынешнем значении; поэтому этим авторам, вероятно, следует отдать должное за создание термина в его современном значении. К началу 1970-х годов «размер генома» был в общем употреблении с его нынешним определением, вероятно, в результате его включения в влиятельную книгу Сусуму Оно «Эволюция путем дупликации генов» , опубликованную в 1970 году. [6]
С появлением различных молекулярных методов за последние 50 лет были проанализированы размеры геномов тысяч эукариот , и эти данные доступны в онлайн-базах данных для животных, растений и грибов (см. внешние ссылки). Размер ядерного генома эукариот обычно измеряется с помощью денситометрических измерений ядер, окрашенных по Фельгену (ранее с использованием специализированных денситометров, теперь чаще с использованием компьютерного анализа изображений [7] ) , или проточной цитометрии . У прокариот преобладающими методами определения размера генома являются пульсирующий гель-электрофорез и полное секвенирование генома .
Хорошо известно, что размеры ядерного генома сильно различаются среди эукариотических видов. У животных они варьируются более чем в 3300 раз, а у наземных растений они различаются примерно в 1000 раз. [8] [9] Сообщалось, что геномы протистов различаются более чем в 300 000 раз по размеру, но верхняя граница этого диапазона ( амеба ) была поставлена под сомнение. [ кем? ] У эукариот (но не прокариот) размер генома не пропорционален количеству генов , присутствующих в геноме, наблюдение, которое считалось полностью противоречащим интуиции до открытия некодирующей ДНК и которое в результате стало известно как « парадокс C-значения ». Однако, хотя больше нет никакого парадоксального аспекта в несоответствии между размером генома и числом генов, этот термин остается общеупотребительным. В целях концептуальной ясности один из авторов предложил вместо этого точнее назвать различные загадки, которые остаются в отношении вариации размера генома, головоломкой или энигмой (так называемой « загадкой C-значения »).
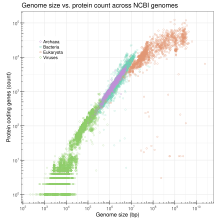
Размер генома коррелирует с рядом измеримых характеристик на уровне клетки и организма, включая размер клетки, скорость деления клетки и, в зависимости от таксона , размер тела, скорость метаболизма , скорость развития, сложность органов , географическое распределение или риск вымирания . [8] [9] На основании имеющихся в настоящее время полностью секвенированных данных генома (по состоянию на апрель 2009 года) логарифмически преобразованное число генов образует линейную корреляцию с логарифмически преобразованным размером генома у бактерий, архей, вирусов и органелл вместе взятых, тогда как для эукариот наблюдается нелинейная (полунатуральная логарифмическая) корреляция. [10] Хотя последнее противоречит предыдущему мнению, что для эукариот не существует корреляции, наблюдаемая нелинейная корреляция для эукариот может отражать непропорционально быстрое увеличение некодирующей ДНК во все более крупных эукариотических геномах. Хотя данные о секвенированных геномах на практике смещены в сторону небольших геномов, что может поставить под угрозу точность эмпирически полученной корреляции, и окончательное доказательство корреляции еще предстоит получить путем секвенирования некоторых из крупнейших эукариотических геномов, текущие данные, по-видимому, не исключают возможную корреляцию.

У людей общий женский диплоидный ядерный геном на клетку составляет 6,37 пар гигабаз (Гбн), имеет длину 208,23 см и весит 6,51 пикограмм (пг). [11] Мужские значения составляют 6,27 Гбн, 205,00 см, 6,41 пг. [11] Каждый полимер ДНК может содержать сотни миллионов нуклеотидов, например, в хромосоме 1. Хромосома 1 является самой большой человеческой хромосомой с приблизительно 220 миллионами пар оснований и будетДлина 85 мм в выпрямленном виде. [12]
У эукариот , в дополнение к ядерной ДНК , есть также митохондриальная ДНК (мтДНК), которая кодирует определенные белки, используемые митохондриями. МтДНК обычно относительно мала по сравнению с ядерной ДНК. Например, человеческая митохондриальная ДНК образует замкнутые кольцевые молекулы, каждая из которых содержит 16 569 [13] [14] пар оснований ДНК, [15] причем каждая такая молекула обычно содержит полный набор митохондриальных генов. Каждая человеческая митохондрия содержит в среднем около 5 таких молекул мтДНК. [15] Каждая клетка человека содержит приблизительно 100 митохондрий, что дает общее количество молекул мтДНК на клетку человека около 500. [15] Однако количество митохондрий на клетку также варьируется в зависимости от типа клеток, и яйцеклетка может содержать 100 000 митохондрий, что соответствует до 1 500 000 копий митохондриального генома (составляющего до 90% ДНК клетки). [16]
Редукция генома , также известная как деградация генома , — это процесс, при котором геном организма уменьшается по сравнению с геномом его предков. Геномы регулярно колеблются в размерах, и уменьшение размера генома наиболее существенно у бактерий .
Наиболее эволюционно значимые случаи редукции генома можно наблюдать в эукариотических органеллах, которые, как известно, произошли от бактерий: митохондриях и пластидах . Эти органеллы произошли от первичных эндосимбионтов , которые были способны выживать внутри клетки-хозяина и которые также были необходимы клетке-хозяину для выживания. Многие современные митохондрии имеют менее 20 генов во всем геноме, тогда как современная свободноживущая бактерия обычно имеет не менее 1000 генов. Многие гены, по-видимому, были перенесены в ядро хозяина , в то время как другие просто были утеряны, и их функция была заменена процессами хозяина.
Другие бактерии стали эндосимбионтами или облигатными внутриклеточными патогенами и в результате испытали обширную редукцию генома. Этот процесс, по-видимому, доминирует в генетическом дрейфе , вызванном небольшим размером популяции , низкими показателями рекомбинации и высокими показателями мутаций , в отличие от отбора в пользу меньших геномов. [ необходима цитата ] Некоторые свободноживущие морские бактериопланктоны также демонстрируют признаки редукции генома, которые, как предполагается, вызваны естественным отбором. [17] [18] [19]
Облигатные эндосимбиотические виды характеризуются полной неспособностью выживать вне среды своего хозяина . Эти виды стали значительной угрозой для здоровья человека, поскольку они часто способны уклоняться от иммунной системы человека и манипулировать средой хозяина для получения питательных веществ. Распространенным объяснением этих манипулятивных способностей является их последовательно компактная и эффективная геномная структура. Эти небольшие геномы являются результатом огромных потерь посторонней ДНК, явление, которое связано исключительно с потерей свободноживущей стадии. До 90% генетического материала может быть потеряно, когда вид совершает эволюционный переход от свободноживущего к облигатному внутриклеточному образу жизни. Во время этого процесса будущий паразит подвергается воздействию среды, богатой метаболитами, где каким-то образом необходимо спрятаться внутри клетки хозяина, эти факторы уменьшают сохранение и увеличивают генетический дрейф, что приводит к ускорению потери несущественных генов. [20] [21] [22] Распространенные примеры видов с сокращенными геномами включают Buchnera aphidicola , Rickettsia prowazekii и Mycobacterium leprae . Один облигатный эндосимбионт цикадовых , Nasuia deltocephalinicola , имеет наименьший геном, известный в настоящее время среди клеточных организмов, в 112 кб. [23] Несмотря на патогенность большинства эндосимбионтов, некоторые облигатные внутриклеточные виды оказывают положительное влияние на приспособленность своих хозяев.
Модель редуктивной эволюции была предложена как попытка определить геномные общности, наблюдаемые у всех облигатных эндосимбионтов. [24] Эта модель иллюстрирует четыре общие черты редуцированных геномов и облигатных внутриклеточных видов:
На основе этой модели становится ясно, что эндосимбионты сталкиваются с иными адаптивными проблемами, чем свободно живущие виды, и, как показал анализ между различными паразитами, их генетические инвентари чрезвычайно различаются, что приводит нас к выводу, что миниатюризация генома следует разным моделям для разных симбионтов. [26] [27] [28]
или просто:
В 1991 году Джон В. Дрейк предложил общее правило: скорость мутаций в геноме и его размер обратно пропорциональны. [29] Было обнаружено, что это правило приблизительно верно для простых геномов, таких как геномы ДНК-вирусов и одноклеточных организмов. Его основа неизвестна.
Было высказано предположение, что малый размер РНК-вирусов заперт в трехчастном соотношении между точностью репликации, размером генома и генетической сложностью. Большинство РНК-вирусов не имеют возможности корректуры РНК, что ограничивает точность их репликации и, следовательно, размер их генома. Это также было описано как «парадокс Эйгена». [30] Исключение из правила малых размеров генома у РНК-вирусов обнаружено у нидовирусов . Эти вирусы, по-видимому, приобрели 3′-5′ экзорибонуклеазу (ExoN), что позволило увеличить размер генома. [31]
В 1972 году Майкл Дэвид Беннетт [32] выдвинул гипотезу о наличии корреляции между содержанием ДНК и объемом ядра, в то время как Коммонер , Вант-Хофф и Спарроу до него постулировали, что даже размер клетки и длина клеточного цикла контролируются количеством ДНК. [33] [34] Более поздние теории заставили нас обсудить возможность наличия механизма, который физически ограничивает развитие генома до оптимального размера. [35]
Эти объяснения были оспорены в статье Кавальер-Смита [36] , где автор указал, что способ понимания связи между размером генома и объемом клетки был связан со скелетной теорией. Ядро этой теории связано с объемом клетки, определяемым балансом адаптации между преимуществами и недостатками большего размера клетки, оптимизацией соотношения ядро:цитоплазма (кариоплазматическое соотношение) [37] [38] и концепцией, что более крупные геномы более склонны к накоплению дублирующих транспозонов как следствие более высокого содержания некодирующей скелетной ДНК. [36] Кавальер-Смит также предположил, что в качестве последующей реакции сокращения клетки ядро будет более склонно к отбору в пользу делеции по сравнению с дупликацией. [36]
С экономической точки зрения, поскольку фосфор и энергия редки, уменьшение ДНК всегда должно быть в центре внимания эволюции, если только не будет приобретена выгода. Случайное удаление будет тогда в основном вредным и не будет выбрано из-за снижения приобретенного приспособления, но иногда устранение будет также выгодным. Этот компромисс между экономией и накоплением некодирующей ДНК является ключом к поддержанию кариоплазматического соотношения.
Основной вопрос, стоящий за процессом миниатюризации генома, заключается в том, происходит ли это большими шагами или из-за постоянной эрозии содержимого гена. Чтобы оценить эволюцию этого процесса, необходимо сравнить предковый геном с тем, где предположительно произошло сокращение. Благодаря сходству содержимого генов Buchnera aphidicola и кишечных бактерий Escherichia coli , 89% идентичности для 16S рДНК и 62% для ортологичных генов стало возможным пролить свет на механизм миниатюризации генома. [39] Геном эндосимбионта B. aphidicola характеризуется размером генома, который в семь раз меньше, чем у E. coli (643 кб по сравнению с 4,6 Мб) [40] [41] и может рассматриваться как подмножество генного инвентаря кишечных бактерий. [41] Из сопоставления двух геномов выяснилось, что некоторые гены сохраняются как частично деградировавшие. [41] что указывает на то, что функция была утрачена во время процесса и что последующие события эрозии сократили длину, как это было задокументировано у Rickettsia . [42] [43] [44] Эта гипотеза подтверждается анализом псевдогенов Buchnera , где число делеций было более чем в десять раз выше по сравнению со вставками. [44]
У Rickettsia prowazekii , как и у других бактерий с малым геномом, этот мутуалистический эндосимбионт испытал значительное снижение функциональной активности, за исключением того, что другие паразиты все еще сохраняют биосинтетическую способность к производству аминокислот, необходимых их хозяину. [45] [46] [41] Общими эффектами сокращения генома между этим эндосимбионтом и другими паразитами являются снижение способности производить фосфолипиды, репарацию и рекомбинацию, а также общее преобразование состава гена в более богатое содержание AT [47] из-за мутаций и замен. [20] [45] Доказательством делеции функции репарации и рекомбинации является потеря гена rec A, гена, участвующего в пути рекомбиназы . Это событие произошло во время удаления более крупной области, содержащей десять генов, в общей сложности почти 10 кб. [41] [45] Та же вера произошла с генами uvr A, uvr B и uvr C, кодирующими ферменты эксцизии, участвующие в восстановлении поврежденной ДНК из-за воздействия УФ-излучения. [39]
Одним из наиболее вероятных механизмов для объяснения сокращения генома является хромосомная перестройка, поскольку вставка/делеция большей части последовательности легче наблюдается во время гомологичной рекомбинации по сравнению с незаконной, поэтому распространение транспонируемых элементов положительно скажется на скорости делеции. [36] Потеря этих генов на ранних стадиях миниатюризации не только выполняет эту функцию, но и должна играть роль в эволюции последующих делеций. Доказательства того факта, что более крупное событие удаления произошло до более мелкой делеции, появились из сравнения генома Bucknera и реконструированного предка, где гены, которые были утрачены, на самом деле не случайным образом разбросаны в гене предка, а агрегированы, и отрицательной связи между числом утраченных генов и длиной спейсеров. [39] Событие небольших локальных инделей играет незначительную роль в редукции генома [48], особенно на ранних стадиях, когда большее количество генов становится излишним. [49] [39]
Вместо этого единичные события происходили из-за отсутствия давления отбора для сохранения генов, особенно если часть пути утратила свою функцию во время предыдущей делеции. Примером этого является делеция rec F, гена, необходимого для функции rec A, и его фланкирующих генов. [50] Одно из последствий устранения такого количества последовательностей повлияло даже на регуляцию оставшихся генов. Потеря большой части геномов могла фактически привести к потере промоторных последовательностей. Это могло фактически подтолкнуть отбор к эволюции полицистронных областей с положительным эффектом как для уменьшения размера [51] , так и для эффективности транскрипции. [52]
Одним из примеров миниатюризации генома является микроспоридии — анаэробные внутриклеточные паразиты членистоногих, произошедшие от аэробных грибов.
В ходе этого процесса митосомы [53] образовались в результате редукции митохондрий до реликта, лишенного геномов и метаболической активности, за исключением производства железо-серных центров и способности проникать в клетки-хозяева. [54] [55] За исключением рибосом , также миниатюризированных, многие другие органеллы были почти утрачены в процессе формирования наименьшего генома, обнаруженного у эукариот. [36] От своего возможного предка, зигомикотиновых грибов, микроспоридии сократили свой геном, удалив почти 1000 генов, и даже уменьшили размер белка и генов, кодирующих белок. [56] Этот экстремальный процесс стал возможен благодаря выгодному отбору на меньший размер клетки, навязанному паразитизмом.
Другой пример миниатюризации представлен наличием нуклеоморфов , порабощенных ядер, внутри клетки двух разных водорослей, криптофитов и хлорарахнеоз . [57]
Нуклеоморфы характеризуются одним из самых маленьких известных геномов (551 и 380 кб), и, как было отмечено для микроспоридий, некоторые геномы заметно сокращены по длине по сравнению с другими эукариотами из-за фактического отсутствия некодирующей ДНК. [36] Наиболее интересным фактором является сосуществование этих маленьких ядер внутри клетки, содержащей другое ядро, которое никогда не испытывало такого сокращения генома. Более того, даже если клетки-хозяева имеют разные объемы от вида к виду и, как следствие, изменчивость размера генома, нуклеоморф остается инвариантным, что указывает на двойной эффект отбора в пределах одной клетки.
{{cite book}}: |work=проигнорировано ( помощь )