В химии солевой мостик представляет собой комбинацию двух нековалентных взаимодействий : водородной связи и ионной связи (рисунок 1). Ионная пара является одной из важнейших нековалентных сил в химии, в биологических системах, в различных материалах и во многих приложениях, таких как ионно-парная хроматография . Это наиболее часто наблюдаемый вклад в устойчивость энтропийно невыгодной складчатой конформации белков. Хотя известно, что нековалентные взаимодействия являются относительно слабыми взаимодействиями, небольшие стабилизирующие взаимодействия могут суммироваться, чтобы внести важный вклад в общую устойчивость конформера. [1] Солевые мостики встречаются не только в белках, но их также можно найти в супрамолекулярной химии . Термодинамика каждого из них исследуется с помощью экспериментальных процедур для оценки вклада свободной энергии солевого мостика в общую свободную энергию состояния.
В воде образование солевых мостиков или ионных пар в основном обусловлено энтропией, обычно сопровождающейся неблагоприятными вкладами ΔH из-за десольватации взаимодействующих ионов при ассоциации. [2] Водородные связи способствуют стабильности ионных пар , например, с протонированными ионами аммония , а с анионами образуются путем депротонирования, как в случае карбоксилата , фосфата и т. д.; тогда константы ассоциации зависят от pH. Энтропийные движущие силы для образования ионных пар (при отсутствии значительных вкладов водородных связей) также обнаруживаются в метаноле как растворителе. В неполярных растворителях образуются контактные ионные пары с очень высокими константами ассоциации; [3] [4] в газовой фазе энергии ассоциации, например, щелочных галогенидов достигают 200 кДж/моль. [5] Уравнение Бьеррума или Фуосса описывает ассоциацию ионных пар как функцию зарядов ионов zA и zB и диэлектрической проницаемости ε среды; соответствующий график стабильности ΔG против zAzB показывает для более чем 200 ионных пар ожидаемую линейную корреляцию для большого разнообразия ионов. [6] Неорганические, а также органические ионы демонстрируют при умеренной ионной силе I схожие значения ассоциации солевого мостика ΔG около 5-6 кДж/моль для комбинации аниона и катиона 1:1, почти независимо от природы (размера, поляризуемости и т. д.) ионов. [7] [8] Значения ΔG являются аддитивными и приблизительно линейной функцией зарядов, взаимодействие, например, двухзарядного фосфатного аниона с однозарядным катионом аммония составляет около 2x5 = 10 кДж/моль. Значения ΔG зависят от ионной силы I раствора, как описано уравнением Дебая-Хюккеля , при нулевой ионной силе наблюдается ΔG = 8 кДж/моль. Стабильность пар щелочных ионов в зависимости от заряда аниона z можно описать более подробным уравнением. [9]

Солевой мостик чаще всего возникает из анионного карбоксилата (RCOO − ) аспарагиновой или глутаминовой кислоты и катионного аммония (RNH 3 + ) лизина или гуанидиния (RNHC(NH 2 ) 2 + ) аргинина (рисунок 2). [1] Хотя они являются наиболее распространенными, другие остатки с ионизированными боковыми цепями, такие как гистидин , тирозин и серин, также могут участвовать, в зависимости от внешних факторов, нарушающих их pK a . Расстояние между остатками, участвующими в солевом мостике, также упоминается как важное. Требуемое расстояние NO составляет менее 4 Å (400 пм). Аминокислоты, находящиеся дальше этого расстояния, не считаются образующими солевой мостик. [11] Из-за многочисленных ионизированных боковых цепей аминокислот, обнаруженных по всему белку, pH, при котором находится белок, имеет решающее значение для его стабильности.
Солевые мостики также могут образовываться между белком и лигандами малых молекул. Было обнаружено, что более 1100 уникальных комплексов белок-лиганд из Protein Databank образуют солевые мостики со своими белковыми мишенями, что указывает на то, что солевые мостики часто встречаются во взаимодействии лекарств и белков. [12] Они содержат структуры из разных классов ферментов, включая гидролазы, трансферазы, киназы, редуктазу, оксидоредуктазу, лиазы и рецепторы, сопряженные с G-белком (GPCR).

Вклад солевого мостика в общую стабильность свернутого состояния белка можно оценить с помощью термодинамических данных, собранных из исследований мутагенеза и методов ядерного магнитного резонанса. [13] Используя мутированный псевдодикий тип белка, специально мутированный для предотвращения осаждения при высоком pH, вклад солевого мостика в общую свободную энергию свернутого состояния белка можно определить, выполнив точечную мутацию, изменив и, следовательно, разрушив солевой мостик. Например, было установлено, что солевой мостик существует в лизоциме T4 между аспарагиновой кислотой (Asp) в остатке 70 и гистидином (His) в остатке 31 (рисунок 3). Был проведен сайт-направленный мутагенез с аспарагином (Asn) (рисунок 4) с получением трех новых мутантов: Asp70Asn His31 (мутант 1), Asp70 His31Asn (мутант 2) и Asp70Asn His31Asn (двойной мутант).

После того, как мутанты установлены, можно использовать два метода для расчета свободной энергии, связанной с солевым мостиком. Один метод включает наблюдение за температурой плавления дикого типа белка по сравнению с температурой плавления трех мутантов. Денатурацию можно отслеживать по изменению кругового дихроизма . Снижение температуры плавления указывает на снижение стабильности. Это количественно определяется с помощью метода, описанного Бектелем и Шеллманом, где разница свободной энергии между ними рассчитывается через Δ T Δ S . [14] С этим расчетом есть некоторые проблемы, и его можно использовать только с очень точными данными. [ необходима цитата ] В примере с лизоцимом T4 Δ S псевдодикого типа ранее сообщалось при pH 5,5, поэтому разница температур в средней точке 11 °C при этом pH, умноженная на сообщенное Δ S в 360 кал/(моль·K) (1,5 кДж/(моль·K)) дает изменение свободной энергии около −4 ккал/моль (−17 кДж/моль). Это значение соответствует количеству свободной энергии, вносимой в стабильность белка солевым мостиком.

Второй метод использует спектроскопию ядерного магнитного резонанса для расчета свободной энергии солевого мостика. Титрование выполняется с регистрацией химического сдвига, соответствующего протонам углерода, соседствующего с карбоксилатной или аммонийной группой. Средняя точка кривой титрования соответствует p K a или pH, при котором соотношение протонированных: депротонированных молекул составляет 1:1. Продолжая пример с лизоцимом T4, кривая титрования получается путем наблюдения за сдвигом протона C2 гистидина 31 (рисунок 5). На рисунке 5 показан сдвиг в кривой титрования между диким типом и мутантом, в котором Asp70 является Asn. Образованный солевой мостик находится между депротонированным Asp70 и протонированным His31. Это взаимодействие вызывает сдвиг, наблюдаемый в p K a His31 . В развернутом белке дикого типа, где солевой мостик отсутствует, His31, как сообщается, имеет ap K a 6,8 в буферах H 2 O умеренной ионной силы. На рисунке 5 показано ap K a дикого типа 9,05. Эта разница в p K a поддерживается взаимодействием His31 с Asp70. Чтобы сохранить солевой мостик, His31 будет пытаться удерживать свой протон как можно дольше. Когда солевой мостик разрушается, как в мутанте D70N, p K a смещается обратно к значению 6,9, что гораздо ближе к значению His31 в развернутом состоянии.
Разницу в p K a можно количественно оценить, чтобы отразить вклад солевого мостика в свободную энергию. Используя свободную энергию Гиббса : Δ G = − RT ln( K eq ), где R — универсальная газовая постоянная, T — температура в градусах Кельвина, а K eq — константа равновесия реакции в равновесии. Депротонирование His31 — это реакция кислотного равновесия со специальным K eq , известным как константа диссоциации кислоты , K a : His31-H + ⇌ His31 + H + . Затем p K a связано с K a следующим образом: p K a = −log( K a ). Расчет разницы свободной энергии мутанта и дикого типа теперь можно выполнить, используя уравнение свободной энергии, определение p K a , наблюдаемые значения p K a и соотношение между натуральными логарифмами и логарифмами. В примере с лизоцимом Т4 этот подход дал расчетный вклад около 3 ккал/моль в общую свободную энергию. [13] Похожий подход можно применить к другому участнику солевого мостика, такому как Asp70 в примере с лизоцимом Т4, путем отслеживания его сдвига в p K a после мутации His31.
Предостережение при выборе подходящего эксперимента касается расположения солевого мостика внутри белка. Окружающая среда играет большую роль во взаимодействии. [15] При высокой ионной силе солевой мостик может быть полностью замаскирован, поскольку задействовано электростатическое взаимодействие. Солевой мостик His31-Asp70 в лизоциме T4 был зарыт внутри белка. Энтропия играет большую роль в поверхностных солевых мостиках, где остатки, которые обычно имеют возможность двигаться, ограничены их электростатическим взаимодействием и водородными связями. Было показано, что это снижает энтропию достаточно, чтобы почти стереть вклад взаимодействия. [16] Поверхностные солевые мостики можно изучать аналогично зарытым солевым мостикам, используя циклы двойных мутантов и титрование ЯМР. [17] Хотя существуют случаи, когда зарытые солевые мостики способствуют стабильности, как и все остальное, существуют исключения, и зарытые солевые мостики могут оказывать дестабилизирующее действие. [11] Кроме того, поверхностные солевые мостики при определенных условиях могут оказывать стабилизирующее действие. [15] [17] Стабилизирующий или дестабилизирующий эффект должен оцениваться в каждом конкретном случае, и здесь невозможно сделать несколько общих заявлений.

Супрамолекулярная химия — это область, занимающаяся нековалентными взаимодействиями между макромолекулами. Солевые мостики использовались химиками в этой области разнообразными и креативными способами, включая обнаружение анионов, синтез молекулярных капсул и двойных спиральных полимеров.
Основной вклад супрамолекулярной химии был направлен на распознавание и восприятие анионов. [18] [19] [20] [21] [22] [23] Ионная пара является наиболее важной движущей силой комплексообразования анионов, но селективность, например, в ряду галогенидов, была достигнута, в основном, за счет вклада водородных связей.
Молекулярные капсулы — это химические каркасы, предназначенные для захвата и удержания гостевой молекулы (см. молекулярная инкапсуляция ). Шумна и его коллеги разработали новую молекулярную капсулу с хиральным внутренним пространством. [24] Эта капсула состоит из двух половинок, как пластиковое пасхальное яйцо (рисунок 6). Взаимодействие солевых мостиков между двумя половинами заставляет их самоорганизовываться в растворе (рисунок 7). Они стабильны даже при нагревании до 60 °C.
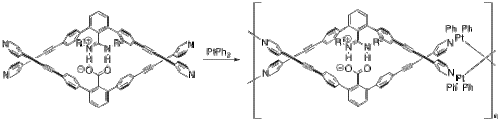
Яшима и его коллеги использовали солевые мостики для создания нескольких полимеров, которые принимают конформацию двойной спирали, очень похожую на ДНК . [25] В одном примере они включили платину для создания двухспирального металлополимера. [26] Начиная с их мономера и бифенила платины (II) (рисунок 8), их металлополимер сам собирается посредством серии реакций обмена лигандами . Две половины мономера закреплены вместе посредством солевого мостика между депротонированным карбоксилатом и протонированными азотами.