Ацетилен ( систематическое название : этин ) — химическое соединение с формулой C2H2 и структурой H−C≡C−H . Это углеводород и простейший алкин . [8] Этот бесцветный газ широко используется в качестве топлива и химического строительного блока. Он нестабилен в чистом виде и поэтому обычно обрабатывается в виде раствора. [9] Чистый ацетилен не имеет запаха, но коммерческие сорта обычно имеют выраженный запах из-за примесей, таких как дивинилсульфид и фосфин . [9] [10]
Как алкин, ацетилен ненасыщен , поскольку два его атома углерода связаны вместе тройной связью . Тройная связь углерод-углерод размещает все четыре атома на одной прямой линии с углами связи CCH 180°. [11]
Ацетилен был открыт в 1836 году Эдмундом Дэви , который определил его как «новый карбюратор водорода». [12] [13] Это было случайное открытие при попытке выделить металлический калий . Нагревая карбонат калия с углеродом при очень высоких температурах, он получил остаток того, что сейчас известно как карбид калия (K 2 C 2 ), который реагировал с водой, выделяя новый газ. Он был заново открыт в 1860 году французским химиком Марселеном Бертло , который придумал название ацетилен . [14] Эмпирическая формула Бертло для ацетилена (C 4 H 2 ), а также альтернативное название « quadricarbure d'hydrogène » (квадрикарбид водорода) были неверными, поскольку многие химики в то время использовали неправильную атомную массу для углерода (6 вместо 12). [15] Бертло смог приготовить этот газ, пропуская пары органических соединений (метанол, этанол и т. д.) через раскаленную докрасна трубку и собирая вытекающий продукт . Он также обнаружил, что ацетилен образуется при искровом разряде электричества через смешанные газы циана и водорода . Позже Бертло получил ацетилен напрямую, пропуская водород между полюсами угольной дуги . [16] [17]
С 1950-х годов ацетилен в основном производился путем частичного сжигания метана в США, большей части ЕС и многих других странах: [9] [18] [19]
Это побочный продукт, получаемый в процессе производства этилена путем крекинга углеводородов . В 1983 году этим методом было произведено около 400 000 тонн. [9] Его присутствие в этилене обычно нежелательно из-за его взрывоопасного характера и способности отравлять катализаторы Циглера-Натта . Он селективно гидрируется в этилен, обычно с использованием катализаторов Pd - Ag . [20]
Самые тяжелые алканы в нефти и природном газе расщепляются на более легкие молекулы, которые дегидрируются при высокой температуре:
Последняя реакция реализуется в процессе анаэробного разложения метана микроволновой плазмой. [21] [ необходим непервичный источник ]
Первый ацетилен был получен Эдмундом Дэви в 1836 году с помощью карбида калия. [22] Исторически ацетилен производился путем гидролиза (реакции с водой) карбида кальция:
Эта реакция была открыта Фридрихом Вёлером в 1862 году [23], но подходящий метод промышленного производства, который позволил бы широко использовать ацетилен, был найден только в 1892 году канадским изобретателем Томасом Уилсоном , который искал жизнеспособный коммерческий метод производства алюминия. [24]
Еще в начале 21 века Китай, Япония и Восточная Европа производили ацетилен преимущественно этим методом. [25]
Использование этой технологии с тех пор сократилось во всем мире, за исключением Китая, с его акцентом на угольную химическую промышленность, по состоянию на 2013 год. В противном случае нефть все больше вытесняет уголь в качестве основного источника восстановленного углерода. [26]
Производство карбида кальция требует высоких температур, ~2000 °C, что требует использования электродуговой печи . В США этот процесс был важной частью революции в химии конца 19 века, которая стала возможной благодаря масштабному проекту гидроэлектростанции на Ниагарском водопаде . [27]
В терминах теории валентных связей , в каждом атоме углерода 2s -орбиталь гибридизуется с одной 2p-орбиталью, образуя таким образом sp-гибрид. Другие две 2p-орбитали остаются негибридизованными. Два конца двух sp-гибридных орбиталей перекрываются, образуя сильную σ-валентную связь между углеродом, в то время как на каждом из двух других концов атомы водорода также присоединяются посредством σ-связей. Две неизмененные 2p-орбитали образуют пару более слабых π-связей . [28]
Поскольку ацетилен является линейной симметричной молекулой , он обладает точечной группой D∞h . [29]
При атмосферном давлении ацетилен не может существовать в жидком состоянии и не имеет точки плавления. Тройная точка на фазовой диаграмме соответствует точке плавления (−80,8 °C) при минимальном давлении, при котором может существовать жидкий ацетилен (1,27 атм). При температурах ниже тройной точки твердый ацетилен может перейти непосредственно в пар ( газ) путем сублимации . Точка сублимации при атмосферном давлении составляет −84,0 °C. [30]
При комнатной температуре растворимость ацетилена в ацетоне составляет 27,9 г на кг. Для того же количества диметилформамида (ДМФ) растворимость составляет 51 г. При 20,26 бар растворимость увеличивается до 689,0 и 628,0 г для ацетона и ДМФ соответственно. Эти растворители используются в баллонах со сжатым газом. [31]
Около 20% ацетилена поставляется промышленностью промышленных газов для кислородно-ацетиленовой газовой сварки и резки из-за высокой температуры пламени. Сгорание ацетилена с кислородом производит пламя с температурой более 3600 К (3330 °C; 6020 °F), выделяя 11,8 кДж /г. Кислород с ацетиленом является самой горячей горящей смесью обычных газов. [32] Ацетилен является третьим по температуре естественным химическим пламенем после дицианоацетилена с температурой 5260 К (4990 °C; 9010 °F) и циана с температурой 4798 К (4525 °C; 8177 °F). Кислородно-ацетиленовая сварка была популярным процессом сварки в предыдущие десятилетия. Развитие и преимущества процессов дуговой сварки сделали кислородно-топливную сварку почти исчезнувшей для многих применений. Использование ацетилена для сварки значительно сократилось. С другой стороны, оборудование для кислородно-ацетиленовой сварки является достаточно универсальным — не только потому, что горелка предпочтительна для некоторых видов сварки железа или стали (как в некоторых художественных приложениях), но и потому, что она легко поддается пайке, пайко-сварке, нагреву металла (для отжига или закалки, гибки или формовки), ослаблению корродированных гаек и болтов и другим применениям. Специалисты по ремонту кабелей Bell Canada по-прежнему используют портативные комплекты горелок, работающих на ацетилене, в качестве паяльного инструмента для герметизации свинцовых муфт в люках и в некоторых местах на высоте. Кислородно-ацетиленовая сварка также может использоваться в областях, где электричество нелегко доступно. Кислородно-ацетиленовая резка используется во многих цехах по изготовлению металла. Для использования при сварке и резке рабочее давление должно контролироваться регулятором, поскольку при давлении выше 15 фунтов на квадратный дюйм (100 кПа) ацетилен при ударной волне (вызванной, например, обратным ударом ) взрывается на водород и углерод . [ 33]

Ацетилен полезен во многих процессах, но лишь немногие из них применяются в промышленных масштабах. [34]
Одним из основных химических применений является этинилирование формальдегида. [9] Ацетилен присоединяется к альдегидам и кетонам , образуя α-этиниловые спирты:
Реакция дает бутиндиол , с пропаргиловым спиртом в качестве побочного продукта. Ацетиленид меди используется в качестве катализатора. [35] [36]
В дополнение к этинилированию, ацетилен реагирует с оксидом углерода , ацетилен реагирует с образованием акриловой кислоты или акриловых эфиров. Требуются металлические катализаторы. Эти производные образуют такие продукты, как акриловые волокна , стекла , краски , смолы и полимеры . За исключением Китая, использование ацетилена в качестве химического сырья сократилось на 70% с 1965 по 2007 год из-за стоимости и экологических соображений. [37] В Китае ацетилен является основным предшественником винилхлорида . [34]
До широкого использования нефтехимии ацетилен, полученный из угля, был строительным блоком для нескольких промышленных химикатов. Таким образом, ацетилен может быть гидратирован с получением ацетальдегида , который в свою очередь может быть окислен до уксусной кислоты. Процессы, ведущие к акрилатам, также были коммерциализированы. Почти все эти процессы устарели с появлением этилена и пропилена, полученных из нефти. [38]
В 1881 году русский химик Михаил Кучеров [39] описал гидратацию ацетилена в ацетальдегид с использованием катализаторов, таких как бромид ртути(II) . До появления процесса Ваккера эта реакция проводилась в промышленных масштабах. [40]
Полимеризация ацетилена с катализаторами Циглера-Натта производит полиацетиленовые пленки. Полиацетилен, цепочка CH-центров с чередующимися одинарными и двойными связями, был одним из первых открытых органических полупроводников . Его реакция с йодом производит высокоэлектропроводный материал. Хотя такие материалы бесполезны, эти открытия привели к разработкам органических полупроводников , что было отмечено Нобелевской премией по химии в 2000 году, присужденной Алану Дж. Хигеру , Алану Г. Мак-Диармиду и Хидеки Сиракаве . [9]
В 1920-х годах чистый ацетилен экспериментально использовался в качестве ингаляционного анестетика . [41]
Ацетилен иногда используют для цементации (то есть закалки) стали, когда объект слишком велик, чтобы поместиться в печь. [42]
Ацетилен используется для испарения углерода при радиоуглеродном датировании . Углеродистый материал в археологическом образце обрабатывается металлическим литием в небольшой специализированной исследовательской печи для образования карбида лития (также известного как ацетиленид лития). Затем карбид может реагировать с водой, как обычно, для образования ацетиленового газа, который подается в масс-спектрометр для измерения изотопного соотношения углерода-14 к углероду-12. [43]
Сгорание ацетилена производит сильный, яркий свет, и повсеместное распространение карбидных ламп привело к значительной коммерциализации ацетилена в начале 20-го века. Распространенными областями применения были прибрежные маяки , [44] уличные фонари , [45] а также автомобильные [46] и шахтерские фары . [47] В большинстве этих областей применения прямое сгорание является пожароопасным , и поэтому ацетилен был заменен сначала лампами накаливания , а много лет спустя — маломощными/высокояркими светодиодами. Тем не менее, ацетиленовые лампы по-прежнему ограниченно используются в отдаленных или иным образом недоступных районах и в странах со слабой или ненадежной центральной электросетью . [47]
Энергетическая насыщенность тройной связи C≡C и довольно высокая растворимость ацетилена в воде делают его подходящим субстратом для бактерий, при условии наличия адекватного источника. [48] Было выявлено несколько бактерий, живущих на ацетилене. Фермент ацетиленгидратаза катализирует гидратацию ацетилена с образованием ацетальдегида : [49]
Ацетилен является умеренно распространенным химическим веществом во Вселенной, часто связанным с атмосферами газовых гигантов . [50] Одно любопытное открытие ацетилена было сделано на Энцеладе , спутнике Сатурна . Считается, что природный ацетилен образуется в результате каталитического разложения длинноцепочечных углеводородов при температурах 1700 К (1430 °C; 2600 °F) и выше. Поскольку такие температуры крайне маловероятны на таком небольшом далеком теле, это открытие потенциально предполагает каталитические реакции внутри этого спутника, что делает его перспективным местом для поиска пребиотической химии. [51] [52]
В реакциях винилирования соединения H−X присоединяются по тройной связи. Спирты и фенолы присоединяются к ацетилену, давая виниловые эфиры . Тиолы дают виниловые тиоэфиры. Аналогично, винилпирролидон и винилкарбазол производятся в промышленности путем винилирования 2-пирролидона и карбазола . [31] [9]
Гидратация ацетилена является реакцией винилирования, но полученный виниловый спирт изомеризуется в ацетальдегид . Реакция катализируется солями ртути. Эта реакция когда-то была доминирующей технологией производства ацетальдегида, но она была вытеснена процессом Ваккера , который дает ацетальдегид путем окисления этилена , более дешевого сырья. Аналогичная ситуация применима к превращению ацетилена в ценный винилхлорид путем гидрохлорирования по сравнению с оксихлорированием этилена.
Винилацетат используется вместо ацетилена для некоторых винилирований, которые более точно описываются как трансвинилирования . [53] Более высокие эфиры винилацетата использовались в синтезе винилформиата .
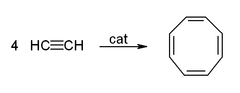
Ацетилен и его производные (2-бутин, дифенилацетилен и т. д.) образуют комплексы с переходными металлами . Его связь с металлом несколько похожа на связь этиленовых комплексов. Эти комплексы являются промежуточными продуктами во многих каталитических реакциях, таких как тримеризация алкинов в бензол, тетрамеризация в циклооктатетраен , [9] и карбонилирование в гидрохинон : [54]

Ацетилениды металлов , виды формулы L n M−C 2 R , также распространены. Ацетиленид меди(I) и ацетиленид серебра могут быть легко образованы в водных растворах из-за благоприятного равновесия растворимости . [55]
Ацетилен имеет p K a 25, ацетилен может быть депротонирован супероснованием с образованием ацетилида : [ 55]
Эффективны различные металлоорганические [56] и неорганические [57] реагенты.

Ацетилен может быть полугидрогенизирован до этилена , что обеспечивает сырье для различных полиэтиленовых пластиков. Галогены добавляются к тройной связи.
Ацетилен не особенно токсичен, но когда он образуется из карбида кальция , он может содержать токсичные примеси, такие как следы фосфина и арсина , что придает ему отчетливый запах, похожий на запах чеснока . Он также легко воспламеняется, как и большинство легких углеводородов, поэтому его используют при сварке. Его самая особая опасность связана с его внутренней нестабильностью, особенно когда он находится под давлением: при определенных условиях ацетилен может реагировать в экзотермической реакции типа присоединения, образуя ряд продуктов, как правило, бензол и/или винилацетилен , возможно, в дополнение к углероду и водороду . [ необходима цитата ] Следовательно, ацетилен, если он инициирован интенсивным теплом или ударной волной, может разлагаться взрывообразно, если абсолютное давление газа превышает примерно 200 килопаскалей (29 фунтов на кв. дюйм). Большинство регуляторов и манометров на оборудовании сообщают об избыточном давлении , и безопасный предел для ацетилена, следовательно, составляет 101 кПа избыточное или 15 фунтов на кв. дюйм. [58] [59] Поэтому он поставляется и хранится растворенным в ацетоне или диметилформамиде (ДМФ), [59] [60] [61] содержащимся в газовом баллоне с пористым наполнением , что делает его безопасным для транспортировки и использования при надлежащем обращении. Ацетиленовые баллоны следует использовать в вертикальном положении, чтобы избежать извлечения ацетона во время использования. [62]
Информация о безопасном хранении ацетилена в вертикальных баллонах предоставлена OSHA, [63] [64] Ассоциацией по сжатому газу, [59] Управлением по безопасности и гигиене труда в шахтах США (MSHA), [65] EIGA, [62] и другими агентствами.
Медь катализирует разложение ацетилена, поэтому ацетилен не следует транспортировать по медным трубам. [66]
Баллоны следует хранить в зоне, отделенной от окислителей, чтобы избежать усиленной реакции в случае пожара/утечки. [59] [64] Баллоны с ацетиленом не следует хранить в замкнутых пространствах, закрытых транспортных средствах, гаражах и зданиях, чтобы избежать непреднамеренной утечки, ведущей к образованию взрывоопасной атмосферы. [59] [64] В США Национальный электротехнический кодекс (NEC) требует рассмотрения опасных зон, включая те, где ацетилен может выделяться во время аварий или утечек. [67] Рассмотрение может включать электрическую классификацию и использование перечисленных электрических компонентов Группы A в США. [67] Дополнительная информация об определении зон, требующих особого рассмотрения, содержится в NFPA 497. [68] В Европе ATEX также требует рассмотрения опасных зон, где во время аварий или утечек могут выделяться горючие газы. [62]
Название ацетилен сохранено для соединения HC≡CH. Это предпочтительное название ИЮПАК, но замена любого рода не допускается; однако в общей номенклатуре допускается замена, например фторацетилен [фторэтин (PIN)], но не алкильными группами или любой другой группой, которая удлиняет углеродную цепь, а также характерными группами, выраженными суффиксами.
веса 6 и 12 использовались для углерода.