Биогенез рибосом — это процесс создания рибосом . У прокариот этот процесс происходит в цитоплазме с транскрипцией многих оперонов генов рибосом . У эукариот он происходит как в цитоплазме , так и в ядрышке . Он включает в себя координированную функцию более 200 белков в синтезе и обработке трех прокариотических или четырех эукариотических рРНК , а также сборку этих рРНК с рибосомальными белками. Большинство рибосомальных белков попадают в различные семейства ферментов, потребляющих энергию, включая АТФ-зависимые РНК- хеликазы , ААА-АТФазы , ГТФазы и киназы . [1] Около 60% энергии клетки тратится на производство и поддержание рибосом. [2]
Биогенез рибосом — это очень строго регулируемый процесс, тесно связанный с другими клеточными процессами, такими как рост и деление. [3] [4]
Некоторые предполагают, что в происхождении жизни биогенез рибосом предшествовал появлению клеток, и что гены и клетки эволюционировали, чтобы усилить репродуктивную способность рибосом. [5]
Рибосомы — это макромолекулярные машины, которые отвечают за трансляцию мРНК в белки. Эукариотическая рибосома, также называемая 80S рибосомой, состоит из двух субъединиц — большой 60S субъединицы (которая содержит 25S [у растений] или 28S [у млекопитающих], 5,8S и 5S рРНК и 46 рибосомных белков) и небольшой 40S субъединицы (которая содержит 18S рРНК и 33 рибосомных белка). [6] Рибосомные белки кодируются рибосомными генами.
Существует 52 гена, кодирующих рибосомальные белки, и они могут быть обнаружены в 20 оперонах в прокариотической ДНК. Регуляция синтеза рибосом зависит от регуляции самой рРНК .
Во-первых, снижение аминоацил-тРНК заставит прокариотическую клетку отреагировать снижением транскрипции и трансляции . Это происходит через ряд шагов, начиная с жестких факторов, связывающихся с рибосомами и катализирующих реакцию:
GTP + ATP --> pppGpp + AMP
Затем γ-фосфат удаляется, и ppGpp связывается с РНК-полимеразой и ингибирует ее. Это связывание приводит к снижению транскрипции рРНК. Уменьшенное количество рРНК означает, что рибосомальные белки (р-белки) будут транслироваться, но не будут иметь рРНК для связывания. Вместо этого они будут отрицательно реагировать и связываться со своей собственной мРНК, подавляя синтез р-белка. Обратите внимание, что р-белки предпочтительно связываются со своей комплементарной рРНК, если она присутствует, а не с мРНК.
Опероны рибосомы также включают гены РНК-полимеразы и факторов удлинения (используются в трансляции РНК). Регуляция всех этих генов одновременно иллюстрирует связь между транскрипцией и трансляцией у прокариот.
Синтез рибосомальных белков у эукариот является важной метаболической активностью. Он происходит, как и большинство синтезов белков, в цитоплазме непосредственно за пределами ядра. Отдельные рибосомальные белки синтезируются и импортируются в ядро через ядерные поры . Подробнее о перемещении рибосомальных белков в ядро см. в разделе ядерный импорт .
ДНК транскрибируется с высокой скоростью в ядрышке , которое содержит все гены 45S рРНК. Единственным исключением является 5S рРНК, которая транскрибируется вне ядрышка . После транскрипции рРНК связываются с рибосомными белками, образуя два типа рибосомных субъединиц (большую и малую). Позже они соберутся в цитозоле, чтобы создать функционирующую рибосому. Подробнее о перемещении рибосомных субъединиц из ядра см. в разделе ядерный экспорт . [11]
Эукариотические клетки ко-транскрибируют три вида зрелых рРНК через ряд этапов. Процесс созревания рРНК и процесс рекрутирования р-белков происходят в предшественниках рибосомных частиц, иногда называемых пре-рибосомами, и происходят в ядрышке , нуклеоплазме и цитоплазме . Дрожжи S. cerevisiae являются эукариотическим модельным организмом для изучения биогенеза рибосом. Биогенез рибосом начинается в ядрышке . Там пре-РНК 35S транскрибируется с рибосомных генов в виде полицистронного транскрипта РНК-полимеразой I и преобразуется в субъединицы 18S, 5.8S и 25S рРНК. [1] [3]
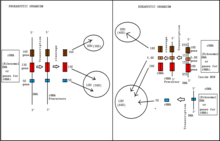
Транскрипция полимеразы I начинается с комплекса инициации Pol I, который связывается с промотором рДНК . Формирование этого комплекса требует помощи вышестоящего активирующего фактора или UAF, который ассоциируется с белком связывания TATA-box и основным фактором (CF). Вместе эти два фактора транскрипции позволяют комплексу РНК pol I связываться с фактором инициации полимеразы I, Rrn3. По мере того, как производится транскрипт pol I, приблизительно 75 небольших ядрышковых рибонуклеочастиц (snoRNP) облегчают ко-транскрипционные ковалентные модификации >100 остатков рРНК. Эти snoRNP контролируют метилирование 2'-O-рибозы нуклеотидов, а также помогают в создании псевдоуридинов . [1] На 5'-конце транскриптов рРНК малые субъединичные рибосомальные белки (Rps) и нерибосомные факторы собираются с пре-РНК-транскриптами, создавая шарообразные выступы. Эти выступы являются первыми прерибосомными частицами в пути малой (40S) рибосомной субъединицы. [1] Транскрипт рРНК расщепляется в участке A2, и это отделяет раннюю прерибосому 40S от оставшейся пре-рРНК, которая будет объединяться с большими субъединицами рибосомных белков (Rpl) и другими нерибосомными факторами для создания пре-60S рибосомных частиц. [1]
Транскрипционная сборка предшественника субъединицы 40 S , иногда называемая малым субъединичным процессомом (SSU) или частицей 90S, происходит иерархически — по сути, это поэтапное включение подкомплексов UTP-A, UTP-B и UTP-C. Эти подкомплексы состоят из более чем 30 нерибосомных белковых факторов, частицы U3 snoRNP, нескольких белков Rps и пре-рРНК 35S. Однако их точная роль не была обнаружена. [3] Состав частицы pre-40S радикально меняется после расщепления на участках, зависящих от U3 snoRNPA (участки A0, A1 и A2). Это событие расщепления создает пре-рРНК 20S и заставляет рибосомные факторы диссоциировать от частицы pre-40S. U3 вытесняется из зарождающегося 40S геликазой Dhr1. [12] На этом этапе процесса биогенеза рибосомы прерибосома 40S уже демонстрирует структуры «головы» и «тела» зрелой субъединицы 40S. Прерибосома 40S транспортируется из ядрышка в цитоплазму. Цитоплазматическая прерибосома 40S теперь содержит рибосомные белки, 20s рРНК и несколько нерибосомных факторов. Окончательное формирование структуры «клюва» субъединицы 40S происходит после фосфорилирования и дефосфорилирования с участием комплекса Enp1-Ltv1-Rps3 и киназы Hrr25. Расщепление прерибосомы 20S в D-сайте создает зрелую 18s рРНК. Это событие расщепления зависит от нескольких нерибосомных факторов, таких как Nob1, Rio1, Rio2, Tsr1 и Fap7. [1]
Созревание субъединицы pre-60S в зрелую субъединицу 60S требует многих факторов биогенеза, которые ассоциируются и диссоциируют. Кроме того, некоторые факторы сборки ассоциируются с субъединицей 60S, в то время как другие взаимодействуют с ней только временно. Как общая тенденция, созревание субъединицы pre-60S отмечено постепенным уменьшением сложности. Субъединица созревает по мере перемещения из ядрышка в цитоплазму, и постепенно количество транс-действующих факторов уменьшается. [3] Созревание субъединицы 60S требует помощи около 80 факторов. Восемь из этих факторов напрямую вовлечены в процессинг пре-рРНК 27S A3, который фактически завершает формирование зрелого 5'-конца 5.8S рРНК. Факторы A3 связываются с отдаленными участками на пре-РНК, а также друг с другом. Затем они сближают области рРНК и способствуют обработке пре-рРНК и привлечению рибосомных белков. Три АТФазы типа ААА работают над тем, чтобы отделить факторы от созревающей прерибосомы 60S. Одна из АТФаз — это динеиноподобный белок Rea1, состоящий из 6 различных доменов АТФазы, которые образуют кольцевую структуру. Кольцевая структура прикреплена к гибкому хвосту, который имеет кончик MIDAS (Metal ion-dependent adhesive site) (сайт адгезии, зависимый от ионов металла). Rea1 взаимодействует с прерибосомой 60S через свое кольцо, в то время как два субстрата , Ytm1 и Rsa1, взаимодействуют с Rea1 через кончик MIDAS. Роль этих субстратов пока не определена. Однако оба, вместе со своими взаимодействиями, удаляются в процессе созревания прерибосомы 60S. Две другие АТФазы, Rix7 и Drg1, также выполняют функцию удаления факторов сборки из созревающей субъединицы 60S. Хеликазы и ГТФазы также участвуют в удалении факторов сборки и перестройке РНК для формирования завершенной субъединицы 60S. Попав в цитоплазму (см. ядерный экспорт), субъединица 60S далее подвергается процессингу, чтобы стать функциональной. Остальные крупные субъединицы рибосомных частиц ассоциируются с единицей 60S, а оставшиеся нерибосомные факторы сборки диссоциируют. Высвобождение факторов биогенеза опосредуется в основном ГТФазами, такими как Lsg1, и АТФазами, такими как Drg1. Точная последовательность этих событий остается неясной. Путь цитоплазматического созревания 60S остается неполным, насколько это касается современных знаний. [3]
Для того чтобы прерибосомные единицы полностью созрели, они должны быть экспортированы в цитоплазму . Для эффективного перемещения из ядрышка в цитоплазму прерибосомы взаимодействуют с экспортными рецепторами для перемещения через гидрофобный центральный канал комплекса ядерной поры. [3] Кариоферин Crm1 является рецептором для обеих рибосомных субъединиц и опосредует экспорт зависимым от Ran-GTP образом. Он распознает молекулы, которые имеют богатые лейцином сигналы ядерного экспорта. Crm1 подтягивается к большой субъединице 60S с помощью адаптерного белка , называемого Nmd3. Адаптерный белок для единицы 40S неизвестен. Помимо Crm1, в ядерном экспорте прерибосом играют роль и другие факторы. Общий рецептор экспорта мРНК, называемый Mex67, а также белок, содержащий HEAT-повторение, Rrp12, облегчают экспорт обеих субъединиц. Эти факторы являются несущественными белками и помогают оптимизировать экспорт прерибосом, поскольку они представляют собой большие молекулы. [3]
Поскольку рибосомы настолько сложны, определенное количество рибосом собирается неправильно и может потенциально тратить клеточную энергию и ресурсы при синтезе нефункциональных белков. Чтобы предотвратить это, у клеток есть активная система надзора, которая распознает поврежденные или дефектные рибосомы и нацеливает их на деградацию. Механизм надзора предназначен для обнаружения нефункциональных прерибосом, а также нефункциональных зрелых рибосом. Кроме того, система надзора обеспечивает необходимое оборудование для деградации и фактически деградирует нефункциональные рибосомы. [1] Прерибосомы, которые накапливаются в ядре, разрушаются экзосомой , которая представляет собой многосубъединичный комплекс с экзонуклеазной активностью. Если дефектные рибосомные субъединицы все же попадают из ядрышка в цитоплазму, там есть вторая система надзора, которая нацеливает неисправные рибосомы в цитоплазме на деградацию. Определенные мутации в остатках большой субъединицы рибосомы фактически приведут к распаду РНК и, таким образом, к деградации единицы. Поскольку количество дефектов, которые возможны при сборке рибосомы, настолько обширно, до сих пор неизвестно, как система наблюдения обнаруживает все дефекты, но было постулировано, что вместо того, чтобы нацеливаться на конкретные дефекты, система наблюдения распознает последствия этих дефектов, такие как задержки сборки. Это означает, что если есть нарушение в сборке или созревании зрелой рибосомы, система наблюдения будет действовать так, как будто субъединица дефектна. [3]
Мутации в биогенезе рибосом связаны с несколькими генетическими заболеваниями человека рибосомопатией , включая наследственные синдромы недостаточности костного мозга, которые характеризуются предрасположенностью к раку и уменьшенным количеством клеток крови. Рибосомальная дисрегуляция также может играть роль в мышечной атрофии . [13]
{{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь ){{cite journal}}: Цитировать журнал требует |journal=( помощь )