
Процесс Ваккера или процесс Хёхста-Ваккера (названный в честь одноименных химических компаний) относится к окислению этилена в ацетальдегид в присутствии хлорида палладия (II) и хлорида меди (II) в качестве катализатора . [1] Эта химическая реакция была одним из первых гомогенных катализов с использованием органопалладийорганической химии, примененных в промышленных масштабах. [2]
Реакция Вакера была впервые описана Смидтом и др. [3] [4] [5]
Разработка химического процесса, теперь известного как процесс Wacker, началась в 1956 году в Wacker Chemie . [6] В то время многие промышленные соединения производились из ацетилена , полученного из карбида кальция , — дорогостоящей и неэкологичной технологии. Строительство нового нефтеперерабатывающего завода в Кельне компанией Esso недалеко от завода Wacker, в сочетании с осознанием того, что этилен будет более дешевым сырьем, побудило Wacker исследовать его потенциальное использование. В рамках последующих исследовательских усилий реакция этилена и кислорода над палладием на углероде в поисках этиленоксида неожиданно дала доказательства образования ацетальдегида (просто на основе запаха). Дополнительные исследования этого превращения этилена в ацетальдегид привели к патенту 1957 года, описывающему газофазную реакцию с использованием гетерогенного катализатора. [7] Тем временем Hoechst AG присоединилась к гонке и после подачи патентной заявки вынудила Wacker вступить в партнерство под названием Aldehyd GmbH . Гетерогенный процесс в конечном итоге потерпел неудачу из-за дезактивации катализатора и был заменен гомогенной системой на водной основе, пилотная установка которой была запущена в эксплуатацию в 1958 году. Проблемы с агрессивным каталитическим раствором были решены путем использования титана (недавно доступного для промышленного использования) в качестве конструкционного материала для реакторов и насосов. Производственные установки были введены в эксплуатацию в 1960 году.
Механизм реакции промышленного процесса Wacker (окисление олефинов через хлорид палладия(II)) привлекал значительное внимание в течение нескольких десятилетий. Аспекты механизма все еще обсуждаются. Современная формулировка описана ниже:
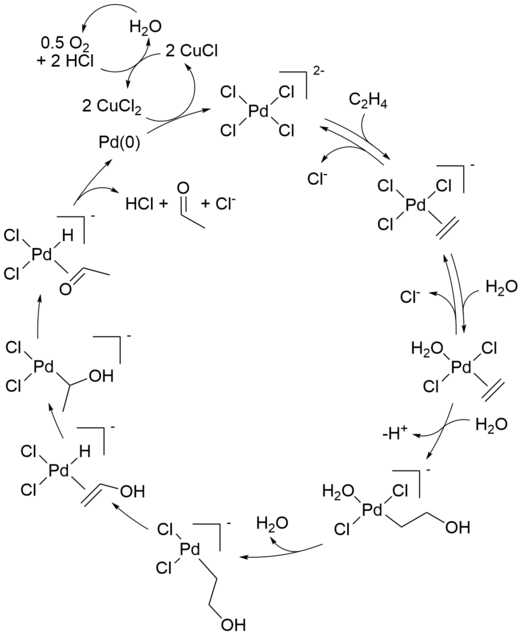
Первоначальная стехиометрическая реакция была впервые описана Филлипсом. [9] [10] Чистую реакцию можно также описать следующим образом:
За этим превращением следуют реакции, регенерирующие катализатор Pd(II):
Потребляются только алкен и кислород. Без хлорида меди(II) в качестве окислителя металлический Pd(0) (образующийся в результате бета-гидридного элиминирования Pd(II) на последнем этапе) выпадал бы в осадок, останавливая реакцию после одного цикла. Эта стехиометрическая реакция была открыта в 1894 году. Воздух, чистый кислород или ряд других реагентов могут затем окислить полученную смесь CuCl -хлорида обратно до CuCl2 , позволяя циклу продолжаться.
Ранние механистические исследования 1960-х годов прояснили несколько ключевых моментов: [11] [8]
Многие механистические исследования процесса Вакера были сосредоточены на пути образования связи CO, этапе гидроксипалладирования . Генри сделал вывод, что координированный гидроксид атакует этиленовый лиганд, внутренний (син-) путь. [12] Позднее стереохимические исследования Стилле и его коллег [13] [14] [15] подтверждают антиприсоединительный путь, при котором свободный гидроксид атакует этиленовый лиганд. Условия экспериментов Стилле значительно отличаются от условий промышленного процесса. Другие исследования с использованием обычных промышленных условий Вакера (за исключением высоких концентраций хлорида и хлорида меди) также дали продукты, которые предполагали, что нуклеофильная атака была реакцией антиприсоединения. [16]
Кинетические исследования были проведены на изотопно замещенных аллиловых спиртах в стандартных промышленных условиях (с низкими концентрациями хлорида) для изучения механизмов реакции. [17] [18] Эти результаты показали, что нуклеофильная атака является медленным процессом, в то время как предложенные механизмы, объясняющие более ранние стереохимические исследования, предполагали, что нуклеофильная атака является быстрым процессом.
Последующие стереохимические исследования показали, что оба пути имеют место и зависят от концентрации хлорида. [19] [20] Однако эти исследования также оспариваются, поскольку аллиловые спирты могут быть чувствительны к реакциям изомеризации, и в результате этих реакций, а не стандартного процесса Ваккера, могут образовываться различные стереоизомеры.
Подводя итог, экспериментальные данные, по-видимому, подтверждают, что син-присоединение происходит при низких концентрациях хлорида в реакции (< 1 моль / л , условия промышленного процесса), тогда как анти-присоединение происходит при высоких концентрациях хлорида (> 3 моль/л), вероятно, из-за того, что хлорид-ионы насыщают катализатор и ингибируют механизм внутренней сферы. Однако точный путь и причина этого переключения путей до сих пор неизвестны.
Еще больше усложняют механизм процесса Ваккера вопросы о роли хлорида меди. Большинство теорий предполагали, что медь не играет роли в механизмах окисления олефинов. Тем не менее, эксперименты Штангла и Джиры [21] показали, что образование хлоргидрина зависит от концентрации хлорида меди. Работа Хосокавы и соавторов [22] дала кристаллизованный продукт, содержащий хлорид меди, что указывает на то, что он может играть невинную роль в окислении олефинов. Наконец, исследование ab initio Комаса-Вивеса и соавторов [23] без участия медного сокатализатора показало, что предпочтительным путем является антиприсоединение. Этот путь был позже подтвержден экспериментами без участия меди Андерсона и Сигмана [24] . В условиях отсутствия меди был обнаружен другой закон кинетической скорости без зависимости от протона, что указывает на возможность того, что даже небольшие количества медных сокатализаторов могут играть невинную роль в этой химии. Хотя эти работы усложняют картину механизма процесса Вакера, вероятно, следует сделать вывод, что эта и родственная химия могут быть чувствительны к условиям реакции, и в ней могут участвовать несколько различных путей реакции.
Другим ключевым шагом в процессе Вакера является миграция водорода из кислорода в хлорид и образование двойной связи CO. Обычно считается, что этот шаг происходит через так называемое β-гидридное исключение с циклическим четырехчленным переходным состоянием :

Исследования in silico [25] [26] [27] утверждают, что переходное состояние для этого этапа реакции неблагоприятно и действует альтернативный механизм реакции восстановительного элиминирования . Предложенные этапы реакции, вероятно, сопровождаются молекулой воды в растворе, действующей как катализатор.

Для производства ацетальдегида освоены два способа: одностадийный и двухстадийный.
Этилен и кислород пропускаются одновременно в реакционной башне при температуре около 130 °C и давлении 400 кПа. [ 28] Катализатор представляет собой водный раствор PdCl2 и CuCl2 . Ацетальдегид очищается экстрактивной дистилляцией с последующей фракционной дистилляцией . Экстрактивная дистилляция с водой удаляет легкие фракции, имеющие более низкие температуры кипения, чем ацетальдегид ( хлорметан , хлорэтан и диоксид углерода ) в верхней части, в то время как вода и более высококипящие побочные продукты, такие как уксусная кислота , кротоновый альдегид или хлорированные ацетальдегиды, выводятся вместе с ацетальдегидом в нижней части. [28] Из-за коррозионной природы катализатора реактор облицован кислотостойким керамическим материалом, а трубки изготовлены из титана .
В двухступенчатом процессе реакция и окисление проводятся отдельно в трубчатых реакторах. В отличие от одноступенчатого процесса, вместо кислорода можно использовать воздух. Этилен пропускается через реактор вместе с катализатором при 105–110 °C и 900–1000 кПа. [28] Раствор катализатора, содержащий ацетальдегид, отделяется путем флэш-дистилляции . Катализатор окисляется в реакторе окисления при 1000 кПа с использованием воздуха в качестве окислительной среды. Окисленный раствор катализатора отделяется и отправляется обратно в реактор. Кислород из воздуха полностью используется, а отработанный воздух циркулирует как инертный газ. Смесь ацетальдегида и водяного пара предварительно концентрируется до 60–90% ацетальдегида путем использования тепла реакции , а сбрасываемая вода возвращается в испарительную колонну для поддержания концентрации катализатора. Далее следует двухступенчатая дистилляция сырого ацетальдегида. На первом этапе отделяются низкокипящие вещества, такие как хлорметан , хлорэтан и диоксид углерода . На втором этапе удаляются вода и высококипящие побочные продукты, такие как хлорированные ацетальдегиды и уксусная кислота , а сверху получается чистый ацетальдегид. [28] Из-за коррозионной природы катализатора контактирующее с ним оборудование облицовано титаном .
В обоих одно- и двухстадийных процессах выход ацетальдегида составляет около 95% [28] , а производственные затраты практически одинаковы. Преимущество использования разбавленных газов в двухстадийном методе уравновешивается более высокими инвестиционными затратами. Оба метода дают хлорированные углеводороды, хлорированные ацетальдегиды и уксусную кислоту в качестве побочных продуктов. Как правило, выбор метода определяется сырьевыми и энергетическими ситуациями, а также доступностью кислорода по разумной цене. В общем, 100 частей этилена дают:
и другие второстепенные побочные продукты
Появление процесса Ваккера подстегнуло множество исследований полезности и применимости реакций к более сложным терминальным олефинам. Окисление Цудзи-Ваккера представляет собой катализируемое палладием(II) превращение таких олефинов в карбонильные соединения. Клемент и Сельвиц [29] были первыми, кто обнаружил, что использование водного ДМФА в качестве растворителя позволяет окислять 1-додецен в 2-додеканон, что решает проблему нерастворимости олефинов более высокого порядка в воде. Фейи [30] отметил, что использование 3-метилсульфолана вместо ДМФА в качестве растворителя увеличивает выход окисления 3,3-диметилбут-1-ена. Два года спустя, Цудзи [31] применил условия Сельвица для селективного окисления терминальных олефинов с несколькими функциональными группами и продемонстрировал их полезность в синтезе сложных субстратов. [32] Дальнейшее развитие реакции привело к появлению различных каталитических систем, позволяющих повысить селективность реакции, а также к внедрению межмолекулярного и внутримолекулярного окисления с неводными нуклеофилами.

Окисление Цудзи-Ваккера окисляет терминальный олефин до соответствующего метилкетона в условиях процесса Ваккера. Почти идентичный процессу Ваккера, предлагаемый каталитический цикл [33] (рисунок 1) начинается с комплексообразования PdCl 2 и двух хлоридных анионов до PdCl 4 , который затем подвергается последующему обмену лигандов двух хлоридных лигандов на воду и алкен с образованием комплекса Pd(Cl 2 )(H 2 O)(алкен). Затем молекула воды региоселективно атакует олефин через механизм внешней сферы в манере Марковникова , образуя более термодинамически стабильный комплекс Pd(Cl 2 )(OH)(-CH 2 -CHOH-R). Диссоциация хлоридного лиганда в трехкоординированный комплекс палладия способствует β-гидридному элиминированию, затем последующее 1,2-гидридное миграционное включение генерирует комплекс Pd(Cl 2 )(OH)(-CHOHR-CH 3 ). Он подвергается β-гидридному элиминированию с высвобождением кетона, а последующее восстановительное элиминирование производит HCl, воду и палладий(0). Наконец, палладий(0) повторно окисляется до PdCl 2 с двумя эквивалентами Cu(II)Cl 2 , который в свою очередь может быть повторно окислен O 2 .
Окисление терминальных олефинов обычно дает продукт кетона Марковникова, однако в случаях, когда субстрат благоприятствует альдегиду (обсуждается ниже), можно использовать различные лиганды для усиления региоселективности Марковникова. Использование спартеина в качестве лиганда (рисунок 2, A) [34] благоприятствует нуклеопалладированию на терминальном углероде, чтобы минимизировать стерическое взаимодействие между комплексом палладия и субстратом. Палладиевый катализатор, связанный с Quinox, используется для благоприятствования образованию кетона, когда субстрат содержит направляющую группу (рисунок 2, B). [35] Когда такой субстрат связывается с Pd(Quinox)(OOtBu), этот комплекс координационно насыщен, что предотвращает связывание направляющей группы и приводит к образованию продукта Марковникова. Эффективность этого лиганда также объясняется его электронным свойством, где анионный TBHP предпочитает связываться транс с оксазолином, а олефин координируется транс с хинолином. [36]

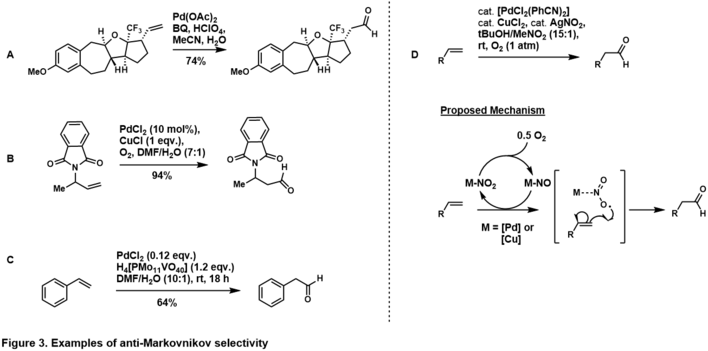
Селективность присоединения анти-Марковникова к альдегиду может быть достигнута за счет использования собственной стереоэлектроники субстрата. [37] Размещение направляющей группы в гомо-аллильном (т. е. Рисунок 3, A) [38] и аллильном положении (т. е. Рисунок 3, B) [39] к терминальному олефину благоприятствует образованию продукта анти-Марковникова альдегида, что предполагает, что в каталитическом цикле направляющая группа хелатируется с комплексом палладия таким образом, что вода атакует углерод анти-Марковникова, образуя более термодинамически стабильный палладацикл. Селективность анти-Марковникова также наблюдается в стиренильных субстратах (т. е. Рисунок 3, C), [40] предположительно через комплекс η 4 -палладий-стирол после того, как вода атакует анти-Марковникова. Дополнительные примеры контролируемого субстратом антимарковниковского окисления Цудзи-Ваккера олефинов приведены в обзорах Намбутири [41] , Феринги [37] и Музарта [42] .
Граббс и его коллеги проложили путь для окисления по антимарковниковскому типу стереоэлектронно несмещенных терминальных олефинов с помощью системы палладий-нитрит (рисунок 2, D). [43] В его системе терминальный олефин окислялся до альдегида с высокой селективностью через путь, контролируемый катализатором. Механизм находится в стадии изучения, однако данные [41] предполагают, что он проходит через нитритный радикал, присоединяющийся к терминальному углероду, для получения более термодинамически стабильного вторичного радикала. Граббс расширил эту методологию до более сложных, несмещенных олефинов. [44] [45]
Межмолекулярные окисления олефинов со спиртами в качестве нуклеофила обычно генерируют кетали , тогда как катализируемое палладием окисление олефинов с карбоновыми кислотами в качестве нуклеофила генерирует виниловые или аллильные карбоксилаты . В случае диолов их реакции с алкенами обычно генерируют кетали, тогда как реакции олефинов, несущих электроноакцепторные группы, имеют тенденцию образовывать ацетали . [46]
Палладий-катализируемое межмолекулярное окисление диенов с карбоновыми кислотами и спиртами в качестве доноров дает продукты 1,4-присоединения . В случае циклогексадиена (рисунок 4, A) Баквалл обнаружил, что стереохимический результат продукта зависит от концентрации LiCl. [47] Эта реакция протекает путем первого образования комплекса Pd(OAc)(бензохинон)(аллил) через антинуклеопалладирование диена с ацетатом в качестве нуклеофила. Отсутствие LiCl вызывает восстановительное элиминирование во внутренней сфере , что дает транс-ацетатную стереохимию для получения транс-1,4-аддукта. Присутствие LiCl замещает ацетат хлоридом из-за его более высокой связывающей аффинности, что заставляет ацетат внешней сферы атаковать анти-палладий и дает цис-ацетатную стереохимию для получения цис-1,4-аддукта. Внутримолекулярная окислительная циклизация: 2-(2-циклогексенил)фенол циклизуется в соответствующий дигидробензофуран (рисунок 4, B); [48] 1-циклогексадиен-уксусная кислота в присутствии уксусной кислоты циклизуется в соответствующий лактон-ацетатный 1,4-аддукт (рисунок 4, C), [49] с цис- и транс -селективностью, контролируемой присутствием LiCl.

Окислительное аминирование олефинов обычно проводят с амидами или имидами ; амины , как полагают, протонируются кислой средой или связывают металлический центр слишком прочно, чтобы позволить произойти каталитической химии. [46] Эти азотные нуклеофилы, как обнаружено, компетентны как в межмолекулярных, так и в внутримолекулярных реакциях, некоторые примеры изображены (Рисунок 5, A, [50] B [51] )

{{cite book}}: CS1 maint: местоположение ( ссылка )