Углекислый газ — это химическое соединение с химической формулой CO2 . Он состоит из молекул , каждая из которых имеет один атом углерода , ковалентно связанный двойной связью с двумя атомами кислорода . Он находится в газообразном состоянии при комнатной температуре, и как источник доступного углерода в углеродном цикле , атмосферный CO2 является основным источником углерода для жизни на Земле. В воздухе углекислый газ прозрачен для видимого света, но поглощает инфракрасное излучение , действуя как парниковый газ . Углекислый газ растворяется в воде и содержится в грунтовых водах , озерах , ледяных шапках и морской воде . Когда углекислый газ растворяется в воде, он образует карбонат и в основном бикарбонат ( HCO−3), что приводит к закислению океана по мере увеличения уровня CO 2 в атмосфере . [9]
Это следовой газ в атмосфере Земли в концентрации 421 частей на миллион (ppm) [a] , или около 0,04% (по состоянию на май 2022 года), увеличившийся с доиндустриального уровня в 280 ppm или около 0,025%. [11] [12] Сжигание ископаемого топлива является основной причиной этих повышенных концентраций CO2 , а также основной причиной изменения климата . [13]
Его концентрация в доиндустриальной атмосфере Земли с конца докембрия регулировалась организмами и геологическими явлениями. Растения , водоросли и цианобактерии используют энергию солнечного света для синтеза углеводов из углекислого газа и воды в процессе, называемом фотосинтезом , который производит кислород в качестве побочного продукта. [14] В свою очередь, кислород потребляется, а CO 2 выделяется в качестве отходов всеми аэробными организмами , когда они метаболизируют органические соединения для производства энергии путем дыхания . [15] CO 2 выделяется из органических материалов, когда они разлагаются или сгорают, например, при лесных пожарах.
Углекислый газ на 53% плотнее сухого воздуха, но он долгоживущий и тщательно перемешивается в атмосфере. Около половины избыточных выбросов CO2 в атмосферу поглощается поглотителями углерода на суше и в океане . [16] Эти поглотители могут насыщаться и быть нестабильными, поскольку распад и лесные пожары приводят к тому, что CO2 выбрасывается обратно в атмосферу. [17] CO2 в конечном итоге изолируется (хранится в течение длительного времени) в горных породах и органических отложениях, таких как уголь , нефть и природный газ . Изолированный CO2 выбрасывается в атмосферу при сжигании ископаемого топлива или естественным образом вулканами , горячими источниками , гейзерами и при растворении карбонатных пород в воде или в реакции с кислотами.
CO 2 — универсальный промышленный материал, используемый, например, в качестве инертного газа при сварке и огнетушителях , в качестве нагнетательного газа в пневматических пушках и при добыче нефти, а также в качестве сверхкритического флюидного растворителя при декофеинизации и сверхкритической сушке . [18] Он является побочным продуктом ферментации сахаров в хлебопечении , пивоварении и виноделии и добавляется в газированные напитки, такие как сельтерская вода и пиво, для шипучести. Он имеет резкий и кислый запах и создает привкус газированной воды во рту, но при обычных концентрациях не имеет запаха. [1]
Углекислый газ не может быть сжижен при атмосферном давлении. Низкотемпературный углекислый газ используется в коммерческих целях в твердой форме, обычно известной как « сухой лед ». Фазовый переход из твердого состояния в газообразное происходит при 194,7 Кельвина и называется сублимацией .
Симметрия молекулы диоксида углерода линейна и центросимметрична в ее равновесной геометрии. Длина связи углерод-кислород в диоксиде углерода составляет 116,3 пм , что заметно короче, чем длина типичной одинарной связи C–O, составляющая примерно 140 пм, и короче, чем у большинства других функциональных групп с множественными связями C–O, таких как карбонилы . [19] Поскольку молекула центросимметрична, она не имеет электрического дипольного момента .

Как линейная трехатомная молекула, CO2 имеет четыре колебательных режима , как показано на схеме. В симметричных и антисимметричных режимах растяжения атомы движутся вдоль оси молекулы. Существуют два изгибных режима, которые являются вырожденными , что означает, что они имеют одинаковую частоту и одинаковую энергию из-за симметрии молекулы. Когда молекула касается поверхности или касается другой молекулы, два изгибных режима могут отличаться по частоте, поскольку взаимодействие для двух режимов различно. Некоторые из колебательных режимов наблюдаются в инфракрасном (ИК) спектре : антисимметричный режим растяжения при волновом числе 2349 см −1 (длина волны 4,25 мкм) и вырожденная пара изгибных режимов при 667 см −1 (длина волны 15 мкм). Симметричная мода растяжения не создает электрический диполь, поэтому не наблюдается в ИК-спектроскопии, но обнаруживается в рамановской спектроскопии при 1388 см −1 (длина волны 7,2 мкм). [20]
В газовой фазе молекулы углекислого газа совершают значительные колебательные движения и не сохраняют фиксированную структуру. Однако в эксперименте по визуализации кулоновского взрыва можно получить мгновенное изображение молекулярной структуры. Такой эксперимент [21] был проведен для углекислого газа. Результат этого эксперимента и вывод теоретических расчетов [22], основанных на ab initio поверхности потенциальной энергии молекулы, заключается в том, что ни одна из молекул в газовой фазе никогда не является точно линейной. Этот противоречащий интуиции результат тривиально обусловлен тем фактом, что элемент объема ядерного движения исчезает для линейных геометрий. [22] Это так для всех молекул, за исключением двухатомных молекул .
Углекислый газ растворяется в воде, где он обратимо образует H2CO3 ( угольную кислоту ), которая является слабой кислотой , поскольку ее ионизация в воде неполная.
Константа равновесия гидратации угольной кислоты при 25 °C составляет:
Таким образом, большая часть углекислого газа не преобразуется в угольную кислоту, а остается в виде молекул CO2 , не влияя на pH.
Относительные концентрации CO 2 , H 2 CO 3 и депротонированных форм HCO−3( бикарбонат ) и CO2−3( карбонат ) зависят от pH . Как показано на графике Бьеррума , в нейтральной или слабощелочной воде (pH > 6,5) преобладает форма бикарбоната (>50%), становясь наиболее распространенной (>95%) при pH морской воды. В очень щелочной воде (pH > 10,4) преобладающей (>50%) формой является карбонат. Океаны, будучи слабощелочными с типичным pH = 8,2–8,5, содержат около 120 мг бикарбоната на литр.
Будучи дипротонной , угольная кислота имеет две константы кислотной диссоциации , первая из которых относится к диссоциации на ион бикарбоната (также называемый гидрокарбонатом) ( HCO−3):
Это истинная константа диссоциации первой кислоты, определяемая как
где знаменатель включает только ковалентно связанный H 2 CO 3 и не включает гидратированный CO 2 (водн.). Гораздо меньшее и часто цитируемое значение около 4,16 × 10 −7 (или pK a1 = 6,38) является кажущимся значением, рассчитанным на основе (неверного) предположения, что весь растворенный CO 2 присутствует в виде угольной кислоты, так что
Поскольку большая часть растворенного CO 2 остается в виде молекул CO 2 , K a1 (кажущийся) имеет гораздо больший знаменатель и гораздо меньшее значение, чем истинный K a1 . [23]
Бикарбонатный ион является амфотерным видом, который может действовать как кислота или как основание, в зависимости от pH раствора. При высоком pH он значительно диссоциирует в карбонатный ион ( CO2−3):
В организмах образование угольной кислоты катализируется ферментом, известным как карбоангидраза .
Помимо изменения кислотности, присутствие углекислого газа в воде также влияет на ее электрические свойства.
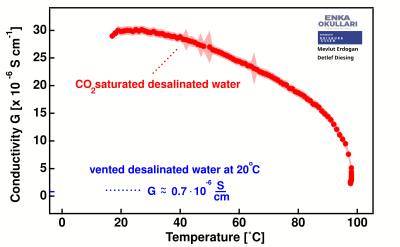
При растворении углекислого газа в опресненной воде электропроводность значительно увеличивается от менее 1 мкСм/см до почти 30 мкСм/см. При нагревании вода начинает постепенно терять проводимость, вызванную присутствием , что особенно заметно при температурах выше 30 °C.
Температурная зависимость электропроводности полностью деионизированной воды без насыщения сравнительно низкая по сравнению с этими данными.
CO 2 является мощным электрофилом, имеющим электрофильную реакционную способность, сравнимую с бензальдегидом или сильно электрофильными α,β-ненасыщенными карбонильными соединениями . Однако, в отличие от электрофилов с аналогичной реакционной способностью, реакции нуклеофилов с CO 2 термодинамически менее предпочтительны и часто оказываются весьма обратимыми. [24] Обратимая реакция диоксида углерода с аминами для получения карбаматов используется в скрубберах CO 2 и была предложена в качестве возможной отправной точки для улавливания и хранения углерода путем очистки газа аминами . Только очень сильные нуклеофилы, такие как карбанионы, предоставляемые реагентами Гриньяра и литийорганическими соединениями, реагируют с CO 2 с образованием карбоксилатов :
В комплексах металлов с диоксидом углерода CO 2 служит лигандом , который может способствовать превращению CO 2 в другие химические вещества. [25]
Восстановление CO2 до CO обычно представляет собой сложную и медленную реакцию:
Окислительно-восстановительный потенциал этой реакции около pH 7 составляет около −0,53 В по сравнению со стандартным водородным электродом . Никельсодержащий фермент дегидрогеназа оксида углерода катализирует этот процесс. [26]
Фотоавтотрофы (т.е. растения и цианобактерии ) используют энергию, содержащуюся в солнечном свете, для фотосинтеза простых сахаров из CO2 , поглощенного из воздуха и воды:

Углекислый газ бесцветен. При низких концентрациях газ не имеет запаха; однако при достаточно высоких концентрациях он имеет резкий, кислый запах. [1] При стандартной температуре и давлении плотность углекислого газа составляет около 1,98 кг/м3 , что примерно в 1,53 раза больше плотности воздуха . [27]
Углекислый газ не имеет жидкого состояния при давлении ниже 0,51795(10) МПа [2] (5,11177(99) атм ). При давлении 1 атм (0,101325 МПа) газ осаждается непосредственно в твердое вещество при температуре ниже 194,6855(30) К [2] (−78,4645(30) °C), а твердое вещество сублимируется непосредственно в газ выше этой температуры. В твердом состоянии углекислый газ обычно называют сухим льдом .

Жидкий диоксид углерода образуется только при давлениях выше 0,51795(10) МПа [2] (5,11177(99) атм); тройная точка диоксида углерода составляет 216,592(3) К [2] (−56,558(3) °C) при 0,51795(10) МПа [2] (5,11177(99) атм) (см. фазовую диаграмму). Критическая точка составляет 304,128(15) К [2] (30,978(15) °C) при 7,3773(30) МПа [2] (72,808(30) атм). Другая форма твердого диоксида углерода, наблюдаемая при высоком давлении, — аморфное стеклообразное твердое вещество. [28] Эта форма стекла, называемая карбония , производится путем переохлаждения нагретого CO2 при экстремальных давлениях (40–48 ГПа , или около 400 000 атмосфер) в алмазной наковальне . Это открытие подтвердило теорию о том, что диоксид углерода может существовать в стеклянном состоянии, подобно другим членам его элементарного семейства, таким как диоксид кремния (силикатное стекло) и диоксид германия . Однако, в отличие от силикатных и германиевых стекол, карбония нестабильна при нормальном давлении и возвращается в газообразное состояние при сбросе давления.
При температурах и давлениях выше критической точки углекислый газ ведет себя как сверхкритическая жидкость, известная как сверхкритический углекислый газ .
Таблица теплофизических свойств насыщенного жидкого диоксида углерода: [29] [30]
Таблица тепловых и физических свойств диоксида углерода (CO 2 ) при атмосферном давлении: [29] [30]
Углекислый газ является конечным продуктом клеточного дыхания в организмах, которые получают энергию путем расщепления сахаров, жиров и аминокислот с помощью кислорода как части своего метаболизма . Сюда входят все растения, водоросли и животные, а также аэробные грибы и бактерии. У позвоночных углекислый газ перемещается в крови из тканей тела в кожу (например, амфибии ) или жабры (например, рыбы ), откуда он растворяется в воде, или в легкие, откуда он выдыхается. Во время активного фотосинтеза растения могут поглощать больше углекислого газа из атмосферы, чем они выделяют при дыхании.

Фиксация углерода — это биохимический процесс, при котором атмосферный углекислый газ включается растениями, водорослями и цианобактериями в богатые энергией органические молекулы, такие как глюкоза , таким образом создавая свою собственную пищу посредством фотосинтеза. Фотосинтез использует углекислый газ и воду для производства сахаров, из которых могут быть построены другие органические соединения , а кислород производится как побочный продукт.
Рибулозо-1,5-бисфосфаткарбоксилаза оксигеназа , обычно сокращенно называемая RuBisCO, представляет собой фермент, участвующий в первом важном этапе фиксации углерода — образовании двух молекул 3-фосфоглицерата из CO2 и рибулозобисфосфата , как показано на схеме слева.
Считается, что RuBisCO является самым распространенным белком на Земле. [31]
Фототрофы используют продукты своего фотосинтеза в качестве внутренних источников пищи и в качестве сырья для биосинтеза более сложных органических молекул, таких как полисахариды , нуклеиновые кислоты и белки. Они используются для их собственного роста, а также в качестве основы пищевых цепей и сетей, которые питают другие организмы, включая животных, таких как мы. Некоторые важные фототрофы, кокколитофориды, синтезируют твердые чешуйки карбоната кальция . [32] Глобально значимым видом кокколитофорид является Emiliania huxleyi , чьи кальцитовые чешуйки сформировали основу многих осадочных пород, таких как известняк , где то, что ранее было атмосферным углеродом, может оставаться фиксированным в течение геологических временных масштабов.

Растения могут расти на 50% быстрее при концентрации 1000 ppm CO 2 по сравнению с условиями окружающей среды, хотя это не предполагает никаких изменений климата и ограничений на другие питательные вещества. [33] Повышенные уровни CO 2 вызывают ускоренный рост, что отражается на урожайности сельскохозяйственных культур: пшеница, рис и соя показывают увеличение урожайности на 12–14% при повышенном уровне CO 2 в экспериментах FACE. [34] [35]
Повышенная концентрация CO2 в атмосфере приводит к уменьшению количества устьиц, развивающихся на растениях [36] , что приводит к снижению потребления воды и повышению эффективности ее использования . [37] Исследования с использованием FACE показали, что обогащение CO2 приводит к снижению концентрации микроэлементов в сельскохозяйственных культурах. [38] Это может иметь косвенные последствия для других частей экосистем , поскольку травоядным животным нужно будет потреблять больше пищи, чтобы получить то же количество белка. [39]
Концентрация вторичных метаболитов, таких как фенилпропаноиды и флавоноиды, также может изменяться в растениях, подвергающихся воздействию высоких концентраций CO 2 . [40] [41]
Растения также выделяют CO2 во время дыхания, и поэтому большинство растений и водорослей, которые используют фотосинтез C3 , являются только чистыми поглотителями в течение дня. Хотя растущий лес будет поглощать много тонн CO2 каждый год, зрелый лес будет производить столько же CO2 от дыхания и разложения мертвых образцов (например, упавших ветвей), сколько используется в фотосинтезе растущими растениями. [42] Вопреки давнему мнению, что они углеродно-нейтральны, зрелые леса могут продолжать накапливать углерод [43] и оставаться ценными поглотителями углерода , помогая поддерживать углеродный баланс атмосферы Земли. Кроме того, и что крайне важно для жизни на Земле, фотосинтез фитопланктона потребляет растворенный CO2 в верхних слоях океана и тем самым способствует поглощению CO2 из атмосферы. [44]

Содержание углекислого газа в свежем воздухе (усредненное между уровнем моря и уровнем 10 кПа, т.е. около 30 км (19 миль) над уровнем моря) варьируется от 0,036% (360 частей на миллион) до 0,041% (412 частей на миллион) в зависимости от местоположения. [46]
CO 2 является удушающим газом и не классифицируется как токсичный или вредный в соответствии со стандартами Глобальной гармонизированной системы классификации и маркировки химических веществ Европейской экономической комиссии Организации Объединенных Наций с использованием Руководящих принципов ОЭСР по испытанию химических веществ . В концентрациях до 1% (10 000 ppm) он вызывает у некоторых людей сонливость и ощущение заложенности легких. [45] Концентрации от 7% до 10% (от 70 000 до 100 000 ppm) могут вызвать удушье даже при наличии достаточного количества кислорода, проявляющееся в виде головокружения, головной боли, нарушения зрения и слуха и потери сознания в течение нескольких минут или часа. [47] Физиологические эффекты острого воздействия углекислого газа объединены под термином гиперкапния , подвидом асфиксии .
Поскольку он тяжелее воздуха, в местах, где газ просачивается из-под земли (из-за подземной вулканической или геотермальной активности) в относительно высоких концентрациях, без рассеивающего воздействия ветра, он может собираться в защищенных/карманных местах ниже среднего уровня земли, в результате чего находящиеся там животные задыхаются. Питающиеся падалью животные, привлеченные тушами, затем также погибают. Дети были убиты таким же образом недалеко от города Гома выбросами CO2 из близлежащего вулкана Ньирагонго . [48] Суахилийское название этого явления — mazuku .

Адаптация к повышенным концентрациям CO 2 происходит у людей, включая изменение дыхания и выработку бикарбоната почками, чтобы сбалансировать эффекты закисления крови ( ацидоз ). Несколько исследований показали, что 2,0-процентные вдыхаемые концентрации могут использоваться для закрытых воздушных пространств (например, подводной лодки ), поскольку адаптация является физиологической и обратимой, поскольку ухудшение работоспособности или нормальной физической активности не происходит при этом уровне воздействия в течение пяти дней. [49] [50] Тем не менее, другие исследования показывают снижение когнитивной функции даже при гораздо более низких уровнях. [51] [52] Кроме того, при продолжающемся респираторном ацидозе адаптационные или компенсаторные механизмы не смогут обратить это состояние вспять.
Существует несколько исследований о влиянии на здоровье долгосрочного непрерывного воздействия CO 2 на людей и животных при уровнях ниже 1%. Пределы профессионального воздействия CO 2 были установлены в Соединенных Штатах на уровне 0,5% (5000 ppm) в течение восьмичасового периода. [53] При этой концентрации CO 2 экипаж Международной космической станции испытывал головные боли, летаргию, умственную заторможенность, эмоциональное раздражение и нарушение сна. [54] Исследования на животных при 0,5% CO 2 продемонстрировали кальцификацию почек и потерю костной массы после восьми недель воздействия. [55] Исследование людей, подвергавшихся воздействию в течение 2,5-часовых сеансов, продемонстрировало значительные негативные эффекты на когнитивные способности при концентрациях всего 0,1% (1000 ppm) CO 2 , вероятно, из-за вызванного CO 2 увеличения мозгового кровотока. [51] Другое исследование наблюдало снижение уровня базовой активности и использования информации при 1000 ppm по сравнению с 500 ppm. [52]
Однако обзор литературы показал, что надежная подгруппа исследований феномена углекислого газа, вызывающего когнитивные нарушения, показала лишь небольшое влияние на принятие решений высокого уровня (для концентраций ниже 5000 ppm). Большинство исследований были озадачены неадекватными планами исследований, комфортом окружающей среды, неопределенностями в дозах воздействия и различными используемыми когнитивными оценками. [56] Аналогичным образом исследование эффектов концентрации CO 2 в мотоциклетных шлемах подверглось критике за сомнительную методологию, заключающуюся в том, что оно не учитывало самоотчеты мотоциклистов и проводило измерения с использованием манекенов. Кроме того, когда достигались нормальные условия езды на мотоцикле (например, скорость на шоссе или в городе) или поднимался козырек, концентрация CO 2 снижалась до безопасного уровня (0,2%). [57] [58]

Плохая вентиляция является одной из основных причин чрезмерной концентрации CO2 в закрытых помещениях, что приводит к плохому качеству воздуха в помещении . Разница в концентрации углекислого газа над наружной концентрацией в условиях устойчивого состояния (когда пребывание и работа системы вентиляции достаточно длительны, чтобы концентрация CO2 стабилизировалась ) иногда используется для оценки скорости вентиляции на человека. [60] Более высокие концентрации CO2 связаны со здоровьем, комфортом и ухудшением производительности пользователей. [61] [62] Стандарт ASHRAE 62.1–2007 может привести к концентрации в помещении до 2100 ppm выше условий окружающей среды на открытом воздухе. Таким образом, если наружная концентрация составляет 400 ppm, концентрация в помещении может достичь 2500 ppm при скорости вентиляции, которая соответствует этому отраслевому консенсусному стандарту. Концентрации в плохо вентилируемых помещениях могут быть даже выше этой (диапазон 3000 или 4000 ppm).
Шахтеры, которые особенно уязвимы к воздействию газа из-за недостаточной вентиляции, называли смеси углекислого газа и азота « черной гнилью », «удушливой гнилью» или «удушливым дымом». До того, как были разработаны более эффективные технологии, шахтеры часто следили за опасными уровнями черной гнилости и других газов в шахтных стволах, принося с собой во время работы канарейку в клетке . Канарейка более чувствительна к удушающим газам, чем люди, и, теряя сознание, прекращала петь и падала со своего насеста. Лампа Дэви также могла обнаруживать высокие уровни черной гнилости (которая опускается и собирается у пола), горя менее ярко, в то время как метан , другой удушающий газ и взрывоопасный газ, заставлял лампу гореть ярче.
В феврале 2020 года три человека погибли от удушья на вечеринке в Москве, когда в бассейн добавили сухой лед (замороженный CO2) для его охлаждения. [ 63] Похожая авария произошла в 2018 году, когда женщина погибла от паров CO2 , исходивших от большого количества сухого льда, который она перевозила в своей машине. [64]
Люди проводят все больше времени в замкнутой атмосфере (около 80-90% времени в здании или транспортном средстве). По данным Французского агентства по продовольствию, окружающей среде и охране труда (ANSES) и различных субъектов во Франции, уровень CO 2 в воздухе внутри зданий (связанный с пребыванием людей или животных и наличием установок для сжигания ), взвешенный по обновлению воздуха, «обычно составляет от 350 до 2500 ppm». [65]
В домах, школах, детских садах и офисах нет систематических связей между уровнями CO 2 и другими загрязняющими веществами, а внутренний CO 2 статистически не является хорошим предиктором загрязняющих веществ, связанных с уличным дорожным (или воздушным и т. д.) движением. [66] CO 2 является параметром, который изменяется быстрее всего (с учетом гигрометрии и уровня кислорода, когда люди или животные собираются в закрытом или плохо проветриваемом помещении). В бедных странах многие открытые очаги являются источниками CO 2 и CO, выбрасываемых непосредственно в жилую среду. [67]
Локальные концентрации углекислого газа могут достигать высоких значений вблизи мощных источников, особенно тех, которые изолированы окружающей местностью. В горячем источнике Боссолето около Раполано-Терме в Тоскане , Италия, расположенном в чашеобразной впадине диаметром около 100 м (330 футов), концентрация CO 2 за ночь поднимается до более чем 75%, что достаточно для уничтожения насекомых и мелких животных. После восхода солнца газ рассеивается конвекцией. [68] Высокие концентрации CO 2, образующиеся в результате возмущения глубокой озерной воды, насыщенной CO 2 , как полагают, стали причиной 37 смертельных случаев в озере Монун , Камерун, в 1984 году и 1700 жертв в озере Ниос , Камерун, в 1986 году. [69]
Организм человека вырабатывает около 2,3 фунта (1,0 кг) углекислого газа в день [71] , что содержит 0,63 фунта (290 г) углерода.У людей этот углекислый газ переносится через венозную систему и выдыхается через легкие, что приводит к снижению его концентрации в артериях . Содержание углекислого газа в крови часто указывается как парциальное давление , которое представляет собой давление, которое имел бы углекислый газ, если бы он один занимал объем. [72] У людей содержание углекислого газа в крови показано в соседней таблице.
CO 2 переносится в крови тремя различными способами. Точные проценты варьируются между артериальной и венозной кровью.
Гемоглобин , основная молекула, переносящая кислород в эритроцитах , переносит как кислород, так и углекислый газ. Однако CO2, связанный с гемоглобином, не связывается с тем же местом, что и кислород. Вместо этого он объединяется с N-концевыми группами на четырех цепях глобина. Однако из-за аллостерических эффектов на молекулу гемоглобина связывание CO2 уменьшает количество кислорода, которое связывается при данном парциальном давлении кислорода. Это известно как эффект Холдейна и важно для транспортировки углекислого газа из тканей в легкие. И наоборот, повышение парциального давления CO2 или более низкий pH вызовут разгрузку кислорода из гемоглобина, что известно как эффект Бора .
Углекислый газ является одним из медиаторов локальной ауторегуляции кровоснабжения. Если его концентрация высока, капилляры расширяются, чтобы обеспечить больший приток крови к этой ткани. [74]
Ионы бикарбоната имеют решающее значение для регулирования pH крови. Частота дыхания человека влияет на уровень CO2 в его крови. Слишком медленное или поверхностное дыхание вызывает респираторный ацидоз , в то время как слишком быстрое дыхание приводит к гипервентиляции , которая может вызвать респираторный алкалоз . [75]
Хотя организму требуется кислород для метаболизма, низкий уровень кислорода обычно не стимулирует дыхание. Скорее, дыхание стимулируется более высоким уровнем углекислого газа. В результате вдыхание воздуха низкого давления или газовой смеси без кислорода (например, чистого азота) может привести к потере сознания без ощущения кислородного голодания . Это особенно опасно для летчиков-истребителей на большой высоте. Именно поэтому бортпроводники инструктируют пассажиров, в случае потери давления в салоне, сначала надеть кислородную маску на себя, прежде чем помогать другим; в противном случае можно потерять сознание. [73]
Дыхательные центры пытаются поддерживать артериальное давление CO2 на уровне 40 мм рт. ст . При преднамеренной гипервентиляции содержание CO2 в артериальной крови может быть снижено до 10–20 мм рт. ст. (содержание кислорода в крови мало затронуто), а дыхательный двигатель ослаблен. Вот почему после гипервентиляции можно задерживать дыхание дольше, чем без нее. Это несет риск того, что потеря сознания может произойти до того, как потребность в дыхании станет непреодолимой, поэтому гипервентиляция особенно опасна перед фридайвингом. [76]

В атмосфере Земли углекислый газ является следовым газом , который играет неотъемлемую роль в парниковом эффекте , углеродном цикле , фотосинтезе и океаническом углеродном цикле . Это один из трех основных парниковых газов в атмосфере Земли . Водяной пар является основным парниковым газом , по состоянию на 2010 год, внося 50% парникового эффекта, за ним следует углекислый газ с 20%. [77] Текущая глобальная средняя концентрация углекислого газа (CO2 ) в атмосфере составляет 421 ppm (0,04%) по состоянию на май 2022 года. [78] Это увеличение на 50% с начала промышленной революции , по сравнению с 280 ppm в течение 10 000 лет до середины 18 века. [79] [78] [80] Увеличение обусловлено деятельностью человека . [81]
По состоянию на март 2024 года среднемесячная концентрация CO 2 достигла нового рекордного максимума в 425,22 частей на миллион (ppm), что на 4,7 ppm больше, чем в марте 2023 года. Согласно последним измерениям, уровни еще больше возросли до 427,48 ppm. [82] Этот непрерывный рост концентрации CO 2 является явным индикатором продолжающегося глобального экологического стресса, в первую очередь обусловленного сжиганием ископаемого топлива , что является основной причиной этого роста, а также основным фактором изменения климата . [83] Другие важные виды деятельности человека, которые приводят к выбросам CO 2 , включают производство цемента , вырубку лесов и сжигание биомассы .
Углекислый газ является парниковым газом. Он поглощает и испускает инфракрасное излучение на своих двух инфракрасно-активных колебательных частотах. Две длины волн составляют 4,26 мкм (2347 см −1 ) (асимметричная растягивающая колебательная мода ) и 14,99 мкм (667 см −1 ) (изгибная колебательная мода). CO2 играет важную роль в воздействии на температуру поверхности Земли посредством парникового эффекта. [84] Излучение света с поверхности Земли наиболее интенсивно в инфракрасном диапазоне между 200 и 2500 см −1 , [85] в отличие от излучения света от гораздо более горячего Солнца , которое наиболее интенсивно в видимом диапазоне. Поглощение инфракрасного света на колебательных частотах атмосферного CO2 задерживает энергию вблизи поверхности, нагревая поверхность Земли и ее нижнюю атмосферу. Меньше энергии достигает верхней атмосферы, которая, следовательно, холоднее из-за этого поглощения. [86]
Увеличение концентрации CO 2 и других долгоживущих парниковых газов, таких как метан, в атмосфере увеличивает поглощение и испускание инфракрасного излучения атмосферой. Это привело к повышению средней глобальной температуры и закислению океана . Другим прямым эффектом является эффект удобрения CO 2 . Увеличение концентрации CO 2 в атмосфере вызывает ряд дополнительных последствий изменения климата для окружающей среды и условий жизни человека.
Современная концентрация CO 2 в атмосфере является самой высокой за 14 миллионов лет. [87] Концентрация CO 2 в атмосфере достигала 4000 ppm в кембрийский период около 500 миллионов лет назад и всего 180 ppm во время четвертичного оледенения последних двух миллионов лет. [79] Реконструированные температурные записи за последние 420 миллионов лет показывают, что концентрация CO 2 в атмосфере достигла пика примерно в 2000 ppm. Этот пик произошел в девонский период (400 миллионов лет назад). Другой пик произошел в триасовый период (220–200 миллионов лет назад). [88]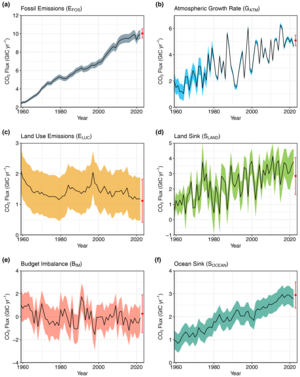
Углекислый газ растворяется в океане, образуя угольную кислоту ( H2CO3 ) , бикарбонат ( HCO−3) и карбонат ( CO2−3). В океанах растворено примерно в пятьдесят раз больше углекислого газа, чем в атмосфере. Океаны действуют как огромный поглотитель углерода и поглощают около трети CO 2 , выбрасываемого в результате деятельности человека. [90]
Закисление океана — это продолжающееся снижение pH океана Земли . В период с 1950 по 2020 год средний pH поверхности океана снизился примерно с 8,15 до 8,05. [91] Выбросы углекислого газа в результате деятельности человека являются основной причиной закисления океана, при этом уровень углекислого газа (CO2) в атмосфере превышает 422 ppm ( по состоянию на 2024 год [update]). [92] CO2 из атмосферы поглощается океанами. В результате этой химической реакции образуется угольная кислота ( H2CO3 ), которая диссоциирует на ион бикарбоната ( HCO−3) и ион водорода ( H + ). Присутствие свободных ионов водорода ( H + ) снижает pH океана, увеличивая кислотность (это не означает, что морская вода уже кислая; она все еще щелочная , с pH выше 8). Морские кальцифицирующие организмы , такие как моллюски и кораллы , особенно уязвимы, поскольку они используют карбонат кальция для построения раковин и скелетов. [93]
Изменение pH на 0,1 представляет собой 26%-ное увеличение концентрации ионов водорода в мировых океанах (шкала pH является логарифмической, поэтому изменение единицы pH на единицу эквивалентно десятикратному изменению концентрации ионов водорода). Уровень pH морской поверхности и насыщенность карбонатами различаются в зависимости от глубины и местоположения океана. Более холодные и высокоширотные воды способны поглощать больше CO2 . Это может привести к повышению кислотности, снижению уровней pH и насыщенности карбонатами в этих областях. Существует несколько других факторов, которые влияют на обмен CO2 между атмосферой и океаном и , таким образом, на локальное закисление океана. К ним относятся океанские течения и зоны апвеллинга , близость к крупным континентальным рекам, покрытие морского льда и атмосферный обмен азотом и серой от сжигания ископаемого топлива и сельского хозяйства . [94] [95] [96]
Изменения в химии океана могут иметь обширные прямые и косвенные эффекты на организмы и их среду обитания. Одно из самых важных последствий повышения кислотности океана связано с образованием раковин из карбоната кальция ( CaCO 3 ). [93] Этот процесс называется кальцификацией и важен для биологии и выживания широкого спектра морских организмов. Кальцификация включает осаждение растворенных ионов в твердые структуры CaCO 3 , структуры для многих морских организмов, таких как кокколитофориды , фораминиферы , ракообразные , моллюски и т. д. После того, как они сформированы, эти структуры CaCO 3 уязвимы для растворения , если окружающая морская вода не содержит насыщающих концентраций карбонатных ионов ( CO2−3).
Очень мало дополнительного углекислого газа, который добавляется в океан, остается в виде растворенного углекислого газа. Большая часть распадается на дополнительный бикарбонат и свободные ионы водорода. Увеличение водорода больше, чем увеличение бикарбоната, [97] создавая дисбаланс в реакции:
Для поддержания химического равновесия некоторые из карбонатных ионов, уже находящихся в океане, объединяются с некоторыми ионами водорода, чтобы создать дополнительный бикарбонат. Таким образом, концентрация карбонатных ионов в океане снижается, удаляя важный строительный блок для морских организмов, чтобы строить раковины или кальцинировать:
Углекислый газ также попадает в океаны через гидротермальные источники. Гидротермальный источник Шампань , обнаруженный на северо-западе вулкана Эйфуку в Марианской впадине , производит почти чистый жидкий углекислый газ, одно из двух известных мест в мире по состоянию на 2004 год, другое находится в Окинавском желобе . [98] Об обнаружении подводного озера жидкого углекислого газа в Окинавском желобе сообщалось в 2006 году. [99]
Углекислый газ является побочным продуктом ферментации сахара при варке пива , виски и других алкогольных напитков , а также при производстве биоэтанола . Дрожжи метаболизируют сахар , производя CO2 и этанол , также известный как спирт, следующим образом:
Все аэробные организмы производят CO 2 при окислении углеводов , жирных кислот и белков . Большое количество вовлеченных реакций чрезвычайно сложны и не поддаются простому описанию. См. клеточное дыхание , анаэробное дыхание и фотосинтез . Уравнение дыхания глюкозы и других моносахаридов :
Анаэробные организмы разлагают органический материал, производя метан и углекислый газ вместе со следами других соединений. [100] Независимо от типа органического материала, производство газов следует четко определенной кинетической схеме . Углекислый газ составляет около 40–45% газа, который выделяется при разложении на свалках (называемого « свалочным газом »). Большая часть оставшихся 50–55% — это метан. [101]
Углекислый газ можно получить путем перегонки из воздуха, но этот метод неэффективен. В промышленности углекислый газ в основном является неутилизированным отходом, производимым несколькими методами, которые могут применяться в различных масштабах. [102]
Сгорание всех видов углеродного топлива , таких как метан ( природный газ ), нефтяные дистилляты ( бензин , дизельное топливо , керосин , пропан ), уголь, древесина и органические вещества общего назначения, производит углекислый газ и, за исключением чистого углерода, воду. Например, химическая реакция между метаном и кислородом :
Железо восстанавливается из его оксидов коксом в доменной печи , в результате чего получается чугун и диоксид углерода: [103]
Углекислый газ является побочным продуктом промышленного производства водорода методом паровой конверсии и реакции конверсии водяного газа при производстве аммиака . Эти процессы начинаются с реакции воды и природного газа (в основном метана). [104] Это основной источник пищевого углекислого газа для использования при карбонизации пива и безалкогольных напитков , а также используется для оглушения животных, таких как птица . Летом 2018 года в Европе возникла нехватка углекислого газа для этих целей из-за временной остановки нескольких аммиачных заводов на техническое обслуживание. [105]
Его получают путем термического разложения известняка CaCO3 путем нагревания ( кальцинирования ) при температуре около 850 °C ( 1560 °F) при производстве негашеной извести ( оксида кальция , CaO), соединения, которое имеет множество промышленных применений:
Кислоты высвобождают CO2 из большинства карбонатов металлов. Следовательно, его можно получить непосредственно из природных источников углекислого газа , где он производится путем воздействия подкисленной воды на известняк или доломит . Реакция между соляной кислотой и карбонатом кальция (известняком или мелом) показана ниже:
Угольная кислота ( H 2 CO 3 ) затем разлагается на воду и CO 2 :
Такие реакции сопровождаются пенообразованием или пузырением, или и тем, и другим, по мере высвобождения газа. Они широко используются в промышленности, поскольку их можно использовать для нейтрализации отработанных кислотных потоков.
Углекислый газ используется в пищевой, нефтяной и химической промышленности. [102] Это соединение имеет различные коммерческие применения, но одно из его самых больших применений в качестве химиката — производство газированных напитков; он обеспечивает игристость газированных напитков, таких как газированная вода, пиво и игристое вино.
В химической промышленности углекислый газ в основном потребляется как ингредиент при производстве мочевины , а меньшая его часть используется для производства метанола и ряда других продуктов. [106] Некоторые производные карбоновых кислот, такие как салицилат натрия, получают с использованием CO2 по реакции Кольбе-Шмитта . [107]
В дополнение к обычным процессам, использующим CO 2 для химического производства, электрохимические методы также изучаются на исследовательском уровне. В частности, использование возобновляемой энергии для производства топлива из CO 2 (например, метанола) является привлекательным, поскольку это может привести к топливу, которое можно было бы легко транспортировать и использовать в обычных технологиях сжигания, но не иметь чистых выбросов CO 2. [108]
Растениям требуется углекислый газ для проведения фотосинтеза. Атмосфера теплиц может (если она большого размера, то должна) быть обогащена дополнительным CO 2 для поддержания и увеличения скорости роста растений. [109] [110] При очень высоких концентрациях (в 100 раз превышающих концентрацию в атмосфере или больше) углекислый газ может быть токсичным для животных, поэтому повышение концентрации до 10 000 ppm (1%) или выше в течение нескольких часов уничтожит вредителей, таких как белокрылки и паутинные клещи в теплице. [111] Некоторые растения более благосклонно реагируют на повышение концентрации углекислого газа, чем другие, что может привести к сдвигам вегетационного режима, таким как вторжение древесных растений . [112]

Углекислый газ — пищевая добавка , используемая в качестве пропеллента и регулятора кислотности в пищевой промышленности. Он одобрен для использования в ЕС [113] (указан под номером E290), США [114] , Австралии и Новой Зеландии [115] (указан под номером INS 290).
Конфета под названием Pop Rocks находится под давлением углекислого газа [116] около 4000 кПа (40 бар ; 580 фунтов на квадратный дюйм ). Когда ее кладут в рот, она растворяется (как и другие твердые конфеты) и выпускает пузырьки газа со слышимым хлопком.
Разрыхлители заставляют тесто подниматься, выделяя углекислый газ. [117] Пекарские дрожжи выделяют углекислый газ путем ферментации сахаров в тесте, в то время как химические разрыхлители, такие как разрыхлитель и пищевая сода, выделяют углекислый газ при нагревании или при воздействии кислот .
Углекислый газ используется для производства газированных безалкогольных напитков и содовой воды . Традиционно газирование пива и игристого вина происходило путем естественного брожения, но многие производители газируют эти напитки углекислым газом, полученным в процессе брожения. В случае с бутылочным и кеговым пивом наиболее распространенным методом является карбонизация переработанным углекислым газом. За исключением британского настоящего эля , разливное пиво обычно перекачивают из кег в холодном помещении или подвале в раздаточные краны на барной стойке с использованием сжатого углекислого газа, иногда смешанного с азотом.
Вкус газированной воды (и связанные с ним вкусовые ощущения в других газированных напитках) является эффектом растворенного углекислого газа, а не лопающихся пузырьков газа. Карбоангидраза 4 преобразует углекислый газ в угольную кислоту, что приводит к кислому вкусу, а также растворенный углекислый газ вызывает соматосенсорную реакцию. [118]

Углекислый газ в виде сухого льда часто используется во время фазы холодного замачивания в виноделии для быстрого охлаждения гроздей винограда после сбора, чтобы помочь предотвратить спонтанное брожение дикими дрожжами . Главное преимущество использования сухого льда перед водяным льдом заключается в том, что он охлаждает виноград без добавления какой-либо дополнительной воды, которая могла бы снизить концентрацию сахара в виноградном сусле и, таким образом, концентрацию алкоголя в готовом вине. Углекислый газ также используется для создания гипоксической среды для углекислой мацерации , процесса, используемого для производства вина Божоле .
Углекислый газ иногда используется для долива в бутылки с вином или другие емкости для хранения , такие как бочки, чтобы предотвратить окисление, хотя у него есть проблема, заключающаяся в том, что он может растворяться в вине, делая ранее негазированное вино слегка шипучим. По этой причине профессиональные виноделы предпочитают для этого процесса другие газы, такие как азот или аргон .
Углекислый газ часто используется для «оглушения» животных перед убоем. [119] «Оглушение» может быть неточным термином, поскольку животные не оглушаются немедленно и могут испытывать стресс. [120] [121]
Углекислый газ является одним из наиболее часто используемых сжатых газов для пневматических (сжатый газ) систем в переносных инструментах давления. Углекислый газ также используется в качестве атмосферы для сварки , хотя в сварочной дуге он реагирует, окисляя большинство металлов. Использование в автомобильной промышленности является обычным, несмотря на существенные доказательства того, что сварные швы, выполненные в углекислом газе, более хрупкие , чем те, которые выполнены в более инертных атмосферах. [122] При использовании для сварки MIG использование CO2 иногда называют сваркой MAG, для Metal Active Gas, поскольку CO2 может реагировать при этих высоких температурах. Он имеет тенденцию создавать более горячую ванну, чем действительно инертные атмосферы, улучшая характеристики потока. Хотя это может быть связано с атмосферными реакциями, происходящими в месте ванны. Это обычно противоположно желаемому эффекту при сварке, так как он имеет тенденцию охрупчивать место, но может не быть проблемой для общей сварки мягкой стали, где конечная пластичность не является серьезной проблемой.
Углекислый газ используется во многих потребительских товарах, которым требуется сжатый газ, потому что он недорогой и негорючий, и потому что он претерпевает фазовый переход из газа в жидкость при комнатной температуре при достижимом давлении приблизительно 60 бар (870 фунтов на кв. дюйм ; 59 атм ), что позволяет поместить в данный контейнер гораздо больше углекислого газа, чем в противном случае. Спасательные жилеты часто содержат баллоны с сжатым углекислым газом для быстрого надувания. Алюминиевые капсулы с CO2 также продаются в качестве запасов сжатого газа для пневматических пистолетов , маркеров/ружей для пейнтбола , накачивания велосипедных шин и для приготовления газированной воды . Высокие концентрации углекислого газа также могут использоваться для уничтожения вредителей. Жидкий углекислый газ используется при сверхкритической сушке некоторых пищевых продуктов и технологических материалов, при подготовке образцов для сканирующей электронной микроскопии [123] и при декофеинизации кофейных зерен .

Углекислый газ можно использовать для тушения пламени, заполняя им окружающую среду вокруг пламени. Сам по себе он не реагирует на тушение пламени, а лишает пламя кислорода, вытесняя его. Некоторые огнетушители , особенно те, которые предназначены для электрических пожаров , содержат жидкий углекислый газ под давлением. Углекислотные огнетушители хорошо работают при небольших возгораниях горючих жидкостей и электрических пожарах, но не при обычных возгораниях горючих веществ, потому что они не охлаждают горящие вещества в значительной степени, и когда углекислый газ рассеивается, они могут загореться при воздействии атмосферного кислорода . Они в основном используются в серверных комнатах. [124]
Углекислый газ также широко использовался в качестве огнетушащего вещества в стационарных системах противопожарной защиты для локального применения конкретных опасностей и полного затопления защищенного пространства. [125] Стандарты Международной морской организации признают системы с углекислым газом для противопожарной защиты трюмов и машинных отделений судов. Системы противопожарной защиты на основе углекислого газа были связаны с несколькими смертельными случаями, поскольку он может вызывать удушье при достаточно высоких концентрациях. Обзор систем с CO2 выявил 51 инцидент между 1975 годом и датой отчета (2000 год), в результате которых погибло 72 человека и 145 человек получили ранения. [126]
Жидкий диоксид углерода является хорошим растворителем для многих липофильных органических соединений и используется для декофеинизации кофе . [18] Диоксид углерода привлек внимание в фармацевтической и других отраслях химической обработки как менее токсичная альтернатива более традиционным растворителям, таким как органохлориды . По этой причине его также используют некоторые химчистки . Он используется при приготовлении некоторых аэрогелей из-за свойств сверхкритического диоксида углерода.
В медицине к кислороду добавляют до 5% углекислого газа (в 130 раз больше атмосферной концентрации) для стимуляции дыхания после апноэ и стабилизации баланса O2 /CO2 в крови.
Углекислый газ можно смешивать с 50% кислорода, образуя вдыхаемый газ; он известен как карбоген и имеет множество медицинских и исследовательских применений.
Другим медицинским применением являются мофетте — сухие спа, в которых в терапевтических целях используется углекислый газ из поствулканических выбросов.
В качестве рабочего тела в двигателе с энергетическим циклом Аллама используется сверхкритический CO2 .
Углекислый газ используется в улучшенной нефтеотдаче , где он впрыскивается в добывающие нефтяные скважины или рядом с ними, обычно в сверхкритических условиях, когда он становится смешивающимся с нефтью. Этот подход может увеличить первоначальную нефтеотдачу за счет снижения остаточной нефтенасыщенности на 7–23% дополнительно к первичной добыче . [127] Он действует как агент давления и, растворяясь в подземной сырой нефти , значительно снижает ее вязкость и изменяет химию поверхности, позволяя нефти быстрее течь через резервуар к скважине для удаления. [128] На зрелых нефтяных месторождениях используются обширные сети трубопроводов для транспортировки углекислого газа к точкам впрыска.
При улучшенном извлечении метана из угольных пластов углекислый газ будет закачиваться в угольный пласт для вытеснения метана, в отличие от существующих методов, которые в первую очередь полагаются на удаление воды (для снижения давления), чтобы заставить угольный пласт высвободить захваченный им метан. [129]
Было предложено, чтобы CO2 , образующийся при производстве электроэнергии, барботировался в прудах для стимуляции роста водорослей , которые затем можно было бы преобразовать в биодизельное топливо. [130] Штамм цианобактерии Synechococcus elongatus был генетически модифицирован для производства топлива изомасляного альдегида и изобутанола из CO2 с использованием фотосинтеза. [131]
Исследователи разработали электрокаталитическую технологию, используя ферменты, выделенные из бактерий, для питания химических реакций, которые преобразуют CO2 в топливо. [132] [133] [134]

Жидкий и твердый диоксид углерода являются важными хладагентами , особенно в пищевой промышленности, где они используются при транспортировке и хранении мороженого и других замороженных продуктов. Твердый диоксид углерода называется «сухим льдом» и используется для небольших партий, где холодильное оборудование непрактично. Твердый диоксид углерода всегда ниже −78,5 °C (−109,3 °F) при обычном атмосферном давлении, независимо от температуры воздуха.
Жидкий диоксид углерода (отраслевая номенклатура R744 или R-744) использовался в качестве хладагента до использования дихлордифторметана ( R12, соединение хлорфторуглерода (ХФУ)). [135] CO 2 может пережить возрождение, поскольку один из основных заменителей ХФУ, 1,1,1,2-тетрафторэтан ( R134a , соединение гидрофторуглерода (ГФУ)), вносит больший вклад в изменение климата , чем CO 2. Физические свойства CO 2 весьма благоприятны для охлаждения, заморозки и нагрева, имея высокую объемную охлаждающую способность. Из-за необходимости работать при давлении до 130 бар (1900 фунтов на кв. дюйм; 13 000 кПа), системы CO 2 требуют высокомеханически прочных резервуаров и компонентов, которые уже были разработаны для массового производства во многих секторах. В автомобильном кондиционировании воздуха, в более чем 90% всех условий вождения для широт выше 50°, CO 2 (R744) работает более эффективно, чем системы, использующие ГФУ (например, R134a). Его экологические преимущества ( GWP 1, не разрушает озоновый слой, нетоксичен, не воспламеняется) могут сделать его будущей рабочей жидкостью для замены текущих ГФУ в автомобилях, супермаркетах и водонагревателях с тепловыми насосами, среди прочего. Coca-Cola выставила на рынок охладители напитков на основе CO 2 , а армия США заинтересована в технологии охлаждения и отопления на основе CO 2 . [136] [137]

Диоксид углерода является рабочей средой в лазере на углекислом газе , который является одним из самых ранних типов лазеров.
Углекислый газ можно использовать в качестве средства контроля pH в плавательных бассейнах [138] путем постоянного добавления газа в воду, тем самым предотвращая повышение pH. Среди преимуществ этого является избежание работы с (более опасными) кислотами. Аналогичным образом, он также используется в рифовых аквариумах , где он обычно используется в кальциевых реакторах для временного снижения pH воды, проходящей через карбонат кальция , чтобы позволить карбонату кальция более свободно растворяться в воде, где он используется некоторыми кораллами для построения своего скелета.
Используется в качестве основного теплоносителя в британском усовершенствованном газоохлаждаемом реакторе для производства ядерной энергии.
Carbon dioxide induction is commonly used for the euthanasia of laboratory research animals. Methods to administer CO2 include placing animals directly into a closed, prefilled chamber containing CO2, or exposure to a gradually increasing concentration of CO2. The American Veterinary Medical Association's 2020 guidelines for carbon dioxide induction state that a displacement rate of 30–70% of the chamber or cage volume per minute is optimal for the humane euthanasia of small rodents.[139]: 5, 31 Percentages of CO2 vary for different species, based on identified optimal percentages to minimize distress.[139]: 22
Carbon dioxide is also used in several related cleaning and surface-preparation techniques.

Carbon dioxide was the first gas to be described as a discrete substance. In about 1640,[140] the Flemish chemist Jan Baptist van Helmont observed that when he burned charcoal in a closed vessel, the mass of the resulting ash was much less than that of the original charcoal. His interpretation was that the rest of the charcoal had been transmuted into an invisible substance he termed a "gas" (from Greek "chaos") or "wild spirit" (spiritus sylvestris).[141]
The properties of carbon dioxide were further studied in the 1750s by the Scottish physician Joseph Black. He found that limestone (calcium carbonate) could be heated or treated with acids to yield a gas he called "fixed air". He observed that the fixed air was denser than air and supported neither flame nor animal life. Black also found that when bubbled through limewater (a saturated aqueous solution of calcium hydroxide), it would precipitate calcium carbonate. He used this phenomenon to illustrate that carbon dioxide is produced by animal respiration and microbial fermentation. In 1772, English chemist Joseph Priestley published a paper entitled Impregnating Water with Fixed Air in which he described a process of dripping sulfuric acid (or oil of vitriol as Priestley knew it) on chalk in order to produce carbon dioxide, and forcing the gas to dissolve by agitating a bowl of water in contact with the gas.[142]
Carbon dioxide was first liquefied (at elevated pressures) in 1823 by Humphry Davy and Michael Faraday.[143] The earliest description of solid carbon dioxide (dry ice) was given by the French inventor Adrien-Jean-Pierre Thilorier, who in 1835 opened a pressurized container of liquid carbon dioxide, only to find that the cooling produced by the rapid evaporation of the liquid yielded a "snow" of solid CO2.[144][145]
Carbon dioxide in combination with nitrogen was known from earlier times as Blackdamp, stythe or choke damp.[b] Along with the other types of damp it was encountered in mining operations and well sinking. Slow oxidation of coal and biological processes replaced the oxygen to create a suffocating mixture of nitrogen and carbon dioxide.[146]
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast
{{cite report}}: CS1 maint: unfit URL (link){{cite report}}: CS1 maint: unfit URL (link)The victims were connected to Instagram influencer Yekaterina Didenko.
Figure 1f
{{cite book}}: |website= ignored (help)