В металлоорганической химии литийорганические реагенты представляют собой химические соединения , содержащие связи углерод - литий (C–Li) . Эти реагенты важны в органическом синтезе и часто используются для переноса органической группы или атома лития к субстратам на синтетических этапах посредством нуклеофильного присоединения или простого депротонирования . [1] Литийорганические реагенты используются в промышленности в качестве инициатора анионной полимеризации , что приводит к получению различных эластомеров . Они также применяются в асимметрическом синтезе в фармацевтической промышленности. [2] Из-за большой разницы в электроотрицательности между атомом углерода и атомом лития связь C–Li является сильно ионной . Благодаря полярной природе связи C–Li литийорганические реагенты являются хорошими нуклеофилами и сильными основаниями. Для лабораторного органического синтеза многие литийорганические реагенты коммерчески доступны в форме раствора. Эти реагенты обладают высокой реакционной способностью и иногда являются пирофорными .


Исследования литийорганических реагентов начались в 1930-х годах и были пионерами Карла Циглера , Георга Виттига и Генри Гилмана . По сравнению с реагентами Гриньяра (магния) , литийорганические реагенты часто могут выполнять те же реакции с более высокими скоростями и более высокими выходами, например, в случае металлирования . [3] С тех пор литийорганические реагенты обогнали реагенты Гриньяра в общем использовании. [4]
Хотя простые алкиллитиевые виды часто представляются как мономер RLi, они существуют в виде агрегатов ( олигомеров ) или полимеров. [5] Степень агрегации зависит от органического заместителя и присутствия других лигандов. [6] [7] Эти структуры были выяснены различными методами, в частности, 6 Li, 7 Li и 13 C ЯМР-спектроскопией и рентгеновским дифракционным анализом. [1] Вычислительная химия поддерживает эти назначения. [5]

Относительная электроотрицательность углерода и лития предполагает, что связь C−Li будет высокополярной. [8] [9] [10] Однако некоторые литийорганические соединения обладают такими свойствами, как растворимость в неполярных растворителях, что усложняет проблему. [8] Хотя большинство данных предполагают, что связь C−Li по сути ионная, ведутся споры о том, насколько ковалентный характер в ней присутствует. [9] [10] Согласно одной из оценок, процент ионного характера алкиллитиевых соединений составляет от 80 до 88%. [11]
В аллиллитиевых соединениях катион лития координируется с поверхностью π-связи углерода в η 3- типе вместо локализованного карбанионного центра, поэтому аллиллитии часто менее агрегированы, чем алкиллитиевые. [6] [12] В ариллитиевых комплексах катион лития координируется с одним карбанионным центром через связь типа Li−C σ. [6] [13]
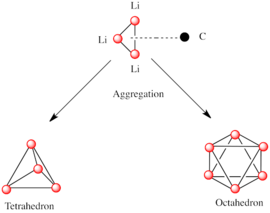
Как и другие виды, состоящие из полярных субъединиц, литийорганические виды агрегируют. [7] [14] На образование агрегатов влияют электростатические взаимодействия, координация между литием и окружающими молекулами растворителя или полярными добавками, а также стерические эффекты. [7]
Базовым строительным блоком для построения более сложных структур является карбанионный центр, взаимодействующий с треугольником Li 3 в η 3 -образе. [5] В простых алкиллитиевых реагентах эти треугольники объединяются, образуя тетраэдрические или октаэдрические структуры. Например, метиллитий , этиллитий и трет -бутиллитий существуют в тетрамере [RLi] 4 . Метиллитий существует в виде тетрамеров в кластере кубанового типа в твердом состоянии, с четырьмя литиевыми центрами, образующими тетраэдр. Каждый метанид в тетрамере в метиллитии может иметь агостическое взаимодействие с катионами лития в соседних тетрамерах. [5] [7] Этиллитий и трет -бутиллитий, с другой стороны, не проявляют этого взаимодействия и, таким образом, растворимы в неполярных углеводородных растворителях. Другой класс алкиллития принимает гексамерные структуры, такие как н -бутиллитий , изопропиллитий и циклогексаниллитий. [5]
Обычные амиды лития, например, литий бис(триметилсилил)амид и литий диизопропиламид , также подвержены агрегации. [15] Амиды лития принимают структуры типа полимерной лестницы в некоординирующем растворителе в твердом состоянии, и они обычно существуют в виде димеров в эфирных растворителях. В присутствии сильно донорных лигандов образуются три- или тетрамерные литиевые центры. [16] Например, LDA существует в основном в виде димеров в ТГФ. [15] Структуры обычных амидов лития, таких как диизопропиламид лития (LDA) и гексаметилдисилазид лития (LiHMDS), были тщательно изучены Коллумом и его коллегами с использованием ЯМР-спектроскопии . [17] Другим важным классом реагентов являются силиллитии, широко используемые в синтезе металлоорганических комплексов и полисиланових дендримеров . [7] [18] В твердом состоянии, в отличие от алкиллитиевых реагентов, большинство силиллитиев имеют тенденцию образовывать мономерные структуры, координированные с молекулами растворителя, такими как ТГФ, и только несколько силиллитиев были охарактеризованы как более высокие агрегаты. [7] Это различие может быть результатом метода приготовления силиллитиев, стерических препятствий, вызванных объемными алкильными заместителями на кремнии, и менее поляризованной природы связей Si-Li. Добавление сильно донорных лигандов, таких как TMEDA и (-)- спартеин , может вытеснять координирующие молекулы растворителя в силиллитиях. [7]
Литийорганические реагенты могут принимать структуры в растворе, которые отличаются от твердого состояния. [6] [19] ЯМР-спектроскопия стала мощным инструментом для изучения литийорганических агрегатов в растворе. Для алкиллитиевых видов связь C−Li J часто может использоваться для определения количества лития, взаимодействующего с карбанионным центром, и того, являются ли эти взаимодействия статическими или динамическими. [6] Отдельные сигналы ЯМР также могут отличать наличие нескольких агрегатов от общей мономерной единицы. [20]
Литийорганические соединения связывают основания Льюиса, такие как тетрагидрофуран (ТГФ), диэтиловый эфир ( Et2O ), тетраметилэтилендиамин (ТМЭДА) или гексаметилфосфорамид (ГМФ). [5] Метиллитий представляет собой особый случай: его тетрамерная структура не подвержена влиянию эфира или даже ГМФ. [7] С другой стороны, ТГФ дезагрегирует гексамерный бутиллитий: тетрамер является основным видом, а ΔG для взаимопревращения между тетрамером и димером составляет около 11 ккал/моль. [21] ТМЭДА также может хелатировать катионы лития в н -бутиллитии и образовывать сольватированные димеры, такие как [(ТМЭДА)LiBu-n)] 2 . [5] [6] Было показано, что фениллитий существует в виде искаженного тетрамера в кристаллизованном эфирном сольвате и в виде смеси димера и тетрамера в эфирном растворе. [6]
Поскольку структуры литийорганических реагентов изменяются в зависимости от их химической среды, то же самое происходит и с их реакционной способностью и селективностью. [7] [22] Один из вопросов, связанных с соотношением структуры и реакционной способности, заключается в том, существует ли корреляция между степенью агрегации и реакционной способностью литийорганических реагентов. Первоначально предполагалось, что низшие агрегаты, такие как мономеры, более реакционноспособны в алкиллитиях. [23] Однако также были обнаружены пути реакции, в которых димер или другие олигомеры являются реакционноспособными видами, [24] а для амидов лития, таких как LDA, реакции на основе димеров являются обычным явлением. [25] Серия исследований кинетики растворов реакций, опосредованных LDA, предполагает, что низшие агрегаты енолятов не обязательно приводят к более высокой реакционной способности. [17]
Кроме того, некоторые основания Льюиса увеличивают реакционную способность литийорганических соединений. [26] [27] Однако не всегда ясно, действуют ли эти добавки как сильные хелатирующие лиганды, и как наблюдаемое увеличение реакционной способности связано со структурными изменениями в агрегатах, вызванными этими добавками. [26] [27] Например, TMEDA увеличивает скорости и эффективность многих реакций с участием литийорганических реагентов. [7] По отношению к алкиллитиевым реагентам TMEDA действует как донорный лиганд, снижает степень агрегации [5] и увеличивает нуклеофильность этих видов. [28] Однако TMEDA не всегда действует как донорный лиганд для катиона лития, особенно в присутствии анионных кислородных и азотных центров. Например, он слабо взаимодействует с LDA и LiHMDS даже в углеводородных растворителях без конкурирующих донорных лигандов. [29] При литировании имина, в то время как THF действует как сильный донорный лиганд для LiHMDS, слабо координирующийся TMEDA легко диссоциирует от LiHMDS, что приводит к образованию димеров LiHMDS, которые являются более реакционноспособными видами. Таким образом, в случае LiHMDS, TMEDA не увеличивает реакционную способность за счет снижения состояния агрегации. [30] Кроме того, в отличие от простых алкиллитиевых соединений, TMEDA не дезагрегирует литийацетофенолят в растворе THF. [6] [31] Добавление HMPA к амидам лития, таким как LiHMDS и LDA, часто приводит к смеси агрегатов димера/мономера в THF. Однако соотношение видов димера/мономера не меняется с увеличением концентрации HMPA, таким образом, наблюдаемое увеличение реакционной способности не является результатом дезагрегации. Механизм того, как эти добавки увеличивают реакционную способность, все еще исследуется. [22]
Связь C−Li в литийорганических реагентах сильно поляризована. В результате углерод притягивает большую часть электронной плотности в связи и напоминает карбанион. Таким образом, литийорганические реагенты являются сильно основными и нуклеофильными. Некоторые из наиболее распространенных применений литийорганических реагентов в синтезе включают их использование в качестве нуклеофилов, сильных оснований для депротонирования, инициаторов полимеризации и исходного материала для получения других металлоорганических соединений.
Как нуклеофилы, литийорганические реагенты подвергаются реакциям карболитирования, в ходе которых связь углерод-литий присоединяется через двойную или тройную связь углерод - углерод, образуя новые виды литийорганических соединений. [32] Эта реакция является наиболее широко используемой реакцией литийорганических соединений. Карболитирование является ключевым в процессах анионной полимеризации, а н -бутиллитий используется в качестве катализатора для инициирования полимеризации стирола , бутадиена или изопрена или их смесей. [33] [34]
Другое применение, которое использует эту реакционную способность, - это образование карбоциклических и гетероциклических соединений путем внутримолекулярного карболитирования. [32] Как форма анионной циклизации, реакции внутримолекулярного карболитирования предлагают несколько преимуществ по сравнению с радикальной циклизацией . Во-первых, для продуктов циклических литийорганических соединений возможно реагировать с электрофилами, тогда как часто бывает трудно захватить радикальное промежуточное соединение соответствующей структуры. Во-вторых, анионные циклизации часто более регио- и стереоспецифичны, чем радикальная циклизация, особенно в случае 5-гексениллития. Внутримолекулярное карболитирование позволяет присоединять алкил-, виниллитий к тройным связям и моноалкилзамещенным двойным связям. Ариллитии также могут подвергаться присоединению, если образуется 5-членное кольцо. Ограничения внутримолекулярного карболитирования включают в себя трудности формирования 3- или 4-членных колец, поскольку промежуточные циклические литийорганические соединения часто склонны подвергаться раскрытию колец. [32] Ниже приведен пример реакции внутримолекулярного карболитирования. Литиевые соединения, полученные в результате обмена литий-галоген, циклизуются с образованием виниллития через замыкание кольца 5-экзо-триг. Виниллитиевые соединения далее реагируют с электрофилами и производят функционализированные циклопентилиденовые соединения. [35]
Нуклеофильные литийорганические реагенты могут присоединяться к электрофильным карбонильным двойным связям, образуя связи углерод - углерод. Они могут реагировать с альдегидами и кетонами , образуя спирты . Присоединение происходит в основном посредством полярного присоединения, при котором нуклеофильные литийорганические виды атакуют с экваториального направления и производят аксиальный спирт. [36] Добавление солей лития, таких как LiClO 4, может улучшить стереоселективность реакции. [37]
Когда кетон стерически затруднен, использование реагентов Гриньяра часто приводит к восстановлению карбонильной группы вместо присоединения. [36] Однако алкиллитиевые реагенты с меньшей вероятностью восстанавливают кетон и могут использоваться для синтеза замещенных спиртов. [38] Ниже приведен пример присоединения этиллития к адамантону для получения третичного спирта. [39]
Литийорганические реагенты также лучше, чем реагенты Гриньяра, в их способности реагировать с карбоновыми кислотами с образованием кетонов. [36] Эту реакцию можно оптимизировать, тщательно контролируя количество добавляемого литийорганического реагента или используя триметилсилилхлорид для гашения избытка литиевого реагента. [40] Более распространенный способ синтеза кетонов — это добавление литийорганических реагентов к амидам Вайнреба ( N -метокси- N -метиламидам). Эта реакция дает кетоны, когда литийорганические реагенты используются в избытке, из-за хелатирования иона лития между N -метокси-кислородом и карбонильным кислородом, что образует тетраэдрический промежуточный продукт, который разрушается при кислотной обработке. [41]
Литийорганические реагенты также реагируют с диоксидом углерода , образуя после обработки карбоновые кислоты . [42]
В случае еноновых субстратов, где возможны два участка нуклеофильного присоединения (1,2-присоединение к карбонильному углероду или 1,4- сопряженное присоединение к β-углероду), наиболее высокореакционноспособные литийорганические соединения благоприятствуют 1,2-присоединению, однако существует несколько способов заставить литийорганические реагенты подвергнуться сопряженному присоединению. Во-первых, поскольку 1,4-аддукт, вероятно, будет более термодинамически выгодным соединением, сопряженное присоединение может быть достигнуто посредством уравновешивания (изомеризации двух продуктов), особенно когда литийнуклеофил слабый, а 1,2-присоединение обратимо. Во-вторых, добавление донорных лигандов к реакции образует гетероатомно-стабилизированные литиевые соединения, которые благоприятствуют 1,4-сопряженному присоединению. В одном примере добавление низкого уровня HMPA к растворителю благоприятствует 1,4-присоединению. В отсутствие донорного лиганда катион лития тесно координируется с атомом кислорода, однако, когда катион лития сольватируется HMPA, координация между карбонильным кислородом и ионом лития ослабевает. Этот метод, как правило, не может быть использован для воздействия на региоселективность алкил- и ариллитиевых реагентов. [43] [44]
Литийорганические реагенты также могут выполнять энантиоселективное нуклеофильное присоединение к карбонилу и его производным, часто в присутствии хиральных лигандов. Эта реакционная способность широко применяется в промышленных синтезах фармацевтических соединений. Примером является синтез Эфавиренза , мощного ингибитора обратной транскриптазы ВИЧ , компанией Merck and Dupont . Ацетиленид лития добавляется к прохиральному кетону для получения хирального спиртового продукта. Структура активного промежуточного продукта реакции была определена с помощью исследований ЯМР-спектроскопии в состоянии раствора и рентгеновской кристаллографии твердого состояния, как кубический тетрамер 2:2. [45]
Литийорганические реагенты могут служить нуклеофилами и проводить реакции типа S N 2 с алкил- или аллильными галогенидами. [46] Хотя они считаются более реакционноспособными, чем реагенты Гриньяра в алкилировании, их использование все еще ограничено из-за конкурирующих побочных реакций, таких как радикальные реакции или обмен металл - галоген. Большинство литийорганических реагентов, используемых в алкилировании, более стабилизированы, менее основные и менее агрегированные, такие как гетероатомно-стабилизированные, арил- или аллиллитиевые реагенты. [6] Было показано, что HMPA увеличивает скорость реакции и выходы продуктов, а реакционная способность ариллитиевых реагентов часто повышается за счет добавления алкоголятов калия. [36] Литийорганические реагенты также могут проводить нуклеофильные атаки с эпоксидами с образованием спиртов.
Литийорганические реагенты обеспечивают широкий диапазон основности . трет -бутиллитий с тремя слабоэлектронодонорными алкильными группами является самым сильным основанием, доступным на рынке ( pKa = 53). В результате кислотные протоны на −OH, −NH и −SH часто защищены в присутствии литийорганических реагентов. Некоторые обычно используемые литиевые основания представляют собой алкиллитиевые виды, такие как н -бутиллитий и диалкиламиды лития (LiNR 2 ). Реагенты с объемными группами R, такие как диизопропиламид лития (LDA) и бис(триметилсилил)амид лития (LiHMDS), часто стерически затруднены для нуклеофильного присоединения и, таким образом, более селективны по отношению к депротонированию. Диалкиламиды лития (LiNR 2 ) широко используются в образовании енолятов и альдольной реакции. [47] Реакционная способность и селективность этих оснований также зависят от растворителей и других противоионов.
Металлирование литийорганическими реагентами, также известное как литирование или литий-водородный обмен, достигается, когда литийорганический реагент, чаще всего алкиллитий, отщепляет протон и образует новую литийорганическую форму.
Распространенными реагентами металлирования являются бутиллитии. Трет -бутиллитий и втор -бутиллитий, как правило, более реакционноспособны и обладают лучшей селективностью, чем н -бутиллитий, однако они также более дороги и сложны в обращении. [47] Металлирование является распространенным способом приготовления универсальных литийорганических реагентов. Положение металлирования в основном контролируется кислотностью связи CH. Литирование часто происходит в положении α по отношению к электроноакцепторным группам, поскольку они хорошо стабилизируют электронную плотность аниона. Направляющие группы на ароматических соединениях и гетероциклах обеспечивают региоселективные сайты металлирования; направленное орто-металлирование является важным классом реакций металлирования. Металлированные сульфоны, ацильные группы и α-металлированные амиды являются важными промежуточными продуктами в химическом синтезе. Металлирование аллилового эфира алкиллитием или LDA образует анион α по отношению к кислороду и может перейти к перегруппировке 2,3-Виттига . Добавление донорных лигандов, таких как TMEDA и HMPA, может увеличить скорость металлирования и расширить область применения субстрата. [48] Хиральные литийорганические реагенты могут быть получены посредством асимметричного металлирования. [49]
Направленное ортометаллирование является важным инструментом в синтезе региоспецифических замещенных ароматических соединений. Этот подход к литированию и последующему гашению промежуточных литиевых видов электрофилом часто лучше, чем электрофильное ароматическое замещение из-за его высокой региоселективности. Эта реакция протекает через депротонирование литийорганическими реагентами в положениях α к группе прямого металлирования (DMG) на ароматическом кольце. DMG часто является функциональной группой, содержащей гетероатом, который является основным по Льюису и может координироваться с кислым по Льюису катионом лития. Это создает эффект близости, вызванный комплексом, который направляет депротонирование в положение α для образования ариллитиевых видов, которые могут далее реагировать с электрофилами. Некоторые из наиболее эффективных DMG - это амиды, карбаматы , сульфоны и сульфонамиды . Они являются сильными электроноакцепторными группами, которые увеличивают кислотность альфа-протонов на ароматическом кольце. В присутствии двух DMG металлирование часто происходит в орто-положении к более сильной направляющей группе, хотя также наблюдаются смешанные продукты. Ряд гетероциклов, содержащих кислотные протоны, также могут подвергаться орто-металлированию. Однако для гетероциклов с низким содержанием электронов обычно используются основания амида лития, такие как LDA, поскольку было замечено, что алкиллитий выполняет присоединение к гетероциклам с низким содержанием электронов, а не депротонирование. В некоторых комплексах переходных металлов и аренов, таких как ферроцен , переходный металл притягивает электронную плотность из арена, тем самым делая ароматические протоны более кислыми и готовыми к орто-металлированию. [50]
Добавление алкоголята калия к алкиллитию значительно увеличивает основность литийорганических соединений. [51] Наиболее распространенное «супероснование» может быть образовано путем добавления KOtBu к бутиллитию, часто сокращенно называемое реагентами «LiCKOR». Эти «супероснования» являются высокореактивными и часто стереоселективными реагентами. В приведенном ниже примере основание LiCKOR генерирует стереоспецифические виды кротилборонатов посредством металлирования и последующего обмена литий-металлоид. [52]
Энантиообогащенные литийорганические соединения могут быть получены посредством асимметричного металлирования прохиральных субстратов. Асимметричная индукция требует присутствия хирального лиганда, такого как (-)- спартеин . [49] Энантиомерное соотношение хиральных литиевых соединений часто зависит от различий в скоростях депротонирования. В приведенном ниже примере обработка N -Boc- N -бензиламина н -бутиллитием в присутствии (-)-спартеина дает один энантиомер продукта с высоким энантиомерным избытком . Трансметаллирование с триметилоловохлоридом дает противоположный энантиомер. [53]
Еноляты лития образуются путем депротонирования связи C−H α в карбонильной группе литийорганическими соединениями. Еноляты лития широко используются в качестве нуклеофилов в реакциях образования связи углерод - углерод, таких как альдольная конденсация и алкилирование. Они также являются важным промежуточным продуктом в образовании эфира силиленола .
Образование енолята лития можно обобщить как реакцию кислота - основание, в которой относительно кислый протон α к карбонильной группе (pK = 20-28 в ДМСО) реагирует с литийорганическим основанием. Обычно используются сильные ненуклеофильные основания, особенно амиды лития, такие как LDA, LiHMDS и LiTMP. ТГФ и ДМСО являются обычными растворителями в реакциях енолята лития. [54]
Стереохимия и механизм образования енолятов вызвали большой интерес в химическом сообществе. На результат стереохимии енолятов влияют многие факторы, такие как стерические эффекты, растворитель, полярные добавки и типы литийорганических оснований. Среди многих моделей, используемых для объяснения и прогнозирования селективности в стереохимии енолятов лития, есть модель Ирландии. [55]
В этом предположении мономерный LDA реагирует с карбонильным субстратом и образует циклическое переходное состояние типа Циммермана-Тракслера . (E)-енолят является предпочтительным из-за неблагоприятного взаимодействия син-пентана в переходном состоянии (Z)-енолята. [54]

Добавление полярных добавок, таких как HMPA или DMPU, способствует образованию (Z)-енолятов. Модель Айрленда утверждает, что эти донорные лиганды координируются с катионами лития, в результате чего взаимодействие карбонильного кислорода и лития уменьшается, а переходное состояние не так сильно связано, как шестичленное кресло. Процент (Z)-енолятов также увеличивается при использовании литиевых оснований с более объемными боковыми цепями (такими как LiHMDS). [54] Однако механизм того, как эти добавки меняют стереоселективность, все еще обсуждается.
В модели Ирландии были некоторые проблемы, поскольку она изображает литиевые виды как мономер в переходном состоянии. В действительности, в растворах енолятов лития часто наблюдаются различные агрегаты лития, и в зависимости от конкретного субстрата, растворителя и условий реакции может быть сложно определить, какой агрегат является фактическим реактивным видом в растворе. [54]
Обмен лития с галогеном включает в себя обмен гетероатомами между органогалогенидными и литийорганическими соединениями.
Обмен литий-галоген очень полезен при приготовлении новых литийорганических реагентов. Применение обмена литий-галоген иллюстрируется циклизацией Пархэма. [56]
Литийорганические реагенты часто используются для получения других металлоорганических соединений путем трансметаллирования. Медьорганические, оловоорганические , кремнийорганические, борорганические, фосфорорганические, церийорганические и сероорганические соединения часто получают путем взаимодействия литийорганических реагентов с соответствующими электрофилами.
Распространенные типы трансметаллирования включают обмен Li/Sn, Li/Hg и Li/Te, которые быстры при низкой температуре. [47] Преимущество обмена Li/Sn заключается в том, что прекурсоры триалкилстаннана подвергаются небольшому количеству побочных реакций, поскольку полученные побочные продукты n-Bu 3 Sn не реагируют с алкиллитиевыми реагентами. [47] В следующем примере винилстаннан, полученный путем гидростаннилирования терминального алкина, образует виниллитий посредством трансметаллирования с n-BuLi. [57]
Литийорганические соединения также можно использовать для получения цинкорганических соединений путем трансметаллирования с солями цинка. [58]
Диорганокупраты лития могут быть образованы путем реакции алкиллитиевых видов с галогенидом меди(I). Полученные органокупраты обычно менее реакционноспособны по отношению к альдегидам и кетонам, чем литийорганические реагенты или реактивы Гриньяра. [59]
Большинство простых алкиллитиевых реагентов и обычных амидов лития коммерчески доступны в различных растворителях и концентрациях. Литийорганические реагенты также могут быть приготовлены в лаборатории. Ниже приведены некоторые распространенные методы приготовления литийорганических реагентов.
Восстановление алкилгалогенида металлическим литием может дать простые алкил- и арильные литийорганические реагенты. [36]
Промышленное получение литийорганических реагентов достигается с помощью этого метода путем обработки алкилхлорида металлическим литием, содержащим 0,5–2 % натрия . Конверсия является высокоэкзотермической . Натрий инициирует радикальный путь и увеличивает скорость. [60] Восстановление происходит по радикальному пути. Ниже приведен пример получения функционализированного литиевого реагента с использованием восстановления металлическим литием. [61] Иногда металлический литий в виде тонкодисперсных порошков используется в реакции с определенными катализаторами, такими как нафталин или 4,4'-ди-трет-бутилбифенил (DTBB). Другим субстратом, который можно восстановить металлическим литием для получения алкиллитиевых реагентов, являются сульфиды. Восстановление сульфидов полезно при образовании функционализированных литийорганических реагентов, таких как альфа-литиоэфиры, сульфиды и силаны. [62]
Вторым методом приготовления литийорганических реагентов является металлирование (литий-водородный обмен). Относительная кислотность атомов водорода контролирует положение литиирования.
Это наиболее распространенный метод получения алкиниллитиевых реагентов, поскольку терминальный водород, связанный с sp2 -углеродом, очень кислый и легко депротонируется. [36] Для ароматических соединений положение литиирования также определяется направляющим эффектом замещающих групп. [63] Некоторые из наиболее эффективных направляющих замещающих групп - это алкокси, амидо, сульфоксид, сульфонил. Металлирование часто происходит в орто-положении к этим заместителям. В гетероароматических соединениях металлирование обычно происходит в орто-положении к гетероатому. [36] [63]
См. литий-галогеновый обмен (в разделе Реакционная способность и применение)
Третий метод приготовления литийорганических реагентов — литий-галогеновый обмен.
трет- бутиллитий или н- бутиллитий являются наиболее часто используемыми реагентами для получения новых литийорганических соединений посредством обмена литий-галоген. Обмен литий-галоген в основном используется для преобразования арильных и алкенильных иодидов и бромидов с sp2- углеродами в соответствующие литийорганические соединения. Реакция протекает чрезвычайно быстро и часто протекает при температуре от −60 до −120 °C. [48]
Четвертый метод получения литийорганических реагентов — через трансметаллирование. Этот метод может быть использован для получения виниллития.
В реакции Шапиро два эквивалента сильного основания алкиллития реагируют с соединениями п-тозилгидразона с образованием виниллития или, при охлаждении, олефинового продукта.
Литийорганические соединения являются высокореакционноспособными видами и требуют специальных методов обращения. Они часто едкие, огнеопасные и иногда пирофорные (самопроизвольное возгорание при воздействии воздуха или влаги). [64] Алкиллитиевые реагенты также могут подвергаться термическому разложению с образованием соответствующих алкильных видов и гидрида лития. [65] Литийорганические реагенты обычно хранятся при температуре ниже 10 °C. Реакции проводятся с использованием безвоздушных методов . [64] Концентрация алкиллитиевых реагентов часто определяется титрованием . [ 66] [67] [68]
Литийорганические реагенты реагируют, часто медленно, с эфирами, которые, тем не менее, часто используются в качестве растворителей. [69]