
Ковалентная связь — это химическая связь , которая предполагает обмен электронами с образованием электронных пар между атомами . Эти электронные пары известны как общие пары или связывающие пары . Стабильный баланс сил притяжения и отталкивания между атомами, когда они имеют общие электроны , известен как ковалентная связь. [1] Для многих молекул совместное использование электронов позволяет каждому атому достичь эквивалента полной валентной оболочки, соответствующей стабильной электронной конфигурации. В органической химии ковалентная связь встречается гораздо чаще, чем ионная .
Ковалентная связь также включает в себя множество видов взаимодействий, в том числе σ-связь , π-связь , связь металл-металл , агостические взаимодействия , изогнутые связи , трехцентровые двухэлектронные связи и трехцентровые четырехэлектронные связи . [2] [3] Термин «ковалентная связь» появился в 1939 году. [4] Приставка «ко-» означает «совместно», «связанный в действии», «партнерский в меньшей степени» и т. д.; таким образом, «ковалентная связь», по сути, означает, что атомы имеют общую « валентность », как это обсуждается в теории валентной связи .
В молекуле H
2Атомы водорода разделяют два электрона посредством ковалентной связи. [5] Ковалентность наибольшая между атомами одинаковой электроотрицательности . Таким образом, ковалентная связь не обязательно требует, чтобы два атома состояли из одних и тех же элементов, а только чтобы они имели сравнимую электроотрицательность. Ковалентная связь, которая влечет за собой совместное использование электронов более чем двумя атомами, называется делокализованной .
Термин ковалентность в отношении связи был впервые использован в 1919 году Ирвингом Ленгмюром в статье журнала Американского химического общества, озаглавленной «Расположение электронов в атомах и молекулах». Ленгмюр писал, что «термином ковалентности мы будем обозначать число пар электронов, которыми данный атом делится со своими соседями». [6]
Идея ковалентной связи возникла за несколько лет до 1919 года у Гилберта Н. Льюиса , который в 1916 году описал совместное использование электронных пар между атомами [7] (а в 1926 году он также ввёл термин « фотон » для обозначения наименьшей единицы лучистой энергии). энергия). Он ввел обозначение Льюиса , или обозначение электронных точек , или структуру точек Льюиса , в которой валентные электроны (те, что находятся во внешней оболочке) представлены в виде точек вокруг атомных символов. Пары электронов, расположенные между атомами, представляют собой ковалентные связи. Множественные пары представляют собой множественные связи, такие как двойные и тройные связи . В альтернативной форме изображения, не показанной здесь, пары электронов, образующих связи, представлены сплошными линиями. [8]
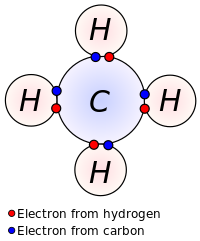
Льюис предположил, что атом образует достаточно ковалентных связей, чтобы сформировать полную (или закрытую) внешнюю электронную оболочку. На диаграмме метана, показанной здесь, атом углерода имеет валентность четыре и, следовательно, окружен восемью электронами ( правило октета ), четырьмя от самого углерода и четырьмя от связанных с ним атомов водорода. Каждый водород имеет валентность, равную единице, и окружен двумя электронами (правило дуэта) – один электрон плюс один углерод. Числа электронов соответствуют полным оболочкам в квантовой теории атома; внешняя оболочка атома углерода — это оболочка с n = 2, которая может содержать восемь электронов, тогда как внешняя (и единственная) оболочка атома водорода — это оболочка с n = 1, которая может содержать только два. [9]
Хотя идея общих электронных пар дает эффективную качественную картину ковалентной связи, квантовая механика необходима, чтобы понять природу этих связей и предсказать структуры и свойства простых молекул. Уолтеру Хейтлеру и Фрицу Лондону приписывают первое успешное квантовомеханическое объяснение химической связи ( молекулярного водорода ) в 1927 году. [10] Их работа была основана на модели валентной связи, которая предполагает, что химическая связь образуется, когда есть хорошая перекрытие атомных орбиталей участвующих атомов.
Атомные орбитали (за исключением s-орбиталей) обладают специфическими направленными свойствами, приводящими к образованию различных типов ковалентных связей. Сигма-связи (σ) являются самыми прочными ковалентными связями и возникают из-за лобового перекрытия орбиталей двух разных атомов. Одинарная связь обычно представляет собой σ-связь. Связи Pi (π) более слабые и возникают из-за латерального перекрытия между p (или d) орбиталями. Двойная связь между двумя данными атомами состоит из одной σ и одной π-связи, а тройная связь — из одной σ и двух π-связей. [8]
На ковалентные связи также влияет электроотрицательность связанных атомов, которая определяет химическую полярность связи. Два атома с одинаковой электроотрицательностью образуют неполярные ковалентные связи, такие как H–H. Неравные отношения создают полярную ковалентную связь, например, с H-Cl. Однако полярность также требует геометрической асимметрии , иначе диполи могут нейтрализоваться, что приведет к неполярной молекуле. [8]
Существует несколько типов структур ковалентных веществ, включая отдельные молекулы, молекулярные структуры , макромолекулярные структуры и гигантские ковалентные структуры. Отдельные молекулы имеют прочные связи, которые удерживают атомы вместе, но, как правило, силы притяжения между молекулами незначительны. Такими ковалентными веществами обычно являются газы, например, HCl , SO 2 , CO 2 и CH 4 . В молекулярных структурах действуют слабые силы притяжения. К таким ковалентным веществам относятся жидкости с низкой температурой кипения (например, этанол ) и твердые вещества с низкой температурой плавления (например, йод и твердый CO 2 ). Макромолекулярные структуры имеют большое количество атомов, связанных ковалентными связями в цепях, включая синтетические полимеры, такие как полиэтилен и нейлон , и биополимеры, такие как белки и крахмал . Сетевые ковалентные структуры (или гигантские ковалентные структуры) содержат большое количество атомов, связанных в листы (например, графит ) или трехмерные структуры (например, алмаз и кварц ). Эти вещества имеют высокие температуры плавления и кипения, часто хрупкие и имеют тенденцию иметь высокое электрическое сопротивление . Элементы, обладающие высокой электроотрицательностью и способностью образовывать связи из трех или четырех электронных пар, часто образуют такие крупные макромолекулярные структуры. [11]

Связи с одним или тремя электронами можно найти в радикалах , которые имеют нечетное число электронов. Самый простой пример одноэлектронной связи находится в катионе диводорода H.+
2. Одноэлектронные связи часто имеют примерно половину энергии связи, чем двухэлектронная связь, и поэтому называются «полусвязями». Однако есть исключения: в случае дилития связь фактически прочнее у 1-электронного Li+
2чем для 2-электронного Li 2 . Это исключение можно объяснить с точки зрения гибридизации и эффектов внутренней оболочки. [12]
Самый простой пример трехэлектронной связи можно найти в катионе димера гелия He .+
2. Она считается «полусвязью», поскольку состоит только из одного общего электрона (а не из двух); [13] в терминах молекулярных орбиталей третий электрон находится на разрыхляющей орбитали, которая нейтрализует половину связи, образованной двумя другими электронами. Другим примером молекулы, содержащей 3-электронную связь, помимо двух 2-электронных связей, является оксид азота NO. Молекулу кислорода O 2 также можно рассматривать как имеющую две 3-электронные связи и одну 2-электронную связь, что объясняет ее парамагнетизм и формальный порядок связи 2. [14] Диоксид хлора и его более тяжелые аналоги, диоксид брома и йод. диоксид также содержит трехэлектронные связи.
Молекулы с нечетными электронными связями обычно обладают высокой реакционной способностью. Эти типы связи стабильны только между атомами с одинаковой электроотрицательностью. [14]
Бывают ситуации, когда одной структуры Льюиса недостаточно для объяснения электронной конфигурации в молекуле и ее экспериментально определенных свойств, поэтому необходима суперпозиция структур. Одни и те же два атома в таких молекулах могут быть связаны по-разному в разных структурах Льюиса (одинарная связь в одной, двойная связь в другой или даже вообще не быть связанной), что приводит к нецелому порядку связи . Нитрат - ион является одним из таких примеров с тремя эквивалентными структурами. Связь между азотом и каждым кислородом представляет собой двойную связь в одной структуре и одинарную связь в двух других, так что средний порядок связи для каждого взаимодействия NO–O равен2 + 1 + 1/3"="4/3. [8]
В органической химии , когда молекула с плоским кольцом подчиняется правилу Хюккеля , где число π-электронов соответствует формуле 4 n + 2 (где n — целое число), она приобретает дополнительную стабильность и симметрию. В бензоле , прототипе ароматического соединения, имеется 6 π-связывающих электронов ( n = 1, 4 n + 2 = 6). Они занимают три делокализованные π-молекулярные орбитали ( теория молекулярных орбиталей ) или образуют сопряженные π-связи в двух резонансных структурах, которые линейно объединяются ( теория валентных связей ), создавая правильный шестиугольник , демонстрирующий большую стабилизацию, чем гипотетический 1,3,5-циклогексатриен. [9]
В случае гетероциклических ароматических соединений и замещенных бензолов различия в электроотрицательности между различными частями кольца могут доминировать в химическом поведении связей ароматического кольца, которые в остальном эквивалентны. [9]
Некоторые молекулы, такие как дифторид ксенона и гексафторид серы, имеют более высокие координационные числа, чем это было бы возможно из-за строго ковалентной связи в соответствии с правилом октетов . Это объясняется моделью трехцентровой четырехэлектронной связи («3c – 4e»), которая интерпретирует волновую функцию молекулы с точки зрения несвязывающих высших занятых молекулярных орбиталей в теории молекулярных орбиталей и резонанса сигма-связей в теории валентных связей . [15]
В трехцентровых двухэлектронных связях («3c–2e») три атома разделяют два электрона при связи. Этот тип связи встречается в гидридах бора , таких как диборан (B 2 H 6 ), которые часто описываются как электронодефицитные, поскольку в них недостаточно валентных электронов для образования локализованных (2-центровых 2-электронных) связей, соединяющих все атомы. Однако более современное описание с использованием связей 3c–2e действительно обеспечивает достаточное количество связывающих орбиталей для соединения всех атомов, так что вместо этого молекулы можно классифицировать как электронно-точные.
Каждая такая связь (2 на молекулу в диборане) содержит пару электронов, которые соединяют атомы бора друг с другом в форме банана , с протоном (ядро атома водорода) в середине связи, разделяющим электроны с обоими. атомы бора. В некоторых кластерных соединениях постулируются также так называемые четырехцентровые двухэлектронные связи . [16]
После развития квантовой механики для квантового описания химической связи были предложены две основные теории: теория валентной связи (ВС) и теория молекулярных орбиталей (МО) . Более позднее квантовое описание [17] дано в терминах атомных вкладов в электронную плотность состояний.
Эти две теории представляют два способа создания электронной конфигурации молекулы. [18] В теории валентных связей атомные гибридные орбитали сначала заполняются электронами, чтобы создать полностью связанную валентную конфигурацию, а затем выполняется линейная комбинация вносящих вклад структур ( резонанс ), если их несколько. Напротив, в теории молекулярных орбиталей сначала выполняется линейная комбинация атомных орбиталей , а затем заполнение полученных молекулярных орбиталей электронами. [8]
Эти два подхода считаются взаимодополняющими, и каждый из них дает свое собственное понимание проблемы химической связи. Поскольку теория валентных связей строит молекулярную волновую функцию из локализованных связей, она больше подходит для расчета энергий связей и понимания механизмов реакций . Поскольку теория молекулярных орбиталей строит молекулярную волновую функцию из делокализованных орбиталей, она больше подходит для расчета энергий ионизации и понимания спектральных полос поглощения . [19]
На качественном уровне обе теории содержат неверные предсказания. Простая теория валентных связей (Гейтлера-Лондона) правильно предсказывает диссоциацию гомоядерных двухатомных молекул на отдельные атомы, тогда как простая теория молекулярных орбиталей (Хартри-Фока) неправильно предсказывает диссоциацию на смесь атомов и ионов. С другой стороны, простая теория молекулярных орбиталей правильно предсказывает правило ароматичности Хюккеля , в то время как простая теория валентных связей неправильно предсказывает, что циклобутадиен имеет большую резонансную энергию, чем бензол. [20]
Хотя волновые функции, генерируемые обеими теориями, на качественном уровне не согласуются и не соответствуют энергии стабилизации экспериментально, их можно скорректировать конфигурационным взаимодействием . [18] Это делается путем объединения ковалентной функции валентной связи с функциями, описывающими все возможные ионные структуры, или путем объединения функции основного состояния молекулярной орбитали с функциями, описывающими все возможные возбужденные состояния с использованием незанятых орбиталей. Тогда можно увидеть, что подход с использованием простых молекулярных орбиталей переоценивает вес ионных структур, в то время как подход с использованием простых валентных связей ими пренебрегает. Это также можно охарактеризовать как утверждение, что подход с использованием простых молекулярных орбиталей пренебрегает электронной корреляцией , в то время как подход с использованием простых валентных связей переоценивает ее. [18]
Современные расчеты в квантовой химии обычно начинаются (но в конечном итоге выходят далеко за рамки) с подхода молекулярной орбитали, а не с подхода валентных связей, не из-за какого-либо внутреннего превосходства первого, а скорее потому, что подход МО легче адаптировать к численным расчетам. Молекулярные орбитали ортогональны, что значительно увеличивает возможности и скорость компьютерных расчетов по сравнению с неортогональными орбиталями валентных связей.
В COOP, [21] COHP [22] и BCOOP, [23] оценка ковалентности связи зависит от базисного набора. Чтобы решить эту проблему, можно предложить альтернативную формулировку ковалентности связи.
Центральная масса атомной орбитали с квантовыми числами для атома A определяется как
где – вклад атомной орбитали атома А в полную электронную плотность состояний твердого тела
где внешняя сумма пробегает все атомы A элементарной ячейки. Энергетическое окно выбрано таким образом, чтобы оно охватывало все соответствующие полосы, участвующие в связи. Если диапазон выбора неясен, его можно определить на практике, исследуя молекулярные орбитали, описывающие электронную плотность вместе с рассматриваемой связью.
Относительное положение центра массы уровней атома A относительно центра массы уровней атома B определяется как
где вклады магнитного и спинового квантовых чисел суммируются. Согласно этому определению, относительное положение уровней A относительно уровней B равно
где для простоты можно опустить зависимость от главного квантового числа в обозначениях, относящихся к
В этом формализме, чем больше значение, тем выше перекрытие выбранных атомных полос, и, таким образом, электронная плотность, описываемая этими орбиталями, дает более ковалентную связь A-B . Величина обозначается как ковалентность связи A-B , которая указывается в тех же единицах энергии .
Считается, что эффект, аналогичный ковалентной связи, возникает в некоторых ядерных системах с той разницей, что общими фермионами являются кварки , а не электроны. [24] Сечение рассеяния протон -протон высокой энергии указывает на то, что обмен кварков либо u-, либо d-кварками является доминирующим процессом ядерного взаимодействия на коротких расстояниях. В частности, оно доминирует над взаимодействием Юкавы , при котором происходит обмен мезона . [25] Таким образом, ожидается, что ковалентное связывание путем обмена кварками будет доминирующим механизмом ядерного связывания на малых расстояниях, когда связанные адроны имеют общие ковалентные кварки. [26]