
Кокколитофориды , или кокколитофориды , являются одноклеточными организмами , которые являются частью фитопланктона , автотрофного (самостоятельно питающегося) компонента планктонного сообщества. Они образуют группу из примерно 200 видов и принадлежат либо к царству Protista , согласно пятицарственной системе Роберта Уиттекера , либо к кладе Hacrobia , согласно более новой биологической системе классификации. В пределах Hacrobia кокколитофориды находятся в типе или отделе Haptophyta , классе Prymnesiophyceae (или Coccolithophyceae ). Кокколитофориды почти исключительно морские , фотосинтезирующие и миксотрофные , и существуют в больших количествах по всей солнечной зоне океана .
Кокколитофориды являются наиболее продуктивными кальцифицирующими организмами на планете, покрываясь оболочкой из карбоната кальция , называемой кокосферой . Однако причины, по которым они кальцифицируются, остаются неясными. Одной из ключевых функций кокосферы может быть то, что она обеспечивает защиту от хищничества микрозоопланктона , которое является одной из основных причин гибели фитопланктона в океане. [1]
Кокколитофориды важны с экологической точки зрения, а с биогеохимической точки зрения они играют важную роль в морском биологическом насосе и углеродном цикле . [2] [1] В зависимости от среды обитания они могут производить до 40 процентов местной морской первичной продукции . [3] Они представляют особый интерес для тех, кто изучает глобальное изменение климата , поскольку по мере повышения кислотности океана их кокколиты могут стать еще более важными в качестве поглотителя углерода . [4] Стратегии управления применяются для предотвращения цветения кокколитофорид, связанного с эвтрофикацией , поскольку это цветение приводит к уменьшению потока питательных веществ на нижние уровни океана. [5]
Самый распространенный вид кокколитофорид, Emiliania huxleyi , принадлежит к порядку Isochrysidales и семейству Noëlaerhabdaceae . [6] Он встречается в умеренных , субтропических и тропических океанах. [7] Это делает E. huxleyi важной частью планктонной базы большой доли морских пищевых цепей . Это также самый быстрорастущий кокколитофорид в лабораторных культурах. [8] Он изучается на предмет обширного цветения, которое он образует в водах с дефицитом питательных веществ после реформирования летнего термоклина . [9] [10] и на предмет производства им молекул, известных как алкеноны , которые обычно используются учеными-геологами в качестве средства для оценки прошлых температур морской поверхности . [11]
Кокколитофориды (или кокколитофориды, от прилагательного [12] ) образуют группу из примерно 200 видов фитопланктона. [13] Они принадлежат либо к царству Protista , согласно классификации пяти царств Роберта Уиттекера , либо к кладе Hacrobia , согласно более новой системе биологической классификации. Внутри Hacrobia кокколитофориды находятся в типе или отделе Haptophyta , классе Prymnesiophyceae (или Coccolithophyceae ). [6] Кокколитофориды отличаются особыми пластинками (или чешуйками) карбоната кальция неопределенной функции, называемыми кокколитами , которые также являются важными микроископаемыми . Однако существуют виды Prymnesiophyceae, у которых нет кокколитов (например, в роде Prymnesium ), поэтому не каждый член Prymnesiophyceae является кокколитофоридой. [14]
Кокколитофориды — это одноклеточный фитопланктон , который производит небольшие чешуйки карбоната кальция (CaCO 3 ) ( кокколиты ), которые покрывают поверхность клетки в виде сферического покрытия, называемого коккосферой . Многие виды также являются миксотрофами и способны как фотосинтезировать, так и поглощать добычу. [15]
Кокколитофориды были неотъемлемой частью морских планктонных сообществ с юрского периода . [16] [17] Сегодня кокколитофориды вносят ~1–10% в неорганическую фиксацию углерода (кальцификацию) от общей фиксации углерода (кальцификация плюс фотосинтез) на поверхности океана [18] и ~50% в пелагические отложения CaCO 3. [19] Их известковый панцирь увеличивает скорость погружения фотосинтетически фиксированного CO 2 в глубины океана за счет балластировки органического вещества. [20] [21] В то же время биогенное осаждение карбоната кальция во время образования кокколитов снижает общую щелочность морской воды и высвобождает CO 2 . [22] [23] Таким образом, кокколитофориды играют важную роль в морском углеродном цикле , влияя на эффективность биологического углеродного насоса и поглощение океаном атмосферного CO 2 . [1]
По состоянию на 2021 год неизвестно, почему кокколитофориды кальцифицируются и как их способность производить кокколиты связана с их экологическим успехом. [24] [25] [26] [27] [28] Наиболее вероятным преимуществом наличия коккосферы, по-видимому, является защита от хищников или вирусов. [29] [27] Вирусная инфекция является важной причиной гибели фитопланктона в океанах, [30] и недавно было показано, что кальцификация может влиять на взаимодействие между кокколитофоридами и их вирусами. [31] [32] Основными хищниками морского фитопланктона являются микрозоопланктон , такой как инфузории и динофлагелляты . По оценкам, они потребляют около двух третей первичной продукции в океане [33] , и микрозоопланктон может оказывать сильное давление на популяции кокколитофорид. [34] Хотя кальцификация не предотвращает хищничество, утверждается, что коккосфера снижает эффективность выедания, затрудняя хищнику использование органического содержимого кокколитофорид. [35] Гетеротрофные простейшие способны избирательно выбирать добычу на основе ее размера или формы, а также посредством химических сигналов [36] [37] и, таким образом, могут отдавать предпочтение другой добыче, которая доступна и не защищена кокколитами. [1]

Кокколитофориды — это сферические клетки размером около 5–100 микрометров в поперечнике, окруженные известковыми пластинами, называемыми кокколитами , которые имеют размер около 2–25 микрометров в поперечнике. Каждая клетка содержит два коричневых хлоропласта , которые окружают ядро . [40]
В каждой коккосфере заключена одна клетка с мембраносвязанными органеллами . Два больших хлоропласта с коричневым пигментом расположены по обе стороны клетки и окружают ядро , митохондрии , аппарат Гольджи , эндоплазматический ретикулум и другие органеллы. Каждая клетка также имеет две жгутиковые структуры, которые участвуют не только в подвижности, но и в митозе и формировании цитоскелета . [ 41] У некоторых видов также присутствует функциональная или рудиментарная гаптонема . [42] Эта структура, которая является уникальной для гаптофитов , скручивается и раскручивается в ответ на стимулы окружающей среды. Хотя она плохо изучена, было высказано предположение, что она участвует в захвате добычи. [41]
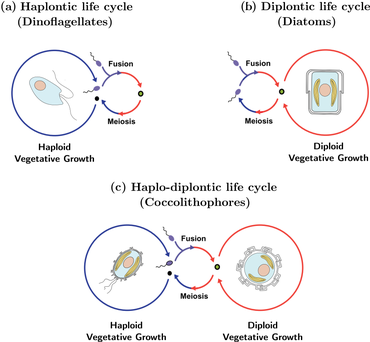
Сложный жизненный цикл кокколитофорид известен как гаплодиплонтический жизненный цикл и характеризуется чередованием как бесполой, так и половой фаз. Бесполая фаза известна как гаплоидная фаза, в то время как половая фаза известна как диплоидная фаза. Во время гаплоидной фазы кокколитофориды производят гаплоидные клетки через митоз . Эти гаплоидные клетки затем могут делиться дальше через митоз или подвергаться половому размножению с другими гаплоидными клетками. Полученная диплоидная клетка проходит через мейоз , чтобы снова произвести гаплоидные клетки, начиная цикл заново. У кокколитофорид бесполое размножение путем митоза возможно в обеих фазах жизненного цикла, что контрастирует с большинством других организмов, которые имеют чередующиеся жизненные циклы. [43] Как абиотические , так и биотические факторы могут влиять на частоту, с которой происходит каждая фаза. [44]
Кокколитофориды размножаются бесполым путем посредством бинарного деления. В этом процессе кокколиты из родительской клетки делятся между двумя дочерними клетками. Были высказаны предположения о возможном наличии процесса полового размножения из-за диплоидных стадий кокколитофорид, но этот процесс никогда не наблюдался. [45]
Стратегии кокколитофорид, выбранные по К или r, зависят от стадии их жизненного цикла. Когда кокколитофориды диплоидны, они r-отбираются. На этом этапе они переносят более широкий спектр питательных составов. Когда они гаплоидны, они K-отбираются и часто более конкурентоспособны в стабильных средах с низким содержанием питательных веществ. [45] Большинство кокколитофорид являются стратегами K и обычно встречаются на поверхностных водах с низким содержанием питательных веществ. Они являются плохими конкурентами по сравнению с другим фитопланктоном и процветают в местах обитания, где другой фитопланктон не выжил бы. [46] Эти две стадии жизненного цикла кокколитофорид происходят сезонно, когда больше питания доступно в более теплые сезоны и меньше в более прохладные сезоны. Этот тип жизненного цикла известен как сложный гетероморфный жизненный цикл. [45]

Кокколитофориды встречаются по всему мировому океану. Их распределение варьируется по вертикали в зависимости от стратифицированных слоев в океане и географически в зависимости от различных временных зон. [47] В то время как большинство современных кокколитофорид можно обнаружить в связанных с ними стратифицированных олиготрофных условиях, наиболее обильные области кокколитофорид, где наблюдается наибольшее видовое разнообразие, находятся в субтропических зонах с умеренным климатом. [48] В то время как температура воды и интенсивность света, попадающего на поверхность воды, являются более влиятельными факторами в определении местонахождения видов, океанские течения также могут определять местонахождение определенных видов кокколитофорид. [49]
Хотя подвижность и образование колоний различаются в зависимости от жизненного цикла различных видов кокколитофорид, часто наблюдается чередование подвижной гаплоидной фазы и неподвижной диплоидной фазы. В обеих фазах распространение организма в значительной степени обусловлено океаническими течениями и моделями циркуляции. [50]
В Тихом океане было идентифицировано около 90 видов с шестью отдельными зонами, связанными с различными тихоокеанскими течениями, которые содержат уникальные группировки различных видов кокколитофорид. [51] Наибольшее разнообразие кокколитофорид в Тихом океане было в районе океана, который считается Центральной Северной зоной, которая представляет собой область между 30 o и 5 o с.ш., состоящую из Северного Экваториального течения и Экваториального противотечения. Эти два течения движутся в противоположных направлениях, на восток и запад, что обеспечивает сильное смешивание вод и позволяет большому разнообразию видов заселять эту область. [51]
В Атлантическом океане наиболее распространенными видами являются E. huxleyi и Florisphaera profunda с меньшими концентрациями видов Umbellosphaera irregularis , Umbellosphaera tenuis и различных видов Gephyrocapsa . [51] Глубоководные виды кокколитофорид в значительной степени зависят от глубины нутриклина и термоклина . Эти кокколитофориды увеличиваются в численности, когда нутриклин и термоклин глубокие, и уменьшаются, когда они мелкие. [52]

Полное распределение кокколитофорид в настоящее время неизвестно, и некоторые регионы, такие как Индийский океан, не так хорошо изучены, как другие места в Тихом и Атлантическом океанах. Также очень трудно объяснить распределение из-за множества постоянно меняющихся факторов, связанных со свойствами океана, такими как прибрежный и экваториальный апвеллинг , фронтальные системы, бентосная среда, уникальная топография океана и очаги изолированных высоких или низких температур воды. [54]
Верхняя фотическая зона имеет низкую концентрацию питательных веществ, высокую интенсивность света и проникновение, и обычно более высокую температуру. Нижняя фотическая зона имеет высокую концентрацию питательных веществ, низкую интенсивность света и проникновение и относительно прохладную. Средняя фотическая зона — это область, которая содержит те же значения между значениями нижней и верхней фотических зон. [48]
Большой кальцитовый пояс Южного океана — это регион повышенной летней концентрации кальцита в верхнем слое океана, полученного из кокколитофорид, несмотря на то, что регион известен своим преобладанием диатомовых водорослей . Наложение двух основных групп фитопланктона, кокколитофорид и диатомовых водорослей, в динамических фронтальных системах, характерных для этого региона, обеспечивает идеальные условия для изучения влияния окружающей среды на распределение различных видов в пределах этих таксономических групп. [57]
Большой кальцитовый пояс, определяемый как повышенный уровень неорганического углерода (PIC), возникающий наряду с сезонно повышенным уровнем хлорофилла a весной и летом в Южном океане, [58] играет важную роль в колебаниях климата, [59] [60] составляя более 60% площади Южного океана (30–60° ю.ш.). [61] Регион между 30° и 50° ю.ш. имеет самое высокое поглощение антропогенного диоксида углерода (CO2 ) наряду с северной частью Атлантического и северной частью Тихого океанов. [62]
Недавние исследования показывают, что изменение климата оказывает прямое и косвенное влияние на распределение и продуктивность кокколитофорид. Они неизбежно пострадают от повышения температуры и термической стратификации верхнего слоя океана, поскольку они являются основными регуляторами их экологии, хотя неясно, приведет ли глобальное потепление к чистому увеличению или уменьшению кокколитофорид. Поскольку они являются кальцифицирующими организмами, было высказано предположение, что закисление океана из-за увеличения углекислого газа может серьезно повлиять на кокколитофорид. [52] Недавнее повышение уровня CO2 привело к резкому увеличению популяции кокколитофорид. [63]


Кокколитофориды являются одними из наиболее распространенных первичных производителей в океане. Как таковые, они вносят большой вклад в первичную продуктивность тропических и субтропических океанов, однако, сколько именно, еще предстоит зафиксировать. [67]
Соотношение между концентрациями азота , фосфора и силиката в определенных областях океана диктует конкурентное доминирование в сообществах фитопланктона. Каждое соотношение по существу склоняет шансы в пользу либо диатомовых водорослей , либо других групп фитопланктона, таких как кокколитофориды. Низкое соотношение силикатов к азоту и фосфору позволяет кокколитофоридам вытеснять другие виды фитопланктона; однако, когда соотношение силикатов к фосфору к азоту высокое, кокколитофориды вытесняются диатомовыми водорослями. Увеличение сельскохозяйственных процессов приводит к эвтрофикации вод и, таким образом, кокколитофориды цветут в этих средах с высоким содержанием азота и фосфора и низким содержанием силикатов. [5]
Кальцит в карбонате кальция позволяет кокколитам рассеивать больше света, чем они поглощают. Это имеет два важных последствия: 1) поверхностные воды становятся ярче, что означает, что они имеют более высокое альбедо , и 2) происходит индуцированное фотоингибирование , что означает, что фотосинтетическое производство уменьшается из-за избытка света. В случае 1) высокая концентрация кокколитов приводит к одновременному повышению температуры поверхностных вод и снижению температуры более глубоких вод. Это приводит к большей стратификации в водной толще и уменьшению вертикального перемешивания питательных веществ. Однако исследование 2012 года показало, что общее влияние кокколитофорид на увеличение радиационного воздействия океана меньше, чем от антропогенных факторов. [68] Таким образом, общим результатом большого цветения кокколитофорид является снижение продуктивности водной толщи, а не вклад в глобальное потепление.
Их хищники включают обычных хищников всего фитопланктона, включая мелкую рыбу, зоопланктон и личинки моллюсков. [46] [69] Вирусы, специфичные для этого вида, были выделены из нескольких мест по всему миру и, по-видимому, играют важную роль в динамике весеннего цветения.
Никаких экологических доказательств токсичности кокколитофорид не сообщалось, но они принадлежат к классу Prymnesiophyceae, который содержит отряды с токсичными видами. Токсичные виды были обнаружены в родах Prymnesium Massart и Chrysochromulina Lackey. Было обнаружено, что представители рода Prymnesium производят гемолитические соединения, агент, ответственный за токсичность. Некоторые из этих токсичных видов ответственны за массовую гибель рыбы и могут накапливаться в таких организмах, как моллюски; передавая его по пищевой цепи. В лабораторных испытаниях на токсичность представители океанических родов кокколитофорид Emiliania, Gephyrocapsa, Calcidiscus и Coccolithus оказались нетоксичными, как и виды прибрежного рода Hymenomonas , однако несколько видов Pleurochrysis и Jomonlithus , оба прибрежных рода были токсичны для артемии . [69]
Кокколитофориды в основном встречаются в виде отдельных свободно плавающих гаплоидных или диплоидных клеток. [47]
Большинству фитопланктона для выживания нужны солнечный свет и питательные вещества из океана, поэтому они процветают в районах с большим количеством богатой питательными веществами воды, поднимающейся с нижних уровней океана. Большинству кокколитофорид солнечный свет нужен только для производства энергии, и у них более высокое соотношение поглощения нитрата по сравнению с поглощением аммония (азот необходим для роста и может быть использован непосредственно из нитрата, но не аммония). Из-за этого они процветают в неподвижных, бедных питательными веществами средах, где другой фитопланктон голодает. [70] Компромиссы, связанные с этими более быстрыми темпами роста, включают меньший радиус клетки и меньший объем клетки, чем у других типов фитопланктона.
Известно , что гигантские ДНК-содержащие вирусы литически инфицируют кокколитофориды, в частности E. huxleyi . Эти вирусы, известные как вирусы E. huxleyi (EhV), по-видимому, инфицируют диплоидную фазу жизненного цикла, покрытую коккосферой. Было высказано предположение, что, поскольку гаплоидный организм не инфицирован и, следовательно, не затронут вирусом, коэволюционная « гонка вооружений » между кокколитофоридами и этими вирусами не следует классической эволюционной схеме Красной Королевы , а вместо этого следует экологической динамике «Чеширского кота». [71] Более поздние работы показали, что вирусный синтез сфинголипидов и индукция запрограммированной гибели клеток обеспечивает более прямую связь для изучения коэволюционной гонки вооружений , подобной Красной Королеве, по крайней мере между кокколитовирусами и диплоидным организмом. [44]
Кокколитофориды являются членами клады Haptophyta , которая является сестринской кладой Centrohelida , которые оба относятся к Haptista . [72] Самые древние известные кокколитофориды известны из позднего триаса, около границы норийского и ретийского ярусов . [73] Разнообразие неуклонно увеличивалось в течение мезозоя, достигнув своего пика в позднем мелу . Однако во время мел -палеогенового вымирания произошел резкий спад , когда вымерло более 90% видов кокколитофорид. Кокколиты достигли другой, более низкой вершины разнообразия во время палеоцен-эоценового термического максимума , но впоследствии сократились с олигоцена из-за снижения глобальных температур, при этом виды, которые производили крупные и сильно кальцинированные кокколиты, пострадали больше всего. [27]
Каждая кокколитофорида заключает себя в защитную оболочку из кокколитов , кальцинированных чешуек, которые составляют ее экзоскелет или коккосферу . [74] Кокколиты создаются внутри клетки кокколитофориды, и в то время как некоторые виды сохраняют один слой на протяжении всей жизни, производя новые кокколиты только по мере роста клетки, другие постоянно производят и сбрасывают кокколиты.
Основной компонент кокколитов — карбонат кальция, или мел . Карбонат кальция прозрачен, поэтому фотосинтетическая активность организмов не нарушается из-за инкапсуляции в коккосферу. [46]
Кокколиты производятся в процессе биоминерализации , известном как кокколитогенез. [40] Как правило, кальцификация кокколитов происходит в присутствии света, и эти чешуйки производятся гораздо больше во время экспоненциальной фазы роста, чем в стационарной фазе. [75] Хотя это еще не полностью изучено, процесс биоминерализации строго регулируется кальциевой сигнализацией . Образование кальцита начинается в комплексе Гольджи , где белковые матрицы зарождают образование кристаллов CaCO3 , а сложные кислые полисахариды контролируют форму и рост этих кристаллов. [50] По мере производства каждой чешуйки она экспортируется в пузырьке , полученном из аппарата Гольджи , и добавляется к внутренней поверхности коккосферы. Это означает, что самые последние произведенные кокколиты могут лежать под более старыми кокколитами. [43] В зависимости от стадии жизненного цикла фитопланктона могут образовываться два разных типа кокколитов. Голококколиты производятся только в гаплоидной фазе, лишены радиальной симметрии и состоят из сотен или тысяч подобных мелких (около 0,1 мкм) ромбических кристаллов кальцита . Считается, что эти кристаллы образуются, по крайней мере, частично вне клетки. Гетерококколиты встречаются только в диплоидной фазе, имеют радиальную симметрию и состоят из относительно небольшого количества сложных кристаллических единиц (менее 100). Хотя они редки, комбинированные коккосферы, которые содержат как голококколиты, так и гетерококколиты, наблюдались в планктоне, регистрирующем переходы жизненного цикла кокколитофорид. Наконец, коккосферы некоторых видов сильно модифицированы различными придатками, сделанными из специализированных кокколитов. [54]
Хотя точная функция коккосферы неясна, было предложено много потенциальных функций. Наиболее очевидно, что кокколиты могут защищать фитопланктон от хищников. Также, по-видимому, они помогают им создавать более стабильный pH . Во время фотосинтеза из воды удаляется углекислый газ, делая ее более щелочной. Также кальцификация удаляет углекислый газ, но химия, стоящая за этим, приводит к противоположной реакции pH; она делает воду более кислой. Таким образом, сочетание фотосинтеза и кальцификации уравнивает друг друга в отношении изменений pH. [76] Кроме того, эти экзоскелеты могут давать преимущество в производстве энергии, поскольку кокколитогенез, по-видимому, тесно связан с фотосинтезом. Органическое осаждение карбоната кальция из раствора бикарбоната производит свободный углекислый газ непосредственно в клеточном теле водоросли, этот дополнительный источник газа затем доступен кокколитофоре для фотосинтеза. Было высказано предположение, что они могут обеспечивать барьер, подобный клеточной стенке, для изоляции внутриклеточной химии от морской среды. [77] Более конкретные защитные свойства кокколитов могут включать защиту от осмотических изменений, химического или механического удара и коротковолнового света. [42] Также было высказано предположение, что дополнительный вес нескольких слоев кокколитов позволяет организму погружаться в более низкие, более богатые питательными веществами слои воды и наоборот, что кокколиты добавляют плавучести, не давая клетке погружаться на опасные глубины. [78] Также было высказано предположение, что придатки кокколитов выполняют несколько функций, таких как подавление выедания зоопланктоном. [54]
Кокколиты являются основным компонентом мела , горной породы позднемелового периода, которая широко обнажается на юге Англии и образует Белые скалы Дувра , а также других подобных пород во многих других частях мира. [10] В настоящее время осадочные кокколиты являются основным компонентом известковых илов , которые покрывают до 35% дна океана и местами достигают толщины в несколько километров. [50] Из-за их обилия и широкого географического распространения кокколиты, которые составляют слои этого ила и мелового осадка, образующегося при его уплотнении, служат ценными микроископаемыми .

Кальцификация , биологическое производство карбоната кальция (CaCO 3 ), является ключевым процессом в морском углеродном цикле . Кокколитофориды являются основной планктонной группой, ответственной за пелагическое производство CaCO 3 . [79] [80] Диаграмма справа показывает энергетические затраты на кальцификацию кокколитофорид:

На диаграмме слева показаны преимущества кальцификации кокколитофорид. (A) Ускоренный фотосинтез включает CCM (1) и усиленное поглощение света посредством рассеивания редких фотонов для глубоко обитающих видов (2). (B) Защита от фотоповреждения включает защиту от солнца от ультрафиолетового (УФ) света и фотосинтетически активного излучения (ФАР) (1) и рассеивание энергии в условиях высокой освещенности (2). (C) Бронированная защита включает защиту от вирусных/бактериальных инфекций (1) и поедания селективными (2) и неселективными (3) травоядными. [27]
Степень, в которой кальцификация может адаптироваться к закислению океана , в настоящее время неизвестна. Физиологические исследования клеток показали, что существенный отток H + (вытекающий из использования HCO 3 − для внутриклеточной кальцификации) становится более затратным с продолжающимся закислением океана, поскольку электрохимический градиент H + изнутри наружу уменьшается, а пассивный отток протонов затрудняется. [81] Адаптированные клетки должны будут активировать протонные каналы чаще, регулировать свой мембранный потенциал и/или снижать свой внутренний pH . [82] Снижение внутриклеточного pH серьезно повлияет на весь клеточный аппарат и потребует других процессов (например, фотосинтеза ) для совместной адаптации, чтобы поддерживать отток H + живым. [83] [84] Обязательный отток H + , связанный с кальцификацией, может, таким образом, представлять собой фундаментальное ограничение для адаптации, которое может потенциально объяснить, почему «кризис кальцификации» был возможен во время длительных (тысячи лет) событий возмущения CO2 [85] [86] , хотя эволюционная адаптация к изменяющимся условиям химии карбоната возможна в течение одного года. [85] [86] Раскрытие этих фундаментальных ограничений и пределов адаптации должно быть в центре внимания будущих исследований кокколитофорид, поскольку их знание является ключевой информацией, необходимой для понимания того, в какой степени реакция кальцификации на возмущения химии карбоната может быть компенсирована эволюцией. [87]
Функциональные группы, защищенные силикатом или целлюлозой, такие как диатомовые водоросли и динофлагелляты , не нуждаются в поддержании оттока H + , связанного с кальцификацией . Таким образом, им, вероятно, не нужно адаптироваться, чтобы поддерживать низкие затраты на производство структурных элементов. Напротив, динофлагелляты (за исключением кальцифицирующих видов; [88] с обычно неэффективными ферментами RuBisCO , фиксирующими CO2 [89], могут даже извлекать выгоду из химических изменений, поскольку фотосинтетическая фиксация углерода в качестве источника их структурных элементов в форме целлюлозы должна облегчаться за счет удобрение CO2, связанное с подкислением океана . [ 90] [91] При предположении, что любая форма оболочки/экзоскелета защищает фитопланктон от хищничества [29], неизвестковые доспехи могут быть предпочтительным решением для реализации защиты в будущем океане. [87]
Диаграмма справа представляет собой представление того, как, по-видимому, работают сравнительные энергетические усилия по строительству брони у диатомовых водорослей, динофлагеллят и кокколитофорид. Панцирь диатомовых водорослей, по-видимому, является самой недорогой броней при любых обстоятельствах, поскольку диатомовые водоросли обычно превосходят все другие группы, когда доступен силикат. Коккосфера относительно недорога при достаточном [CO 2 ], высоком [HCO 3 − ] и низком [H + ], поскольку субстрат насыщает, и протоны легко высвобождаются в морскую воду. [81] Напротив, строительство текальных элементов, которые представляют собой органические ( целлюлозные ) пластины, составляющие панцирь динофлагеллят, должно скорее благоприятствоваться при высоких концентрациях H + , поскольку они обычно совпадают с высоким [CO 2 ]. В этих условиях динофлагелляты могли бы понижать энергозатратность работы механизмов концентрации углерода, чтобы подпитывать производство органического исходного материала для своего панциря. Следовательно, сдвиг в условиях карбонатной химии в сторону высокого [CO 2 ] может способствовать их конкурентоспособности по отношению к кокколитофоридам. Однако такой гипотетический рост конкурентоспособности из-за измененных условий карбонатной химии не приведет автоматически к доминированию динофлагеллят, поскольку на видовой состав также влияет огромное количество факторов, помимо карбонатной химии . [87] [92]
В настоящее время доказательства, подтверждающие или опровергающие защитную функцию коккосферы от хищничества, ограничены. Некоторые исследователи обнаружили, что общие показатели хищничества микрозоопланктона снижались во время цветения кокколитофориды Emiliania huxleyi , [93] [94] , в то время как другие обнаружили высокие показатели выедания микрозоопланктоном естественных сообществ кокколитофорид. [95] В 2020 году исследователи обнаружили, что показатели поглощения микрозоопланктона in situ E. huxleyi существенно не отличались от показателей некальцифицирующего фитопланктона аналогичного размера. [96] В лабораторных экспериментах гетеротрофный динофлагеллят Oxyrrhis marina предпочитал кальцинированные клетки E. huxleyi некальцинированным , что, как предполагалось, было связано с избирательным по размеру поведением при кормлении, поскольку кальцинированные клетки крупнее некальцинированных E. huxleyi . [97] В 2015 году Харви и др. исследовали хищничество динофлагеллята O. marina на различных генотипах некальцифицирующих E. huxleyi , а также на кальцифицированных штаммах, которые различались по степени кальцификации. [98] Они обнаружили, что скорость поглощения O. marina зависела от предложенного генотипа E. huxleyi , а не от степени их кальцификации. Однако в том же исследовании авторы обнаружили, что хищники, которые охотились на некальцифицирующие генотипы, росли быстрее, чем те, кого кормили кальцифицированными клетками. [98] В 2018 году Штром и др. сравнили скорость хищничества динофлагеллята Amphidinium longum на кальцифицированной добыче по сравнению с голой добычей E. huxleyi и не нашли никаких доказательств того, что коккосфера предотвращает поглощение травоядным. [99] Вместо этого, скорость поглощения зависела от предложенного генотипа E. huxleyi. [99] В целом, эти два исследования показывают, что генотип оказывает сильное влияние на поглощение микрозоопланктонными видами, но защищает ли кальцификация кокколитофориды от хищничества микрозоопланктона и каким образом, не удалось полностью выяснить. [1]
Кокколитофориды оказывают как долгосрочное, так и краткосрочное воздействие на углеродный цикл . Производство кокколитов требует поглощения растворенного неорганического углерода и кальция. Карбонат кальция и углекислый газ производятся из кальция и бикарбоната в результате следующей химической реакции: [100]
Поскольку кокколитофориды являются фотосинтезирующими организмами, они способны использовать часть CO2, выделяемого в ходе реакции кальцификации, для фотосинтеза . [101]
Однако, производство карбоната кальция снижает щелочность поверхности, и в условиях низкой щелочности CO 2 вместо этого выбрасывается обратно в атмосферу. [102] В результате этого исследователи предположили, что большое цветение кокколитофорид может способствовать глобальному потеплению в краткосрочной перспективе. [103] Однако более широко принятая идея заключается в том, что в долгосрочной перспективе кокколитофориды способствуют общему снижению концентрации CO 2 в атмосфере . Во время кальцификации поглощаются два атома углерода, и один из них оказывается в ловушке в виде карбоната кальция. Этот карбонат кальция опускается на дно океана в форме кокколитов и становится частью осадка; таким образом, кокколитофориды обеспечивают сток для выделяемого углерода, опосредуя эффекты выбросов парниковых газов. [103]
Исследования также показывают, что закисление океана из-за увеличения концентрации CO 2 в атмосфере может повлиять на механизм кальцификации кокколитофорид. Это может не только повлиять на немедленные события, такие как увеличение популяции или производство кокколитов, но также может вызвать эволюционную адаптацию видов кокколитофорид в течение более длительных периодов времени. Например, кокколитофориды используют каналы ионов H + для постоянного откачивания ионов H + из клетки во время производства кокколитов. Это позволяет им избегать ацидоза , поскольку в противном случае производство кокколитов производило бы токсичный избыток ионов H + . Когда функция этих ионных каналов нарушается, кокколитофориды останавливают процесс кальцификации, чтобы избежать ацидоза, тем самым образуя петлю обратной связи . [104] Низкая щелочность океана ухудшает функцию ионных каналов и, следовательно, оказывает эволюционное селективное давление на кокколитофорид и делает их (и других кальцифицирующих организмов океана) уязвимыми для закисления океана. [105] В 2008 году полевые данные, указывающие на увеличение кальцификации новообразованных океанических осадков, содержащих кокколитофориды, подкрепили первые экспериментальные данные, показывающие, что увеличение концентрации CO 2 в океане приводит к увеличению кальцификации этих организмов. Уменьшение массы кокколитов связано как с увеличением концентрации CO 2 , так и с уменьшением концентрации CO2−3в мировых океанах. Предполагается, что эта более низкая кальцификация ставит кокколитофориды в экологически невыгодное положение. Однако некоторые виды, такие как Calcidiscus leptoporus , не затронуты таким образом, в то время как наиболее распространенный вид кокколитофорид, E. huxleyi, может быть затронут (результаты исследования неоднозначны). [104] [106] Кроме того, сильно кальцинированные кокколитофориды были обнаружены в условиях низкого насыщения CaCO 3 вопреки прогнозам. [4] Понимание влияния увеличения закисления океана на виды кокколитофорид абсолютно необходимо для прогнозирования будущего химического состава океана, особенно его карбонатной химии. Жизнеспособные меры по сохранению и управлению будут получены в результате будущих исследований в этой области. Такие группы, как базирующаяся в Европе CALMARO [107], отслеживают реакцию популяций кокколитофорид на изменение pH и работают над определением экологически безопасных мер контроля.
Кокколитовые окаменелости являются выдающимися и ценными известковыми микроископаемыми . Они являются крупнейшим мировым источником биогенного карбоната кальция и вносят значительный вклад в глобальный углеродный цикл . [108] Они являются основным компонентом меловых отложений, таких как белые скалы Дувра .
Особый интерес представляют окаменелости, датируемые палеоцен-эоценовым термическим максимумом 55 миллионов лет назад. Считается, что этот период наиболее точно соответствует нынешним уровням CO 2 в океане. [109] Наконец, полевые свидетельства окаменелостей кокколитофорид в породах были использованы для того, чтобы показать, что глубоководная летопись окаменелостей несет в себе смещение летописи окаменелостей , похожее на то, которое, как широко признано, влияет на наземную летопись окаменелостей . [110]
Кокколитофориды помогают регулировать температуру океанов. Они процветают в теплых морях и выделяют в воздух диметилсульфид (ДМС), ядра которого помогают производить более толстые облака, чтобы закрывать солнце. [111] Когда океаны остывают, количество кокколитофорид уменьшается, а также уменьшается количество облаков. Когда становится меньше облаков, закрывающих солнце, температура также повышается. Таким образом, это поддерживает баланс и равновесие природы. [112] [113]
{{cite journal}}: CS1 maint: date and year (link)Источники подробной информации
Введение в кокколитофориды