(2 S ,4 R )-4-Гидроксипролин , или L- гидроксипролин ( C 5 H 9 O 3 N ), представляет собой аминокислоту , сокращенно обозначаемую Hyp или O , например , в Protein Data Bank .
В 1902 году Герман Эмиль Фишер выделил гидроксипролин из гидролизованного желатина . В 1905 году Герман Лойхс синтезировал рацемическую смесь 4-гидроксипролина. [1]
Гидроксипролин отличается от пролина наличием гидроксильной (ОН) группы, присоединенной к гамма-атому углерода.
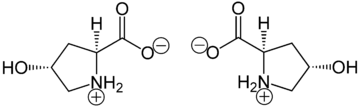
Гидроксипролин производится путем гидроксилирования аминокислоты пролина ферментом пролилгидроксилазой после синтеза белка (как посттрансляционная модификация ). Реакция, катализируемая ферментами, протекает в просвете эндоплазматической сети . Хотя он не включен напрямую в белки, гидроксипролин составляет примерно 4% всех аминокислот, обнаруженных в тканях животных, — это количество превышает семь других аминокислот, которые встраиваются трансляционно. [2]
Гидроксипролин является основным компонентом белка коллагена [ 3] , составляющего примерно 13,5% коллагена млекопитающих. Гидроксипролин и пролин играют ключевую роль в стабильности коллагена. [4] Они допускают резкое скручивание спирали коллагена. [5] В канонической триаде коллагена Xaa-Yaa-Gly (где Xaa и Yaa представляют собой любую аминокислоту) пролин, занимающий положение Yaa, гидроксилируется с образованием последовательности Xaa-Hyp-Gly. Эта модификация остатка пролина увеличивает стабильность тройной спирали коллагена . Первоначально предполагалось, что стабилизация происходит за счет того, что молекулы воды образуют сеть водородных связей, связывающую пролилгидроксильные группы и карбонильные группы основной цепи. [6] Впоследствии было показано, что увеличение стабильности происходит в первую очередь за счет стереоэлектронных эффектов и что гидратация остатков гидроксипролина практически не обеспечивает дополнительную стабильность. [7]
Гидроксипролин содержится в немногих белках, кроме коллагена. По этой причине содержание гидроксипролина использовалось в качестве индикатора для определения количества коллагена и/или желатина . Однако белки млекопитающих эластин и аргонавт 2 имеют коллагеноподобные домены, в которых образуется гидроксипролин. Некоторые яды улиток, конотоксины , содержат гидроксипролин, но не имеют коллагеноподобных последовательностей. [2]
Было показано, что гидроксилирование пролина участвует в нацеливании на субъединицу альфа -индуцируемого гипоксией фактора (HIF) ( HIF-1 альфа ) для деградации путем протеолиза . В нормоксии (нормальные кислородные условия) белок EGLN1 [1] гидроксилирует пролин в положении 564 HIF-1 альфа, что позволяет убиквитилировать супрессором опухоли фон Хиппеля-Линдау (pVHL) и последующее нацеливание на деградацию протеасом . [8]
Гликопротеины, богатые гидроксипролином (HRGP), также обнаружены в клеточных стенках растений . [9] Эти гидроксипролины служат точками прикрепления гликановых цепей , которые добавляются в результате посттрансляционных модификаций . [9]
Для гидроксилирования пролина требуется аскорбиновая кислота ( витамин С ). Наиболее очевидные и первые последствия (проблемы с деснами и волосами) отсутствия аскорбиновой кислоты у людей возникают в результате дефекта гидроксилирования остатков пролина в коллагене , что приводит к снижению стабильности молекулы коллагена, что приводит к цинге .
Повышенные уровни гидроксипролина в сыворотке и моче также наблюдались при болезни Педжета . [10]
В природе существуют и другие гидроксипролины. Наиболее заметными из них являются 2,3- цис- , 3,4- транс- и 3,4-дигидроксипролин, который встречается в клеточных стенках диатомей [11] и, как предполагается, играет роль в отложении кремнезема . Гидроксипролин также обнаружен в стенках оомицетов , грибоподобных простейших, родственных диатомовым водорослям. [12] (2S , 4S ) -цис - 4-гидроксипролин обнаружен в токсичных циклических пептидах грибов мухоморов ( например , фаллоидине ). [13]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )