

Протеасомы — это белковые комплексы , которые разрушают белки, помеченные убиквитином , путем протеолиза — химической реакции , которая разрывает пептидные связи . Ферменты , которые помогают таким реакциям, называются протеазами .
Протеасомы являются частью основного механизма, с помощью которого клетки регулируют концентрацию определенных белков и разрушают неправильно свернутые белки . Белки помечаются для разрушения небольшим белком, называемым убиквитином . Реакция мечения катализируется ферментами, называемыми убиквитинлигазами . Как только белок помечен одной молекулой убиквитина, это является сигналом для других лигаз для присоединения дополнительных молекул убиквитина. Результатом является полиубиквитиновая цепь , которая связывается протеасомой, что позволяет ей разрушать помеченный белок. [1] Процесс разрушения дает пептиды длиной около семи-восьми аминокислот , которые затем могут быть далее разрушены до более коротких аминокислотных последовательностей и использованы для синтеза новых белков. [1]
Протеасомы обнаружены внутри всех эукариот и архей , а также в некоторых бактериях . У эукариот протеасомы находятся как в ядре , так и в цитоплазме . [2]
В структуре протеасома представляет собой цилиндрический комплекс, содержащий «ядро» из четырех сложенных друг на друга колец, образующих центральную пору. Каждое кольцо состоит из семи отдельных белков. Внутренние два кольца состоят из семи β-субъединиц , которые содержат от трех до семи активных участков протеазы . Эти участки расположены на внутренней поверхности колец, так что целевой белок должен войти в центральную пору, прежде чем он будет деградирован. Внешние два кольца каждое содержат семь α-субъединиц , функция которых заключается в поддержании «ворот», через которые белки попадают в ствол. Эти α-субъединицы контролируются путем связывания со структурами «колпачка» или регуляторными частицами , которые распознают полиубиквитиновые метки, прикрепленные к белковым субстратам, и инициируют процесс деградации. Общая система убиквитинирования и протеасомной деградации известна как система убиквитин–протеасома . [3]
Путь протеасомной деградации необходим для многих клеточных процессов, включая клеточный цикл , регуляцию экспрессии генов и реакции на окислительный стресс . Важность протеолитической деградации внутри клеток и роль убиквитина в протеолитических путях были признаны при присуждении Нобелевской премии по химии 2004 года Аарону Чехановеру , Авраму Гершко и Ирвину Роузу . [4]
До открытия системы убиквитин-протеасома считалось, что деградация белка в клетках в основном осуществляется лизосомами , мембраносвязанными органеллами с кислой и заполненной протеазой внутренней частью, которые могут деградировать, а затем перерабатывать экзогенные белки и старые или поврежденные органеллы. [1] Однако работа Джозефа Этлингера и Альфреда Л. Голдберга в 1977 году по АТФ-зависимой деградации белка в ретикулоцитах , в которых отсутствуют лизосомы, предположила наличие второго механизма внутриклеточной деградации. [5] В 1978 году было показано, что он состоит из нескольких отдельных белковых цепей, что было новинкой среди протеаз в то время. [6] Более поздняя работа по модификации гистонов привела к идентификации неожиданной ковалентной модификации гистонового белка с помощью связи между боковой цепью лизина гистона и С-концевым остатком глицина убиквитина , белка, который не имел известной функции. [7] Затем было обнаружено, что ранее идентифицированный белок, связанный с протеолитической деградацией, известный как АТФ-зависимый протеолизный фактор 1 (APF-1), был тем же белком, что и убиквитин. [8] Протеолитическая активность этой системы была выделена в виде мультибелкового комплекса, первоначально названного Шервином Уилком и Мэрион Орловски мультикаталитическим протеиназным комплексом. [9] Позже был обнаружен АТФ -зависимый протеолитический комплекс, который отвечал за убиквитин-зависимую деградацию белка и был назван 26S протеасомой. [10] [11]
Большая часть ранних работ, приведших к открытию системы убиквитин-протеасомы, была выполнена в конце 1970-х и начале 1980-х годов в Технионе в лаборатории Аврама Гершко , где Аарон Чехановер работал аспирантом. Годовой отпуск Гершко в лаборатории Ирвина Роуза в онкологическом центре Фокс-Чейз дал ключевые концептуальные идеи, хотя Роуз позже преуменьшил свою роль в открытии. [12] Все трое разделили Нобелевскую премию по химии 2004 года за свою работу по открытию этой системы. [4]
Хотя данные электронной микроскопии, раскрывающие структуру протеасомы в виде стопки колец, стали доступны в середине 1980-х годов [13] , первая структура частицы ядра протеасомы не была решена с помощью рентгеновской кристаллографии до 1994 года. [14] В 2018 году первые атомные структуры голофермента человеческой протеасомы 26S в комплексе с полиубиквитинированным белковым субстратом были решены с помощью криогенной электронной микроскопии , выявив механизмы, с помощью которых субстрат распознается, деубиквитинируется, разворачивается и деградирует человеческой протеасомой 26S. [15]
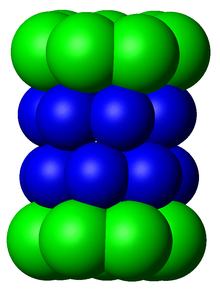
Субкомпоненты протеасомы часто называют по их коэффициенту седиментации Сведберга (обозначаемому S ). Протеасома, наиболее часто используемая у млекопитающих, — это цитозольная 26S протеасома, молекулярная масса которой составляет около 2000 килодальтон (кДа), содержащая одну субъединицу белка 20S и две субъединицы регуляторной крышки 19S. Ядро полое и обеспечивает замкнутую полость, в которой белки деградируют; отверстия на двух концах ядра позволяют целевому белку проникать внутрь. Каждый конец частицы ядра ассоциируется с регуляторной субъединицей 19S, которая содержит несколько активных участков АТФазы и участков связывания убиквитина; именно эта структура распознает полиубиквитинированные белки и переносит их в каталитическое ядро. [15] Альтернативная форма регуляторной субъединицы, называемая частицей 11S, может ассоциироваться с ядром по существу таким же образом, как и частица 19S; 11S может играть роль в деградации чужеродных пептидов, таких как те, которые образуются после заражения вирусом . [ 16]
Количество и разнообразие субъединиц, содержащихся в основной частице 20S, зависит от организма; количество отдельных и специализированных субъединиц больше у многоклеточных, чем у одноклеточных организмов, и больше у эукариот, чем у прокариот. Все частицы 20S состоят из четырех сложенных друг на друга гептамерных кольцевых структур, которые сами состоят из двух различных типов субъединиц; субъединицы α являются структурными по своей природе, тогда как субъединицы β являются преимущественно каталитическими . Субъединицы α являются псевдоферментами, гомологичными субъединицам β. Они собираются так, что их N-концы соседствуют с N-концами субъединиц β. [17] Два внешних кольца в стопке состоят из семи субъединиц α каждое, которые служат стыковочными доменами для регуляторных частиц, а N-концы субъединиц альфа ( Pfam PF10584) образуют ворота, которые блокируют нерегулируемый доступ субстратов во внутреннюю полость. [18] Каждое из двух внутренних колец состоит из семи β-субъединиц и на своих N-концах содержит активные участки протеазы, которые выполняют реакции протеолиза. [19] В очищенном комплексе были идентифицированы три различных каталитических активности: химотрипсин-подобная, трипсин-подобная и пептидилглутамил-пептидный гидролиз. [20] Размер протеасомы относительно консервативен и составляет около 150 ангстрем (Å) на 115 Å. Внутренняя камера имеет ширину не более 53 Å, хотя вход может быть узким до 13 Å, что предполагает, что субстратные белки должны быть по крайней мере частично развернуты для входа. [21]
У архей, таких как Thermoplasma acidophilum , все субъединицы α и все субъединицы β идентичны, тогда как эукариотические протеасомы, такие как протеасомы дрожжей , содержат семь различных типов каждой субъединицы. У млекопитающих субъединицы β1, β2 и β5 являются каталитическими; хотя они имеют общий механизм, у них есть три различные субстратные специфичности, считающиеся химотрипсин -подобными, трипсин -подобными и пептидил-глутамилпептид-гидролизующими (PHGH). [22] Альтернативные формы β, обозначаемые как β1i, β2i и β5i, могут быть экспрессированы в гемопоэтических клетках в ответ на воздействие провоспалительных сигналов , таких как цитокины , в частности, интерферон гамма . Протеасома, собранная с этими альтернативными субъединицами, известна как иммунопротеасома , чья субстратная специфичность изменена относительно нормальной протеасомы. [21] Недавно альтернативная протеасома была идентифицирована в клетках человека, в которых отсутствует основная субъединица α3. [23] Эти протеасомы (известные как протеасомы α4-α4) вместо этого образуют основные частицы 20S, содержащие дополнительную субъединицу α4 вместо отсутствующей субъединицы α3. Ранее было известно, что эти альтернативные протеасомы 'α4-α4' существуют в дрожжах. [24] Хотя точная функция этих изоформ протеасом до сих пор в значительной степени неизвестна, клетки, экспрессирующие эти протеасомы, демонстрируют повышенную устойчивость к токсичности, вызванной ионами металлов, такими как кадмий. [23] [25]
Частица 19S у эукариот состоит из 19 отдельных белков и делится на две подгруппы: основание из 9 субъединиц, которое напрямую связывается с α-кольцом основной частицы 20S, и крышку из 10 субъединиц. Шесть из девяти базовых белков являются субъединицами АТФазы из семейства AAA, и эволюционный гомолог этих АТФаз существует у архей, называемый PAN (нуклеотидаза, активирующая протеасому). [26] Ассоциация частиц 19S и 20S требует связывания АТФ с субъединицами АТФазы 19S, а гидролиз АТФ необходим для того, чтобы собранный комплекс деградировал свернутые и убиквитинированные белки. Обратите внимание, что только этап разворачивания субстрата требует энергии от гидролиза АТФ, в то время как связывание АТФ само по себе может поддерживать все остальные этапы, необходимые для деградации белка (например, сборку комплекса, открытие ворот, транслокацию и протеолиз). [27] [28] Фактически, связывание АТФ с АТФазами само по себе поддерживает быструю деградацию развернутых белков. Однако, хотя гидролиз АТФ требуется только для развертывания, пока не ясно, может ли эта энергия использоваться в сопряжении некоторых из этих шагов. [28] [29]

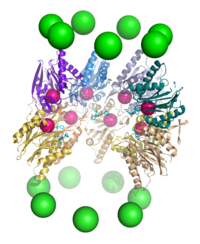
В 2012 году две независимые попытки прояснили молекулярную архитектуру протеасомы 26S с помощью одночастичной электронной микроскопии . [31] [32] В 2016 году три независимых попытки определили первую структуру человеческой протеасомы 26S с разрешением, близким к атомному, в отсутствие субстратов с помощью крио-ЭМ. [33] [34] [35] В 2018 году основные усилия прояснили подробные механизмы деубиквитинирования, инициации транслокации и процессивного разворачивания субстратов путем одновременного определения семи атомных структур протеасомы 26S, взаимодействующей с субстратом. [15] В самом сердце 19S, непосредственно рядом с 20S, находятся AAA-АТФазы ( белки AAA ), которые собираются в гетерогексамерное кольцо порядка Rpt1/Rpt2/Rpt6/Rpt3/Rpt4/Rpt5. Это кольцо представляет собой тример димеров: Rpt1/Rpt2, Rpt6/Rpt3 и Rpt4/Rpt5 димеризуются через свои N-концевые спиральные спирали. Эти спиральные спирали выступают из гексамерного кольца. Самые крупные регуляторные частицы не-АТФазы Rpn1 и Rpn2 связываются с кончиками Rpt1/2 и Rpt6/3 соответственно. Убиквитиновый рецептор Rpn13 связывается с Rpn2 и завершает базовый субкомплекс. Крышка покрывает половину гексамера ААА-АТФазы (Rpt6/Rpt3/Rpt4) и, неожиданно, напрямую контактирует с 20S через Rpn6 и в меньшей степени Rpn5. Субъединицы Rpn9, Rpn5, Rpn6, Rpn7, Rpn3 и Rpn12, которые структурно связаны между собой и с субъединицами комплекса COP9 и eIF3 (отсюда и название субъединицы PCI), собираются в подковообразную структуру, охватывающую гетеродимер Rpn8/Rpn11. Rpn11, деубиквитинирующий фермент , расположен в устье гексамера AAA-ATPase, идеально расположенном для удаления убиквитиновых фрагментов непосредственно перед транслокацией субстратов в 20S. Второй убиквитиновый рецептор, идентифицированный на сегодняшний день, Rpn10, расположен на периферии крышки, рядом с субъединицами Rpn8 и Rpn9.
Регуляторная частица 19S в голоферменте протеасомы 26S на сегодняшний день наблюдалась в шести сильно различающихся конформационных состояниях в отсутствие субстратов. [36] [37] Отличительной чертой конфигурации ААА-АТФазы в этом преобладающем низкоэнергетическом состоянии является лестничное или стопорное расположение ААА-доменов. [30] [31] В присутствии АТФ , но в отсутствие субстрата принимаются три альтернативные, менее распространенные конформации 19S, в первую очередь отличающиеся расположением крышки по отношению к модулю ААА-АТФазы. [33] [37] В присутствии АТФ-γS или субстрата наблюдалось значительно больше конформаций, демонстрирующих резкие структурные изменения модуля ААА-АТФазы. [15] [36] [38] [39] Некоторые из связанных с субстратом конформаций имеют большое сходство с конформациями без субстрата, но они не полностью идентичны, особенно в модуле ААА-АТФазы. [15] [36] До сборки 26S регуляторная частица 19S в свободной форме также наблюдалась в семи конформационных состояниях. [40] Примечательно, что все эти конформеры несколько отличаются и представляют различные особенности. Таким образом, регуляторная частица 19S может выбирать по крайней мере 20 конформационных состояний в различных физиологических условиях.

Регуляторная частица 19S отвечает за стимуляцию 20S к деградации белков. Основной функцией регуляторных АТФаз 19S является открытие ворот в 20S, которые блокируют попадание субстратов в камеру деградации. [41] Механизм, с помощью которого протеасомная АТФаза открывает эти ворота, был недавно выяснен. [18] Открытие ворот 20S и, следовательно, деградация субстрата требуют C-концов протеасомных АТФаз, которые содержат определенный мотив (т. е. мотив HbYX). C-концы АТФаз связываются с карманами в верхней части 20S и привязывают комплекс АТФазы к протеолитическому комплексу 20S, таким образом соединяя оборудование для разворачивания субстрата с оборудованием для деградации 20S. Связывание этих C-концов с этими карманами 20S само по себе стимулирует открытие ворот в 20S во многом таким же образом, как «ключ в замке» открывает дверь. [18] Точный механизм, с помощью которого функционирует этот механизм «ключ в замке», был структурно выяснен в контексте человеческой протеасомы 26S с почти атомным разрешением, что предполагает, что вставка пяти C-концов субъединиц АТФазы Rpt1/2/3/5/6 в поверхностные карманы 20S необходима для полного открытия ворот 20S. [36] [15] [33]
Протеасомы 20S также могут ассоциироваться со вторым типом регуляторной частицы, регуляторной частицей 11S, гептамерной структурой, которая не содержит никаких АТФаз и может способствовать деградации коротких пептидов , но не полных белков. Предполагается, что это происходит потому, что комплекс не может разворачивать более крупные субстраты. Эта структура также известна как PA28, REG или PA26. [17] Механизмы, с помощью которых он связывается с основной частицей через C-концевые хвосты своих субъединиц и вызывает конформационные изменения α-кольца для открытия ворот 20S, предполагают аналогичный механизм для частицы 19S. [42] Экспрессия частицы 11S индуцируется интерфероном гамма и отвечает, совместно с субъединицами β иммунопротеасомы, за генерацию пептидов, которые связываются с главным комплексом гистосовместимости . [16]
Еще один тип не-АТФазной регуляторной частицы — это Blm10 (дрожжи) или PA200/ PSME4 (человек). Он открывает только одну α-субъединицу в воротах 20S и сам сворачивается в купол с очень маленькой порой над ним. [17]
Сборка протеасомы — сложный процесс из-за количества субъединиц, которые должны ассоциироваться для формирования активного комплекса. Субъединицы β синтезируются с N-концевыми «пропептидами», которые посттрансляционно модифицируются во время сборки частицы 20S, чтобы обнажить протеолитический активный центр. Частица 20S собирается из двух полупротеасом, каждая из которых состоит из семичленного про-β-кольца, прикрепленного к семичленному α-кольцу. Ассоциация β-колец двух полупротеасом запускает треонин -зависимый автолиз пропептидов для обнажения активного центра. Эти β-взаимодействия опосредуются в основном солевыми мостиками и гидрофобными взаимодействиями между консервативными альфа-спиралями, нарушение которых мутацией повреждает способность протеасомы к сборке. [43] Сборка полупротеасом, в свою очередь, инициируется сборкой субъединиц α в их гептамерное кольцо, образуя шаблон для ассоциации соответствующего кольца pro-β. Сборка субъединиц α не была охарактеризована. [44]
Только недавно процесс сборки регуляторной частицы 19S был в значительной степени выяснен. Регуляторная частица 19S собирается в виде двух отдельных субкомпонентов, основания и крышки. Сборка базового комплекса облегчается четырьмя сборочными шаперонами , Hsm3/S5b, Nas2/p27, Rpn14/PAAF1 и Nas6/ ганкирин (названия для дрожжей/млекопитающих). [45] Эти сборочные шапероны связываются с субъединицами AAA- АТФазы , и их основная функция, по-видимому, заключается в обеспечении правильной сборки гетерогексамерного кольца AAA- АТФазы . На сегодняшний день все еще ведутся споры о том, собирается ли базовый комплекс отдельно, шаблоном ли сборки является основная частица 20S или существуют ли альтернативные пути сборки. В дополнение к четырем сборочным шаперонам, деубиквитинирующий фермент Ubp6/Usp14 также способствует сборке оснований, но это не является необходимым. [46] Крышка собирается отдельно в определенном порядке и не требует участия сборщиков. [47]

Белки направляются на деградацию протеасомой с ковалентной модификацией остатка лизина, которая требует скоординированных реакций трех ферментов . На первом этапе убиквитин-активирующий фермент (известный как E1) гидролизует АТФ и аденилилирует молекулу убиквитина . Затем он переносится на остаток цистеина активного центра E1 совместно с аденилилированием второго убиквитина. [48] Этот аденилилированный убиквитин затем переносится на цистеин второго фермента, убиквитин-конъюгирующего фермента (E2). На последнем этапе член весьма разнообразного класса ферментов, известных как убиквитинлигазы (E3), распознает конкретный белок, который должен быть убиквитинирован, и катализирует перенос убиквитина из E2 в этот целевой белок. Целевой белок должен быть помечен как минимум четырьмя мономерами убиквитина (в форме полиубиквитиновой цепи), прежде чем он будет распознан крышкой протеасомы. [49] Таким образом, именно E3 придает этой системе субстратную специфичность. [50] Количество экспрессируемых белков E1, E2 и E3 зависит от организма и типа клеток, но у людей присутствует множество различных ферментов E3, что указывает на то, что существует огромное количество мишеней для системы убиквитин-протеасомы.
Механизм, посредством которого полиубиквитинированный белок нацеливается на протеасому, до конца не изучен. Несколько снимков протеасомы, связанной с полиубиквитинированным белком, с высоким разрешением предполагают, что рецепторы убиквитина могут координироваться с деубиквитиназой Rpn11 для первоначального нацеливания и взаимодействия с субстратом. [15] Белки рецепторов убиквитина имеют N-концевой убиквитин-подобный (UBL) домен и один или несколько убиквитин-ассоциированных (UBA) доменов. Домены UBL распознаются колпачками протеасомы 19S, а домены UBA связывают убиквитин через трехспиральные пучки . Эти рецепторные белки могут сопровождать полиубиквитинированные белки в протеасому, хотя специфика этого взаимодействия и его регуляция неясны. [51]
Сам белок убиквитин состоит из 76 аминокислот и был назван из-за своей повсеместной природы, так как он имеет высококонсервативную последовательность и встречается во всех известных эукариотических организмах. [52] Гены, кодирующие убиквитин у эукариот, расположены в тандемных повторах , возможно, из-за высоких требований к транскрипции этих генов для производства достаточного количества убиквитина для клетки. Было высказано предположение, что убиквитин является самым медленно эволюционирующим белком, идентифицированным на сегодняшний день. [53] Убиквитин содержит семь остатков лизина, к которым может быть лигирован другой убиквитин, что приводит к различным типам полиубиквитиновых цепей. [54] Цепи, в которых каждый дополнительный убиквитин связан с лизином 48 предыдущего убиквитина, играют роль в нацеливании протеасомы, в то время как другие типы цепей могут быть вовлечены в другие процессы. [55] [56]

Убиквитиновые цепи, конъюгированные с белком, предназначенным для протеасомной деградации, обычно удаляются любым из трех протеасомно-ассоциированных деубиквитилирующих ферментов (DUB), которыми являются Rpn11, Ubp6/USP14 и UCH37. Этот процесс перерабатывает убиквитин и необходим для поддержания резервуара убиквитина в клетках. [56] Rpn11 является внутренней стехиометрической субъединицей регуляторной частицы 19S и необходим для функционирования протеасомы 26S. DUB-активность Rpn11 усиливается в протеасоме по сравнению с его мономерной формой. То, как Rpn11 удаляет убиквитиновую цепь en bloc из белкового субстрата, было зафиксировано атомной структурой вовлеченной в субстрат человеческой протеасомы в конформации, называемой E B . [15] Интересно, что эта структура также показывает, как активность DUB связана с распознаванием субстрата протеасомной ААА-АТФазой. В отличие от Rpn11, USP14 и UCH37 являются DUB, которые не всегда связаны с протеасомой. В клетках было обнаружено, что около 10-40% протеасом связаны с USP14. Как Ubp6/USP14, так и UCH37 в значительной степени активируются протеасомой и демонстрируют очень низкую активность DUB в одиночку. Было обнаружено, что после активации USP14 подавляет функцию протеасомы своей активностью DUB и путем индукции параллельных путей конформационных переходов протеасомы, один из которых, как оказалось, напрямую запрещает вставку субстрата в ААА-АТФазу, что интуитивно наблюдалось с помощью криогенной электронной микроскопии с временным разрешением. [57] Похоже, что USP14 регулирует функцию протеасомы в нескольких контрольных точках, как каталитически конкурируя с Rpn11, так и аллостерически перепрограммируя состояния ААА-АТФазы, что довольно неожиданно для DUB. [57] Эти наблюдения подразумевают, что регуляция протеасомы может зависеть от ее динамических переходов конформационных состояний.
После убиквитинирования белка он распознается регуляторной частицей 19S на этапе связывания, зависящем от АТФ. [15] [28] Затем субстратный белок должен войти внутрь субъединицы 20S, чтобы войти в контакт с протеолитически активными сайтами. Поскольку центральный канал частицы 20S узкий и закрыт N-концевыми хвостами субъединиц α-кольца, субстраты должны быть по крайней мере частично развернуты, прежде чем они попадут в ядро. [15] Проход развернутого субстрата в ядро называется транслокацией и обязательно происходит после деубиквитинирования. [15] [28] Однако порядок, в котором субстраты деубиквитинируются и развертываются, пока не ясен. [58] Какой из этих процессов является этапом, ограничивающим скорость в общей реакции протеолиза, зависит от конкретного субстрата; Для некоторых белков процесс разворачивания является лимитирующим по скорости, в то время как деубиквитинирование является самым медленным этапом для других белков. [27] Предполагается, что степень, в которой субстраты должны быть развернуты перед транслокацией, составляет около 20 аминокислотных остатков по атомной структуре субстрат-задействованной протеасомы 26S в состоянии, совместимом с деубиквитинированием, [15] но существенная третичная структура и, в частности, нелокальные взаимодействия, такие как дисульфидные связи , достаточны для ингибирования деградации. [59] Также предполагается, что наличие внутренне неупорядоченных сегментов белка достаточного размера, либо на конце белка, либо внутри, способствует эффективному началу деградации. [60] [61]
Ворота, образованные субъединицами α, не позволяют пептидам длиннее четырех остатков проникать внутрь частицы 20S. Молекулы АТФ, связанные до начального этапа распознавания, гидролизуются перед транслокацией. Хотя энергия необходима для разворачивания субстрата, она не требуется для транслокации. [27] [28] Собранная протеасома 26S может разрушать несвернутые белки в присутствии негидролизуемого аналога АТФ , но не может разрушать свернутые белки, что указывает на то, что энергия от гидролиза АТФ используется для разворачивания субстрата. [27] Прохождение несвернутого субстрата через открытые ворота происходит посредством облегченной диффузии , если кэп 19S находится в связанном с АТФ состоянии. [62]
Механизм разворачивания глобулярных белков обязательно является общим, но в некоторой степени зависит от последовательности аминокислот . Было показано, что длинные последовательности чередующегося глицина и аланина ингибируют разворачивание субстрата, снижая эффективность протеасомной деградации; это приводит к высвобождению частично разложенных побочных продуктов, возможно, из-за разъединения этапов гидролиза АТФ и разворачивания. [63] Такие глицин-аланиновые повторы также встречаются в природе, например, в фиброине шелка ; в частности, некоторые продукты генов вируса Эпштейна-Барр, несущие эту последовательность, могут останавливать протеасому, помогая вирусу размножаться, предотвращая презентацию антигена в главном комплексе гистосовместимости. [64]
Протеасома функционирует как эндопротеаза . [65] [66] [67] [68] Механизм протеолиза субъединицами β ядра 20S осуществляется посредством треонин-зависимой нуклеофильной атаки . Этот механизм может зависеть от связанной молекулы воды для депротонирования реактивного гидроксила треонина . Деградация происходит в центральной камере, образованной ассоциацией двух β колец, и обычно не высвобождает частично деградированные продукты, вместо этого уменьшая субстрат до коротких полипептидов, обычно длиной 7–9 остатков, хотя они могут варьироваться от 4 до 25 остатков, в зависимости от организма и субстрата. Биохимический механизм, определяющий длину продукта, полностью не охарактеризован. [69] Хотя три каталитические субъединицы β имеют общий механизм, они имеют немного различную субстратную специфичность, которая считается химотрипсин-подобной, трипсин-подобной и пептидил-глутамилпептид-гидролизующей (PHGH)-подобной. Эти вариации специфичности являются результатом межатомных контактов с локальными остатками вблизи активных участков каждой субъединицы. Каждая каталитическая субъединица β также обладает консервативным остатком лизина, необходимым для протеолиза. [22]
Хотя протеасома обычно производит очень короткие пептидные фрагменты, в некоторых случаях эти продукты сами по себе являются биологически активными и функциональными молекулами. Некоторые факторы транскрипции, регулирующие экспрессию определенных генов, включая один компонент комплекса млекопитающих NF-κB , синтезируются как неактивные предшественники, убиквитинирование которых и последующая протеасомная деградация преобразуют их в активную форму. Такая активность требует, чтобы протеасома расщепила субстратный белок изнутри, а не процессивно деградировала его с одного конца. Было высказано предположение, что длинные петли на поверхности этих белков служат протеасомными субстратами и входят в центральную полость, в то время как большая часть белка остается снаружи. [70] Аналогичные эффекты наблюдались в дрожжевых белках; этот механизм селективной деградации известен как регулируемая убиквитин/протеасомная зависимая обработка (RUP). [71]
Хотя большинство протеасомных субстратов должны быть убиквитинированы перед деградацией, существуют некоторые исключения из этого общего правила, особенно когда протеасома играет нормальную роль в посттрансляционной обработке белка. Протеасомная активация NF-κB путем обработки p105 в p50 посредством внутреннего протеолиза является одним из основных примеров. [70] Некоторые белки, которые предположительно нестабильны из-за внутренне неструктурированных областей, [72] деградируют убиквитин-независимым образом. Наиболее известным примером убиквитин-независимого протеасомного субстрата является фермент орнитиндекарбоксилаза . [73] Также сообщалось об убиквитин-независимых механизмах, нацеленных на ключевые регуляторы клеточного цикла , такие как p53 , хотя p53 также подвержен убиквитин-зависимой деградации. [74] Наконец, структурно аномальные, неправильно свернутые или сильно окисленные белки также подвергаются убиквитин-независимой и 19S-независимой деградации в условиях клеточного стресса. [75]

Протеасома 20S является как повсеместной, так и необходимой для эукариот и архей. Бактериальный отряд Actinomycetales также имеет гомологов протеасомы 20S, тогда как большинство бактерий обладают генами теплового шока hslV и hslU , генными продуктами которых являются мультимерная протеаза, организованная в двухслойное кольцо, и АТФаза. [76] Было высказано предположение, что белок hslV напоминает вероятного предка протеасомы 20S. [77] В целом, HslV не является необходимым для бактерий, и не все бактерии обладают им, тогда как некоторые простейшие обладают как системами 20S, так и hslV. [76] Многие бактерии также обладают другими гомологами протеасомы и связанной с ней АТФазой, в первую очередь ClpP и ClpX . Эта избыточность объясняет, почему система HslUV не является необходимой.
Анализ последовательности предполагает, что каталитические субъединицы β расходятся в эволюции раньше, чем преимущественно структурные субъединицы α. У бактерий, которые экспрессируют протеасому 20S, субъединицы β имеют высокую идентичность последовательностей с субъединицами β архей и эукариот, тогда как идентичность последовательностей α намного ниже. Наличие протеасом 20S у бактерий может быть результатом латерального переноса генов , тогда как диверсификация субъединиц среди эукариот приписывается множественным событиям дупликации генов . [76]
Прогресс клеточного цикла контролируется упорядоченным действием циклин-зависимых киназ (CDK), активируемых специфическими циклинами , которые разграничивают фазы клеточного цикла . Митотические циклины, которые сохраняются в клетке всего несколько минут, имеют одну из самых коротких продолжительностей жизни среди всех внутриклеточных белков. [1] После того, как комплекс CDK-циклин выполнил свою функцию, связанный циклин полиубиквитинируется и разрушается протеасомой, что обеспечивает направленность клеточного цикла. В частности, выход из митоза требует протеасомозависимой диссоциации регуляторного компонента циклина B из комплекса факторов, способствующих митозу . [78] В клетках позвоночных может произойти «проскальзывание» через митотическую контрольную точку, приводящее к преждевременному выходу из фазы М, несмотря на задержку этого выхода из-за контрольной точки веретена . [79]
Более ранние контрольные точки клеточного цикла, такие как проверка точки пост-рестрикции между фазой G 1 и фазой S , также включают протеасомную деградацию циклина А , убиквитинирование которого стимулируется комплексом, способствующим анафазе (APC), убиквитинлигазой E3 . [80] APC и белковый комплекс Skp1/Cul1/F-box ( комплекс SCF ) являются двумя ключевыми регуляторами деградации циклина и контроля контрольной точки; сам SCF регулируется APC посредством убиквитинирования адаптерного белка Skp2, который предотвращает активность SCF до перехода G1-S. [81]
Отдельные компоненты частицы 19S имеют свои собственные регуляторные роли. Ганкирин , недавно идентифицированный онкопротеин , является одним из субкомпонентов 19S, который также прочно связывает циклин-зависимую киназу CDK4 и играет ключевую роль в распознавании убиквитинированного p53 , через его сродство к убиквитинлигазе MDM2 . Ганкирин является антиапоптотическим и , как было показано, сверхэкспрессируется в некоторых типах опухолевых клеток, таких как гепатоцеллюлярная карцинома . [82]
Подобно эукариотам, некоторые археи также используют протеасому для контроля клеточного цикла, в частности, контролируя деление клеток, опосредованное ESCRT -III. [83]
В растениях сигнализация ауксинов или фитогормонов , которые упорядочивают направление и тропизм роста растений, индуцирует нацеливание класса репрессоров факторов транскрипции, известных как белки Aux/IAA, для протеасомной деградации. Эти белки убиквитинируются SCFTIR1 или SCF в комплексе с рецептором ауксина TIR1. Деградация белков Aux/IAA дерепрессирует факторы транскрипции в семействе факторов ответа на ауксин (ARF) и индуцирует экспрессию генов, направленную на ARF. [84] Клеточные последствия активации ARF зависят от типа растения и стадии развития, но участвуют в управлении ростом корней и жилок листьев. Считается, что специфический ответ на дерепрессию ARF опосредован специфичностью в паре отдельных белков ARF и Aux/IAA. [85]
Как внутренние, так и внешние сигналы могут приводить к индукции апоптоза или запрограммированной гибели клеток. Результирующая деконструкция клеточных компонентов в первую очередь осуществляется специализированными протеазами, известными как каспазы , но протеасома также играет важную и разнообразную роль в процессе апоптоза. Участие протеасомы в этом процессе указывается как увеличением убиквитинирования белка, так и ферментов E1, E2 и E3, которое наблюдается задолго до апоптоза. [86] [87] [88] Во время апоптоза также наблюдалось, что протеасомы, локализованные в ядре, перемещаются в пузырьки внешней мембраны , характерные для апоптоза. [89]
Ингибирование протеасомы по-разному влияет на индукцию апоптоза в разных типах клеток. В целом, протеасома не требуется для апоптоза, хотя ее ингибирование является проапоптотическим в большинстве изученных типов клеток. Апоптоз опосредуется посредством нарушения регулируемой деградации белков проростового клеточного цикла. [90] Однако некоторые клеточные линии — в частности, первичные культуры покоящихся и дифференцированных клеток , таких как тимоциты и нейроны — не подвергаются апоптозу при воздействии ингибиторов протеасомы. Механизм этого эффекта не ясен, но предполагается, что он специфичен для клеток в состоянии покоя или является результатом дифференциальной активности проапоптотической киназы JNK . [91] Способность ингибиторов протеасомы вызывать апоптоз в быстро делящихся клетках использовалась в нескольких недавно разработанных химиотерапевтических агентах, таких как бортезомиб и салиноспорамид А.
В ответ на клеточные стрессы, такие как инфекция , тепловой шок или окислительное повреждение , экспрессируются белки теплового шока , которые идентифицируют неправильно свернутые или развернутые белки и направляют их на протеасомную деградацию. Оба белка - шапероны Hsp27 и Hsp90 были вовлечены в повышение активности системы убиквитин-протеасома, хотя они не являются прямыми участниками процесса. [92] С другой стороны, Hsp70 связывает открытые гидрофобные участки на поверхности неправильно свернувшихся белков и привлекает убиквитинлигазы E3, такие как CHIP, для маркировки белков для протеасомной деградации. [93] Белок CHIP (карбоксильный конец белка, взаимодействующего с Hsp70) сам по себе регулируется посредством ингибирования взаимодействий между ферментом E3 CHIP и его партнером по связыванию E2. [94]
Аналогичные механизмы существуют для содействия деградации окислительно поврежденных белков через систему протеасом. В частности, протеасомы, локализованные в ядре, регулируются PARP и активно деградируют ненадлежащим образом окисленные гистоны . [95] Окисленные белки, которые часто образуют большие аморфные агрегаты в клетке, могут деградировать непосредственно частицей ядра 20S без регуляторного колпачка 19S и не требуют гидролиза АТФ или маркировки убиквитином. [75] Однако высокие уровни окислительного повреждения увеличивают степень перекрестного связывания между фрагментами белка, делая агрегаты устойчивыми к протеолизу. Большее количество и размеры таких сильно окисленных агрегатов связаны со старением . [96]
Нарушение регуляции системы убиквитин-протеасом может способствовать возникновению нескольких невральных заболеваний. Это может привести к опухолям мозга, таким как астроцитомы . [97] При некоторых нейродегенеративных заболеваниях с поздним началом, для которых характерна агрегация неправильно свернутых белков, таких как болезнь Паркинсона и болезнь Альцгеймера , могут образовываться крупные нерастворимые агрегаты неправильно свернутых белков, которые затем приводят к нейротоксичности посредством механизмов, которые еще не до конца изучены. Сниженная активность протеасом была предложена в качестве причины агрегации и образования телец Леви при болезни Паркинсона. [98] Эта гипотеза подтверждается наблюдением, что дрожжевые модели болезни Паркинсона более восприимчивы к токсичности α-синуклеина , основного белкового компонента телец Леви, в условиях низкой активности протеасом. [99] Нарушенная протеасомная активность может лежать в основе когнитивных расстройств, таких как расстройства аутистического спектра , а также заболеваний мышц и нервов, таких как миопатия с тельцами включения . [97]
Протеасома играет простую, но важную роль в функционировании адаптивной иммунной системы . Пептидные антигены отображаются белками главного комплекса гистосовместимости класса I (MHC) на поверхности антигенпрезентирующих клеток . Эти пептиды являются продуктами протеасомной деградации белков, образованных вторгшимся патогеном . Хотя конститутивно экспрессируемые протеасомы могут участвовать в этом процессе, специализированный комплекс, состоящий из белков, экспрессия которых индуцируется интерфероном гамма , является основным производителем пептидов, которые оптимальны по размеру и составу для связывания MHC. Эти белки, экспрессия которых увеличивается во время иммунного ответа, включают регуляторную частицу 11S, чья основная известная биологическая роль заключается в регулировании продукции лигандов MHC, и специализированные субъединицы β, называемые β1i, β2i и β5i с измененной субстратной специфичностью. Комплекс, образованный специализированными субъединицами β, известен как иммунопротеасома . [16] Другая субъединица варианта β5i, β5t, экспрессируется в тимусе, что приводит к образованию специфической для тимуса « тимопротеасомы », функция которой пока неясна. [100]
Сила связывания лиганда MHC класса I зависит от состава C-конца лиганда , поскольку пептиды связываются посредством водородных связей и тесных контактов с областью, называемой «B-карманом» на поверхности MHC. Многие аллели MHC класса I предпочитают гидрофобные остатки C-конца, а иммунопротеасомный комплекс с большей вероятностью будет генерировать гидрофобные C-концы. [101]
Из-за своей роли в генерации активированной формы NF-κB , антиапоптотического и провоспалительного регулятора экспрессии цитокинов , протеасомальная активность была связана с воспалительными и аутоиммунными заболеваниями . Повышенные уровни протеасомальной активности коррелируют с активностью заболевания и были вовлечены в аутоиммунные заболевания, включая системную красную волчанку и ревматоидный артрит . [16]
Протеасома также участвует в внутриклеточном антитело-опосредованном протеолизу вирионов, связанных с антителами. В этом пути нейтрализации TRIM21 (белок семейства трехкомпонентных мотивов) связывается с иммуноглобулином G , чтобы направить вирион в протеасому, где он деградирует. [102]
Ингибиторы протеасомы обладают эффективной противоопухолевой активностью в клеточной культуре , вызывая апоптоз путем нарушения регулируемой деградации белков клеточного цикла, способствующих росту. [90] Этот подход избирательного индуцирования апоптоза в опухолевых клетках доказал свою эффективность в животных моделях и испытаниях на людях.
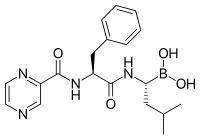
Лактацистин , натуральный продукт, синтезируемый бактериями Streptomyces , был первым обнаруженным непептидным ингибитором протеасомы [103] и широко используется в качестве исследовательского инструмента в биохимии и клеточной биологии. Лактацистин был лицензирован Myogenics/Proscript, которая была приобретена Millennium Pharmaceuticals , теперь частью Takeda Pharmaceuticals . Лактацистин ковалентно модифицирует аминоконцевой треонин каталитических β-субъединиц протеасомы, в частности β5-субъединицу, ответственную за химотрипсин-подобную активность протеасомы. Это открытие помогло установить протеасому как механистически новый класс протеаз: аминоконцевую треониновую протеазу .
Бортезомиб (боронированный MG132), молекула, разработанная Millennium Pharmaceuticals и продаваемая под названием Velcade, является первым ингибитором протеасом, который достиг клинического применения в качестве химиотерапевтического средства. [104] Бортезомиб используется при лечении множественной миеломы . [105] Примечательно, что множественная миелома приводит к повышению уровня пептидов, полученных из протеасом, в сыворотке крови , который снижается до нормального уровня в ответ на успешную химиотерапию. [106] Исследования на животных показали, что бортезомиб также может иметь клинически значимые эффекты при раке поджелудочной железы . [107] [108] Были начаты доклинические и ранние клинические исследования для изучения эффективности бортезомиба при лечении других видов рака, связанных с В-клетками , [109] в частности, некоторых типов неходжкинской лимфомы . [110] Клинические результаты также, по-видимому, оправдывают использование ингибитора протеасомы в сочетании с химиотерапией при остром лимфобластном лейкозе В-клеток [111] Ингибиторы протеасомы могут убивать некоторые типы культивируемых лейкозных клеток, которые устойчивы к глюкокортикоидам. [112]
Молекула ритонавира , продаваемая как Norvir, была разработана как ингибитор протеазы и использовалась для борьбы с ВИЧ- инфекцией. Однако было показано, что она ингибирует протеасомы, а также свободные протеазы; если быть точным, химотрипсин -подобная активность протеасомы ингибируется ритонавиром, в то время как трипсин -подобная активность несколько усиливается. [113] Исследования на животных моделях показывают, что ритонавир может оказывать ингибирующее действие на рост клеток глиомы . [114]
Ингибиторы протеасом также показали свою эффективность в лечении аутоиммунных заболеваний на животных моделях. Например, исследования на мышах с трансплантатами человеческой кожи показали уменьшение размера поражений от псориаза после лечения ингибитором протеасом. [115] Ингибиторы также показывают положительные эффекты на моделях астмы на грызунах . [116]
Маркировка и ингибирование протеасомы также представляет интерес в лабораторных условиях для изучения протеасомной активности в клетках как in vitro , так и in vivo . Наиболее часто используемыми лабораторными ингибиторами являются лактацистин и пептидный альдегид MG132, первоначально разработанный лабораторией Голдберга. Флуоресцентные ингибиторы также были разработаны для специфической маркировки активных участков собранной протеасомы. [117]
Протеасома и ее субъединицы имеют клиническое значение по крайней мере по двум причинам: (1) нарушенная сложная сборка или дисфункциональная протеасома могут быть связаны с базовой патофизиологией определенных заболеваний, и (2) их можно использовать в качестве лекарственных мишеней для терапевтических вмешательств. В последнее время все больше усилий было приложено для рассмотрения протеасомы с целью разработки новых диагностических маркеров и стратегий. Улучшенное и всестороннее понимание патофизиологии протеасомы должно привести к ее клиническому применению в будущем.
Протеасомы образуют основной компонент для системы убиквитин-протеасома (UPS) [118] и соответствующего контроля качества клеточного белка (PQC). Убиквитинирование белка и последующий протеолиз и деградация протеасомой являются важными механизмами в регуляции клеточного цикла , роста и дифференциации клеток , транскрипции генов, передачи сигнала и апоптоза . [119] Дефекты протеасом приводят к снижению протеолитической активности и накоплению поврежденных или неправильно свернутых белков, что может способствовать нейродегенеративным заболеваниям, [120] [121] сердечно-сосудистым заболеваниям, [122] [123] [124] воспалительным реакциям и аутоиммунным заболеваниям, [125] и системным реакциям на повреждение ДНК, приводящим к злокачественным новообразованиям . [126]
Исследования показали, что дефекты UPS связаны с патогенезом нейродегенеративных и миодегенеративных заболеваний, включая болезнь Альцгеймера [127] , болезнь Паркинсона [128] и болезнь Пика [129] , боковой амиотрофический склероз (БАС), [129] болезнь Хантингтона [128] , болезнь Крейтцфельдта–Якоба [130] и заболевания двигательных нейронов , полиглутаминовые (PolyQ) заболевания, мышечные дистрофии [131] и несколько редких форм нейродегенеративных заболеваний, связанных с деменцией [132] . Как часть убиквитин-протеасомной системы (UPS), протеасома поддерживает гомеостаз сердечного белка и, таким образом, играет важную роль в ишемическом повреждении сердца [133] гипертрофии желудочков [134] и сердечной недостаточности . [135] Кроме того, накапливаются доказательства того, что UPS играет существенную роль в злокачественной трансформации. Протеолиз UPS играет важную роль в ответах раковых клеток на стимулирующие сигналы, которые имеют решающее значение для развития рака. Соответственно, экспрессия генов путем деградации факторов транскрипции , таких как p53 , c-jun , c-Fos , NF-κB , c-Myc , HIF-1α, MATα2, STAT3 , стерол-регулируемые элементы-связывающие белки и андрогеновые рецепторы , все контролируются UPS и, таким образом, участвуют в развитии различных злокачественных новообразований. [136] Более того, UPS регулирует деградацию продуктов генов-супрессоров опухолей, таких как аденоматозный полипоз толстой кишки (APC) при колоректальном раке, ретинобластома (Rb). и супрессор опухолей фон Гиппеля–Линдау (VHL), а также ряд протоонкогенов ( Raf , Myc , Myb , Rel , Src , Mos , ABL ). UPS также участвует в регуляции воспалительных реакций. Эта активность обычно приписывается роли протеасом в активации NF-κB, который далее регулирует экспрессию провоспалительных цитокинов, таких как TNF-α , IL-β, IL-8 , молекул адгезии ( ICAM-1 , VCAM-1 , P-селектин ) ипростагландины и оксид азота (NO). [125] Кроме того, UPS также играет роль в воспалительных реакциях в качестве регуляторов пролиферации лейкоцитов, в основном посредством протеолиза циклинов и деградации ингибиторов CDK . [137] Наконец, у пациентов с аутоиммунными заболеваниями, такими как СКВ , синдром Шегрена и ревматоидный артрит (РА), в основном обнаруживаются циркулирующие протеасомы, которые можно использовать в качестве клинических биомаркеров. [138]