Полный синтез таксола Данишефски в органической химии является важным третьим синтезом таксола, опубликованным группой Самуэля Данишефски в 1996 году [1] через два года после первых двух попыток, описанных в полном синтезе таксола Холтона и полном синтезе таксола Николау . Объединенные вместе, они дают хорошее представление о применении органической химии в полном синтезе .
Путь Данишефски к Таксолу имеет много общего с путем Николау. Оба являются примерами конвергентного синтеза с соединением колец А и С из двух предшественников. Основной характеристикой варианта Данишефски является завершение оксетанового кольца D на циклогексанольном кольце С до построения 8-членного кольца В. Наиболее известным исходным материалом является (+) энантиомер кетона Виланда-Мишера . Это соединение коммерчески доступно в виде одного энантиомера , и единственная хиральная группа, присутствующая в этой молекуле, способна управлять всей последовательностью органических реакций до одного оптически активного конечного продукта Таксола. Последний шаг, хвостовое присоединение, идентичен таковому Николау и основан на химии Одзимы .
С точки зрения закупки сырья, эта молекула таксола состоит из вышеупомянутого кетона Виланда-Мишера , 2-метил-3-пентанона , алюмогидрида лития , тетроксида осмия , фениллития , хлорхромата пиридиния , реагента Кори-Чайковского и акрилоилхлорида . Ключевыми химическими превращениями являются реакция Джонсона-Кори-Чайковского и реакция Хека .
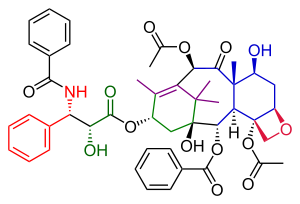
Таксол получился в результате присоединения хвостовой части лактама Оджима к спирту 51 , который является баккатином III (исходная целевая молекула синтеза Данишефского). Спирт 51 был получен в результате аллильного окисления α-ацилкетона 49. Соединение 49 в конечном итоге было получено в результате реакции Хека енолтрифлата 38 , который использовался для замыкания B-кольца. Енолтрифлат 38 получился в результате перегруппировки соединения 31 после защиты его гидроксильной группы. Соединение 31 было получено в результате соединения колец A и C с альдегидом 21 , объединенным с виниллитиевым реагентом, полученным из циангидрина 29. Циангидрин 29 произошел как этилизопропилкетон ( 22 ). Альдегид 21 был получен из соединения 17 , которое было продуктом открытия кеталя 12 . Кеталь 12 в конечном итоге был получен из кетона Виланда-Мишера ( 1 ).
Схема 1 показывает синтез оксетанового кольца D из кольца C, начиная с (+) энантиомера кетона Виланда-Мишера ( 1 ). Восстановление этого дикетона боргидридом натрия дало ненасыщенный кетоспирт 2 , который был защищен в виде ацетата. Образование кеталя сопровождалось перегруппировкой алкена. Ацетильная группа была заменена трет-бутилдиметилсилильной защитной группой. Гидроборирование с последующим окислением перекисью водорода дало спирт 5 . Затем гидроксильная группа была окислена до карбонильной группы, дав кетон 6 под действием дихромата пиридиния . После защиты всех чувствительных функциональных групп метиленовая группа, необходимая для оксетанового кольца D, была затем предоставлена реагентом Кори-Чайковского , который превратил карбонильную группу в эпоксид ( 7 ). Обработка этого эпоксида изопропоксидом алюминия дала аллиловый спирт 8 . Еще две гидроксильные группы были добавлены путем окисления новообразованной двойной связи каталитическим количеством тетроксида осмия в присутствии N-оксида N-метилморфолина . Эта реакция не имела стереоспецифичности , и выход триола 9 с правильной стереохимией был поэтому снижен. Первичный спирт был защищен как силиловый эфир , а вторичный спирт был активирован как трифлат ( 11 ). Нагревание этого триметилсилилзащищенного трифлата в кипящем этиленгликоле замкнуло кольцо, получив оксетан 12 .
На следующем этапе ( Схема 2 ), начиная с кеталя 12 , циклогексановое кольцо было расщеплено, чтобы обеспечить две точки закрепления для слияния с кольцом A. Спирт 12 был защищен бензильной группой. Защитная группа ацетонида была удалена из кетона. Кетон 14 был преобразован в силиловый еноловый эфир 15 реакцией с триметилсилилтрифлатом, а модифицированное окисление Руботтома с использованием 3,3-диметилдиоксирана с последующей обработкой камфорсульфоновой кислотой ввело гидроксильную группу альфа в кетон. Раскрытие кольца окислительным расщеплением с тетраацетатом свинца в метаноле дало соединение 17. На следующем этапе альдегид был защищен в виде диметилацеталя, а эфир был восстановлен , чтобы получить первичный спирт 18 . Гидроксильная группа была преобразована в результате элиминирования Грико в селенид ( 19 ), который при окислении перекисью водорода дал алкен 20. Озонолиз с озоном и трифенилфосфином дал альдегид 21 .
Для этого синтеза ( Схема 3 ) морфолиновый енамин этилизопропилкетона обрабатывали акрилоилхлоридом, получая после гидролиза дикетон 25. Реакция с гидразином в триэтиламине и этаноле давала гидразон 26. После необычного иодирования гидразона , которое также включало иодирование альфа в карбонильную группу и устранение HI, в неожиданной дегидрировании был получен полностью сопряженный винилиодид 28. Кетон был преобразован в циангидрин 29 с триметилсилилцианидом , цианидом калия и краун-эфиром .
Как показано на схеме 4 , нижняя часть синтеза кольца таксола B включала реакцию альдегидной группы кольца C 21. Кетонную группу сняли защитой под действием фторида тетра-н-бутиламмония , а двойную связь эпоксидировали мета-хлорпероксибензойной кислотой до эпоксида 32. Затем этот эпоксид гидрировали водородом над палладием на углероде, получая диол 33 , который был защищен на следующем этапе как циклический карбонатный эфир ( 34 ).
Восстановление L-селектридом енона 34 дало кетон 35. Кетон был преобразован в винилтрифлат 36 с использованием фенилтрифлимида и гексаметилдисилазида калия в тетрагидрофуране при -78 °C. Этот винилтрифлат был одной из функциональных групп, необходимых для реакции Хека . Для получения другой реакционноспособной группы ацетальная группа была удалена, чтобы получить альдегид 37 , который впоследствии был преобразован в терминальный алкен 38 в реакции Виттига с участием метилентрифенилфосфорана . Внутримолекулярная реакция Хека включала тетракис(трифенилфосфин)палладий(0) и карбонат калия в ацетонитриле при кипячении с обратным холодильником, чтобы получить диен 39 и завершить формирование кольца B.
Вторая часть синтеза кольца B ( Схема 5 ) касалась правильной химии для новообразованного этиленового мостика, соединяющего кольца A и C. После Схемы 4 этот мостик содержал экзоциклическую метиленовую группу, но в конечной молекуле таксола этот мостик представляет собой α-ацилкетон. Требуемое преобразование было достигнуто за следующие 10 шагов.
Защитная группа трет-бутилсилил в диене 39 оказалась несовместимой в последующих реакциях и была заменена триэтилсилилом . Эпоксидирование диена 40 мета -хлорпероксибензойной кислотой дало оксирановое кольцо. Оно служило исключительно в качестве защитной группы при подготовке к модификациям экзоциклического алкена. На следующих двух этапах защитная группа бензила в соединении 41 была заменена ацетильной группой. Карбонатный эфир 43 был открыт реакцией с фениллитием с получением спирта 44. Расщепление экзоциклической двойной связи было затруднено и осуществлялось только при форсированных условиях (19 эквивалентов тетроксида осмия , 105 °C, 24 часа) предполагаемым осматным эфиром ( 45 ). Последующее окислительное расщепление тетраацетатом свинца дало кетон 46 . Защитная эпоксидная группа была удалена с помощью иодида самария (II) [2] с получением α-ß-ненасыщенного кетона 47. Енолят был образован в результате реакции кетона 47 с трет-бутоксидом калия , а последующая реакция с фенилселениновым ангидридом с последующим ацилированием дала α-ацилкетон 49 .
Этап присоединения хвоста в этом синтезе ( Схема 6 ) был идентичен этапу присоединения хвоста Николау и был основан на химии Ойджмы . Кольцо А было функционализировано гидроксильной группой посредством окисления пиридинийхлорхроматом α-ацилкетона 49 с образованием кетона 50. Последующее восстановление с использованием боргидрида натрия дало спирт 51. Реакция этого спирта с лактамом Оджима 52 и заключительный этап снятия защиты силилом в двух триэтилсилильных положениях в соединении 53 дали таксол.
В синтезе используются различные защитные группы, такие как: