
Гипоксия относится к условиям с низким содержанием кислорода . Для организмов, дышащих воздухом, гипоксия представляет собой проблему, но для многих анаэробных организмов гипоксия необходима. Гипоксия применима ко многим ситуациям, но обычно относится к атмосфере и природным водам. [3]
Атмосферная гипоксия естественным образом возникает на больших высотах . Общее атмосферное давление снижается с увеличением высоты, что приводит к снижению парциального давления кислорода, что определяется как гипобарическая гипоксия. Кислород остается на уровне 20,9% от общей газовой смеси, в отличие от гипоксической гипоксии , при которой процент кислорода в воздухе (или крови) снижается. Это обычное явление в запечатанных норах некоторых подземных животных, таких как блесмолы . [4] Атмосферная гипоксия также является основой высотной подготовки , которая является стандартной частью тренировок элитных спортсменов. Некоторые компании имитируют гипоксию, используя нормобарическую искусственную атмосферу .
Водная система, в которой отсутствует растворенный кислород (насыщение 0%), называется анаэробной, восстановительной или бескислородной .
В воде уровень кислорода составляет примерно 7 частей на миллион или 0,0007% в воде хорошего качества, но колеблется. [5] Многим организмам необходимы гипоксические условия. Например, кислород ядовит для анаэробных бактерий . [3]
Истощение кислорода обычно выражается в процентах от кислорода, который растворяется в воде при преобладающей температуре и солености. Система с низкой концентрацией — в диапазоне от 1 до 30% насыщения — называется гипоксической или дизоксической . Большинство рыб не могут жить при насыщении ниже 30%, поскольку они полагаются на кислород для получения энергии из питательных веществ. Гипоксия приводит к нарушению воспроизводства оставшихся рыб вследствие эндокринных нарушений . [6] «Здоровая» водная среда редко должна иметь насыщенность ниже 80%. Экзаэробная зона находится на границе аноксической и гипоксической зон.
Гипоксия может возникать во всей толще воды, а также на больших высотах, а также вблизи отложений на дне. Обычно он простирается на 20-50% толщи воды, но зависит от глубины воды и расположения пикноклинов (быстрых изменений плотности воды с глубиной). Это может произойти в 10-80% толщи воды. Например, в 10-метровой толще воды она может достигать глубины до 2 метров. В толще воды 20 метров он может простираться на глубину до 8 метров. [7]
Гиполимнетическое истощение кислорода может привести как к летним, так и к зимним «убийствам». Во время летней стратификации поступления органических веществ и осаждение первичных продуцентов могут увеличить скорость дыхания в гиполимнионе . Если истощение кислорода станет экстремальным, аэробные организмы, такие как рыбы, могут погибнуть, что приведет к так называемой «летней гибели». [8] Те же явления могут возникать и зимой, но по другим причинам. Зимой лед и снежный покров могут ослаблять свет и, следовательно, снижать скорость фотосинтеза. Замерзание озера также предотвращает взаимодействие воздуха и воды, которое обеспечивает обмен кислорода. Это создает недостаток кислорода при продолжающемся дыхании. Когда кислород сильно истощается, анаэробные организмы могут погибнуть, что приведет к «зимней гибели». [8]

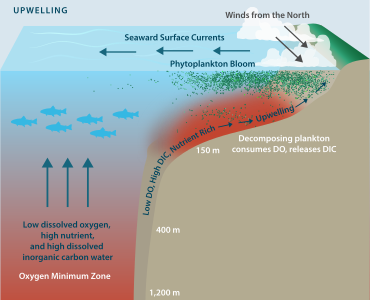
Истощение кислорода может быть результатом ряда природных факторов, но чаще всего вызывает беспокойство вследствие загрязнения и эвтрофикации , при которых питательные вещества растений попадают в реки, озера или океаны, что способствует цветению фитопланктона . В то время как фитопланктон посредством фотосинтеза повышает насыщение DO в дневное время, плотная популяция цветков снижает насыщение DO в ночное время за счет дыхания . Когда клетки фитопланктона умирают, они опускаются на дно и разлагаются бактериями — процесс, который еще больше снижает содержание DO в толще воды. Если истощение кислорода переходит в гипоксию, может произойти гибель рыбы , а также беспозвоночных, таких как черви и моллюски на дне.

Гипоксия может возникать и в отсутствие загрязняющих веществ. Например, в эстуариях пресная вода, текущая из реки в море, менее плотная, чем соленая, что может привести к расслоению водной толщи. Таким образом, вертикальное перемешивание между водоемами уменьшается, что ограничивает поступление кислорода из поверхностных вод в более соленые придонные воды. Концентрация кислорода в придонном слое может тогда стать достаточно низкой, чтобы возникла гипоксия. Районы, особенно склонные к этому, включают мелководье полузамкнутых водоемов, таких как Ваддензее или Мексиканский залив , где сток с суши значителен. На этих территориях может возникнуть так называемая « мертвая зона ». Условия с низким содержанием растворенного кислорода часто носят сезонный характер, как в случае с каналом Худ и районами Пьюджет-Саунд в штате Вашингтон. [9] Институт мировых ресурсов выявил 375 гипоксических прибрежных зон по всему миру, сконцентрированных в прибрежных районах Западной Европы, восточного и южного побережья США и Восточной Азии, особенно в Японии. [10]

Гипоксия также может быть объяснением периодических явлений, таких как юбилей залива Мобил , когда водная жизнь внезапно устремляется на мелководье, возможно, пытаясь спастись из обедненной кислородом воды. Недавняя массовая гибель моллюсков у берегов Орегона и Вашингтона также объясняется циклической экологией мертвой зоны . [11]
Фитопланктон в основном состоит из лигнина и целлюлозы, которые расщепляются по окислительному механизму, потребляя кислород. [12]
Распад фитопланктона в окружающей среде зависит от присутствия кислорода, и как только кислорода больше нет в водоемах, лигнинпероксидазы не могут продолжать расщеплять лигнин. При отсутствии кислорода в воде время, необходимое для распада фитопланктона, изменяется от 10,7 дней до 160 дней.
Скорость распада фитопланктона можно представить с помощью этого уравнения:
В этом уравнении G(t) представляет собой общее количество твердых частиц органического углерода (POC) в данный момент времени, t. G(0) — концентрация ПОУ до того, как произойдет пробой. k — константа скорости в году-1, а t — время в годах. Для большинства POC фитопланктона k составляет около 12,8 лет-1, или около 28 дней, в течение которых в этих системах расщепляется почти 96% углерода. В то время как для бескислородных систем разрушение POC занимает 125 дней, что более чем в четыре раза дольше. [15] Для расщепления 1 мг ПОУ в окружающей среде требуется примерно 1 мг кислорода, поэтому быстро возникает гипоксия, поскольку кислород быстро расходуется на переваривание ПОУ. Около 9% ПОУ в фитопланктоне может быть расщеплено за один день при температуре 18 °C. Следовательно, для полного расщепления фитопланктона требуется около одиннадцати дней. [16]
После расщепления ПОУ эти твердые частицы можно превратить в другой растворенный углерод, такой как диоксид углерода, ионы бикарбоната и карбонат. До 30% фитопланктона может быть расщеплено на растворенный углерод. Когда эти частицы органического углерода взаимодействуют с ультрафиолетовым светом длиной 350 нм, образуется растворенный неорганический углерод, удаляющий еще больше кислорода из окружающей среды в форме диоксида углерода, ионов бикарбоната и карбоната. Растворенный неорганический углерод вносится из расчета 2,3–6,5 мг/(м 3 ⋅сут). [17]
По мере распада фитопланктона в окружающую среду поступают свободный фосфор и азот, что также способствует возникновению гипоксических состояний. По мере распада этого фитопланктона большее количество фосфора превращается в фосфаты, а азота — в нитраты. Это еще больше истощает кислород в окружающей среде, создавая еще большие гипоксические зоны. По мере вытеснения в эти водные системы большего количества минералов, таких как фосфор и азот, рост фитопланктона значительно увеличивается, а после его гибели образуются гипоксические зоны. [18]
{{cite journal}}: CS1 maint: multiple names: authors list (link)