Метаболизм пуринов относится к метаболическим путям синтеза и расщепления пуринов , присутствующих во многих организмах.
Пурины биологически синтезируются как нуклеотиды и, в частности, как риботиды, т.е. основания, присоединенные к рибозо-5-фосфату . Как аденин , так и гуанин происходят от нуклеотидинозинмонофосфата ( ИМФ), который является первым соединением в пути, имеющим полностью сформированную пуриновую кольцевую систему.
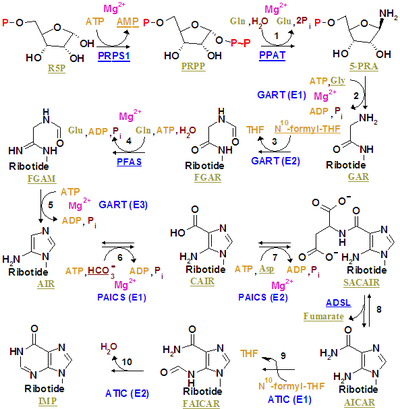
Инозинмонофосфат синтезируется на уже существующем рибозофосфате через сложный путь (как показано на рисунке справа). Источник атомов углерода и азота пуринового кольца, 5 и 4 соответственно, поступает из нескольких источников. Аминокислота глицин вносит все свои атомы углерода (2) и азота (1), с дополнительными атомами азота от глутамина (2) и аспарагиновой кислоты (1), и дополнительными атомами углерода от формильных групп (2), которые переносятся из кофермента тетрагидрофолата в виде 10-формилтетрагидрофолата , и атома углерода от бикарбоната (1). Формильные группы образуют углерод-2 и углерод-8 в системе пуринового кольца, которые действуют как мостики между двумя атомами азота.
Ключевым регуляторным шагом является производство 5-фосфо-α- D -рибозил-1-пирофосфата ( PRPP ) рибозофосфатпирофосфокиназой, которая активируется неорганическим фосфатом и инактивируется пуриновыми рибонуклеотидами. Это не обязательный шаг к синтезу пурина, поскольку PRPP также используется в синтезе пиримидина и путях утилизации.
Первым обязательным этапом является реакция PRPP, глутамина и воды с образованием 5'-фосфорибозиламина (PRA), глутамата и пирофосфата , катализируемая амидофосфорибозилтрансферазой , которая активируется PRPP и ингибируется AMP , GMP и IMP .
На втором этапе происходит реакция PRA , глицина и АТФ с образованием GAR , ADP и пирофосфата, катализируемая фосфорибозиламин-глицинлигазой (GAR-синтетазой). Из-за химической лабильности PRA, период полураспада которой составляет 38 секунд при pH 7,5 и 37 °C, исследователи предположили, что соединение передается от амидофосфорибозилтрансферазы к GAR-синтетазе in vivo. [1]
Третий катализируется фосфорибозилглицинамидформилтрансферазой .
Четвертый катализируется фосфорибозилформилглицинамидинсинтазой .
Пятый катализируется синтетазой AIR (циклазой FGAM) .
Шестой катализируется фосфорибозиламиноимидазолкарбоксилазой .
Седьмой катализируется фосфорибозиламиноимидазолсукцинокарбоксамидсинтазой .
Восьмерка катализируется аденилосукцинатлиазой .
Продукты AICAR и фумарат переходят на два разных пути. AICAR служит реагентом для девятого шага, в то время как фумарат транспортируется в цикл лимонной кислоты, который затем может пропустить этапы выделения диоксида углерода, чтобы произвести малат. Превращение фумарата в малат катализируется фумаразой. Таким образом, фумарат связывает синтез пурина с циклом лимонной кислоты. [2]
Девятый катализируется фосфорибозиламиноимидазолкарбоксамидформилтрансферазой .
Последний этап катализируется инозинмонофосфатсинтазой .
У эукариот второй, третий и пятый этапы катализируются трифункциональным пуриновым биосинтетическим белком аденозином-3 , который кодируется геном GART.
Девятый и десятый этапы выполняются одним белком, называемым бифункциональным белком биосинтеза пуринов PURH, кодируемым геном ATIC.
Пурины метаболизируются несколькими ферментами :
Образование 5'-фосфорибозиламина из глутамина и PRPP, катализируемое PRPP-аминотрансферазой, является точкой регуляции для синтеза пурина. Фермент является аллостерическим ферментом, поэтому он может быть преобразован из IMP, GMP и AMP в высокой концентрации, связывается с ферментом, чтобы оказывать ингибирование, в то время как PRPP в большом количестве связывается с ферментом, который вызывает активацию. Таким образом, IMP, GMP и AMP являются ингибиторами, в то время как PRPP является активатором. Между образованием 5'-фосфорибозила, аминоимидазола и IMP нет известного этапа регуляции.
Пурины, образующиеся в результате обмена клеточных нуклеиновых кислот (или из пищи), также могут быть восстановлены и повторно использованы в новых нуклеотидах.
Когда дефектный ген вызывает пробелы в процессе метаболической переработки пуринов и пиримидинов, эти химические вещества не метаболизируются должным образом, и взрослые или дети могут страдать от любого из двадцати восьми наследственных заболеваний, возможно, еще от нескольких, пока неизвестных. Симптомы могут включать подагру , анемию, эпилепсию, задержку развития, глухоту, компульсивное самокусывание, почечную недостаточность или камни или потерю иммунитета.
Метаболизм пуринов может иметь дисбаланс, который может возникнуть из-за вредных нуклеотидтрифосфатов, включающихся в ДНК и РНК, что в дальнейшем приводит к генетическим нарушениям и мутациям, и в результате вызывает несколько типов заболеваний. Вот некоторые из заболеваний:
Модуляция метаболизма пуринов имеет фармакотерапевтическое значение.
Ингибиторы синтеза пуринов подавляют пролиферацию клеток, особенно лейкоцитов . К этим ингибиторам относится азатиоприн , иммунодепрессант, используемый при трансплантации органов , аутоиммунных заболеваниях, таких как ревматоидный артрит , или воспалительных заболеваниях кишечника, таких как болезнь Крона и язвенный колит .
Микофенолата мофетил — иммунодепрессант, используемый для предотвращения отторжения при трансплантации органов; он подавляет синтез пуринов, блокируя инозинмонофосфатдегидрогеназу (ИМФДГ). [5] Метотрексат также косвенно подавляет синтез пуринов, блокируя метаболизм фолиевой кислоты (он является ингибитором дигидрофолатредуктазы ) .
Аллопуринол — это препарат, который ингибирует фермент ксантиноксидоредуктазу и, таким образом, снижает уровень мочевой кислоты в организме. Это может быть полезно при лечении подагры, заболевания, вызванного избытком мочевой кислоты, образующей кристаллы в суставах.
Чтобы понять, как возникла жизнь , необходимо знание химических путей, которые позволяют формировать ключевые строительные блоки жизни в вероятных пребиотических условиях . Нам и др. [6] продемонстрировали прямую конденсацию пуриновых и пиримидиновых нуклеиновых оснований с рибозой, чтобы получить рибонуклеозиды в водных микрокаплях, ключевой шаг, ведущий к образованию РНК. Кроме того, вероятный пребиотический процесс синтеза пуриновых рибонуклеозидов был представлен Беккером и др. [7] .
Организмы во всех трех доменах жизни, эукариоты , бактерии и археи , способны осуществлять биосинтез пуринов de novo . Эта способность отражает важность пуринов для жизни. Биохимический путь синтеза очень похож у эукариот и видов бактерий, но более изменчив среди видов архей. [8] Было установлено, что почти полный или полный набор генов, необходимых для биосинтеза пуринов, присутствует у 58 из 65 изученных видов архей. [8] Однако также были идентифицированы семь видов архей с полностью или почти полностью отсутствующими генами, кодирующими пурины. По-видимому, виды архей, неспособные синтезировать пурины, способны приобретать экзогенные пурины для роста., [8] и, таким образом, похожи на пуриновых мутантов эукариот, например, пуриновых мутантов гриба-аскомицета Neurospora crassa , [9] , которым также требуются экзогенные пурины для роста.