Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 года — это версия Номенклатуры неорганической химии 2005 года (которая неофициально называется Красной книгой ). Это сборник правил наименования неорганических соединений, рекомендованных Международным союзом теоретической и прикладной химии (IUPAC).
Издание 2005 года заменяет их предыдущие рекомендации : Номенклатуру Красной книги неорганической химии, Рекомендации ИЮПАК 1990 года (Красная книга I) и «где это уместно» (так в оригинале) Номенклатуру неорганической химии II, Рекомендации ИЮПАК 2000 года (Красная книга II) .
Рекомендации занимают более 300 страниц [1] , а полный текст можно скачать на сайте IUPAC. [2] Внесены исправления. [3]
Помимо реорганизации содержания, появился новый раздел, посвященный металлоорганическим соединениям, и формальный список элементов, который будет использоваться вместо списков электроотрицательности при упорядочении элементов в формулах и названиях. Концепция предпочтительного названия ИЮПАК (ПИН), являющаяся частью пересмотренной синей книги по наименованию органических соединений, еще не принята для неорганических соединений. Однако существуют рекомендации относительно того, какой метод именования следует использовать.
В рекомендациях описывается ряд различных способов обозначения соединений. Это:
Кроме того, имеются рекомендации по следующим вопросам:
Для простого соединения, такого как AlCl 3, различные соглашения об именах дают следующее:
Во всех рекомендациях использование электроотрицательности элементов для секвенирования было заменено формальным списком, который в общих чертах основан на электроотрицательности. В рекомендациях по-прежнему используются термины электроположительный и электроотрицательный для обозначения относительного положения элемента в этом списке.
Простое практическое правило игнорирования лантаноидов и актинидов таково:
Полный список, от самой высокой до самой низкой «электроотрицательности» (с добавлением элементов со 112 по 118, которые еще не были названы в 2005 году, к соответствующим группам):
Примечание. «Рассматривать отдельно» означает использование таблицы решений для каждого компонента.
Неопределенный образец просто берет имя элемента. Например, образец углерода (который может быть алмазом, графитом и т. д. или их смесью) будет называться углеродом.
Это указывается символом элемента, за которым следует символ Пирсона для кристаллической формы. (Обратите внимание, что в рекомендациях второй символ выделен курсивом.)
Примеры включают P n ,. красный фосфор; В качестве n аморфный мышьяк.
Композиционные названия несут мало структурной информации и рекомендуются к использованию, когда структурная информация недоступна или не требует передачи. Стехиометрические названия самые простые и отражают либо эмпирическую формулу, либо молекулярную формулу. Порядок элементов соответствует формальному списку электроотрицательностей для бинарных соединений и списку электроотрицательностей, в котором элементы группируются в два класса, которые затем располагаются в алфавитном порядке. Пропорции указываются ди-, три- и т. д. (См. числовой множитель ИЮПАК .) Если известно, что существуют сложные катионы или анионы, они называются самостоятельно, а затем эти названия используются как часть названия соединения.
В бинарных соединениях первым в формуле стоит более электроположительный элемент. Используется формальный список. Название наиболее электроотрицательного элемента изменено и теперь заканчивается на -ide, а название более электроположительного элемента остается неизменным.
Возьмем бинарное соединение натрия и хлора: хлор находится первым в списке, поэтому в названии идет последним. Другими примерами являются
Нижеследующее иллюстрирует принципы.
Четвертичное соединение брома, хлора, йода и фосфора в соотношении 1:1:1:1:
Тройное соединение сурьмы, меди и калия в соотношении 2:1:5 можно назвать двумя способами в зависимости от того, какой элемент (ы) обозначен как электроотрицательный.
Одноатомные катионы называются путем названия элемента и последующего заряда в скобках, например
Иногда необходимо использовать сокращенную форму названия элемента, например, гермид вместо германия, поскольку германид относится к GeH.−
3.
Многоатомные катионы одного и того же элемента называются по названию элемента, которому предшествуют ди-, три- и т. д. , например:
Многоатомные катионы, состоящие из разных элементов, называются замещающе или аддитивно, например:
Одноатомные анионы называются как элемент, модифицированный окончанием -ide. Плата указывается в скобках (необязательно для 1-), например:
Некоторые элементы имеют в качестве корня свое латинское название, например
Многоатомные анионы одного и того же элемента называются по названию элемента, которому предшествуют ди-, три- и т. д. , например:
или иногда в качестве альтернативы, полученной из замещающего имени, например
Многоатомные анионы, состоящие из разных элементов, называются либо замещающе, либо аддитивно, окончания названий -ide и -ate соответственно, например:
Полный список альтернативных допустимых несистематических названий катионов и анионов приведен в рекомендациях. Многие анионы имеют названия, полученные от неорганических кислот, и о них речь пойдет позже.
Наличие неспаренных электронов может обозначаться знаком « · ». Например:
Использование термина «гидрат» по-прежнему приемлемо, например, Na 2 SO 4 ·10H 2 O, декагидрат сульфата натрия. Рекомендуемый метод — назвать его сульфатом натрия — вода (1/10). Аналогичным образом, другими примерами решетчатых соединений являются:
В качестве альтернативы префиксам ди- и три- можно использовать либо заряд, либо степень окисления. Рекомендуется зарядить, поскольку степень окисления может быть неоднозначной и открытой для дискуссий.
Этот метод наименования обычно соответствует установленной органической номенклатуре ИЮПАК. Гидридам элементов основной группы (группы 13–17) присвоены названия -ановых оснований, например боран, BH 3 . Приемлемые альтернативные названия для некоторых исходных гидридов — вода, а не оксидан, и аммиак, а не азан. В этих случаях основное название предназначено для использования для замещенных производных.
В этом разделе рекомендаций рассмотрены названия соединений, содержащих кольца и цепи.
Если соединение имеет нестандартную связь по сравнению с исходным гидридом, например PCl 5 , используется лямбда-условие. Например:
К названию родительского гидрида добавляется приставка ди-, три- и т.д. Примеры:
В рекомендациях описаны три способа присвоения «родительских» названий гомоядерным моноциклическим гидридам (т.е. одиночным кольцам, состоящим из одного элемента):
За стехиометрическим названием следует количество атомов водорода в скобках. Например, B 2 H 6 , диборан(6). Дополнительную структурную информацию можно передать, добавив к «структурному дескриптору» приставки клозо- , нидо- , арахно- , гифо- , кладо- .
Существует полностью систематический метод нумерации атомов в кластерах гидрида бора и метод описания положения мостиковых атомов водорода с помощью символа μ.
Использование замещающей номенклатуры рекомендуется для металлоорганических соединений групп 13–16 основной группы. Примеры:
Для металлоорганических соединений 1–2 групп можно использовать аддитивные (с указанием молекулярного агрегата) или композиционные наименования. Примеры:
Однако в рекомендации отмечается, что будущие номенклатурные проекты будут рассматривать эти соединения.
Это наименование было разработано в основном для координационных соединений, хотя оно может применяться и более широко. Примеры:
Рекомендации включают блок-схему, которую можно кратко резюмировать:
Если имя аниона заканчивается на -ide, то его имя в качестве лиганда меняется на -o. Например, хлорид-анион Cl − становится хлоридом. В этом отличие от наименований органических соединений и наименований-заместителей, где хлор рассматривается как нейтральный и становится хлором, как в PCl 3 , который может быть назван либо замещающе, либо аддитивно, как трихлорфосфан или трихлорофосфор соответственно.
Аналогично, если названия анионов оканчиваются на -ite, -ate, то имена лигандов будут -ito, -ato.
Нейтральные лиганды не меняют названия, за исключением следующих:
Лиганды упорядочены по имени в алфавитном порядке и предшествуют названию центрального атома. Число координирующих лигандов обозначается приставками ди-, три-, тетра-пента- и т. д. для простых лигандов или бис-, трис-, тетракис- и т. д. для сложных лигандов. Например:
Если есть разные центральные атомы, они упорядочены с использованием списка электроотрицательности.
Лиганды могут соединять два или более центров. Префикс μ используется для указания мостикового лиганда как в формуле, так и в названии. Например, димерная форма трихлорида алюминия :
Этот пример иллюстрирует расположение мостиковых и немостиковых лигандов одного и того же типа. В формуле мостиковые лиганды следуют за немостиковыми лигандами, тогда как в названии мостиковые лиганды предшествуют немостиковым. Обратите внимание на использование каппа-соглашения, чтобы указать, что в каждом алюминии есть два концевых хлорида.
Если имеется более двух центров, соединенных мостом, в качестве нижнего индекса добавляется индекс моста. Например, в основном ацетате бериллия , который можно представить как тетраэдрическое расположение атомов Be, связанных 6 ацетатными ионами, образующими клетку с центральным оксидным анионом, формула и название следующие:
μ 4 описывает мостиковое соединение центрального оксидного иона. (Обратите внимание на использование каппа-соглашения для описания образования мостиков ацетат-иона, в котором участвуют оба атома кислорода.) В названии, где лиганд участвует в различных способах образования мостиков, множественные мостиковые соединения перечислены в порядке убывания сложности, например Перемычка μ 3 перед перемычкой μ 2 .
Соглашение каппа используется для определения того, какие атомы лиганда связаны с центральным атомом, а в полиядерных соединениях какие атомы, как мостиковые, так и несвязанные, связаны с каким центральным атомом. Для монодентатных лигандов нет однозначности относительно того, какой атом образует связь с центральным атомом. Однако, когда лиганд имеет более одного атома, который может связываться с центральным атомом, используется соглашение каппа, чтобы указать, какие атомы в лиганде образуют связь. Атомный символ элемента выделен курсивом и ему предшествует каппа, κ. Эти символы размещаются после части названия лиганда, обозначающей кольцо, цепь и т. д., где расположен лиганд. Например:
Если существует более одной связи, образованной из лиганда определенным элементом, числовой верхний индекс дает счет. Например:
В полиядерных комплексах использование символа каппа расширяется двумя взаимосвязанными способами. Во-первых, чтобы указать, какие лигирующие атомы с каким центральным атомом связываются, и, во-вторых, для мостикового лиганда указать, какие центральные атомы участвуют. Центральные атомы необходимо идентифицировать, т.е. присвоив им номера. (Формально это предусмотрено в рекомендациях). Чтобы указать, какие лигирующие атомы в лиганде связаны с каким центральным атомом, номера центральных атомов предшествуют символу каппа, а числовой верхний индекс указывает количество лигандов, за которым следует атомный символ. Несколько вхождений разделяются запятыми.
Примеры:
Систематизировано использование η для обозначения тактильности. Использование η 1 не рекомендуется. Если спецификация задействованных атомов неоднозначна, необходимо указать положение атомов. Это иллюстрируется примерами:
Для любого координационного числа выше 2 возможно более одной координационной геометрии. Например, четырехкоординатные координационные соединения могут иметь форму тетраэдра, плоского квадрата, квадратной пирамиды или формы качелей. Символ многогранника используется для описания геометрии. Индекс конфигурации определяется по положению лигандов и вместе с символом многогранника ставится в начале названия. Например, в комплексе ( SP -4-3)-(ацетонитрил)дихлоро(пиридин)платина(II) ( SP -4-3) в начале названия описывает квадратную плоскую геометрию, координата 4 с индексом конфигурации из 3, что указывает на положение лигандов вокруг центрального атома. Подробнее см. символ многогранника .
Номенклатура добавок обычно рекомендуется для металлоорганических соединений групп 3–12 (переходные металлы и цинк, кадмий и ртуть).
Вслед за ферроценом — первым сэндвич-соединением с центральным атомом железа, координированным с двумя параллельными циклопентадиенильными кольцами, — широко используются названия соединений со схожей структурой, таких как осмоцен и ванадоцен. Рекомендуется, чтобы окончание названия оцена ограничивалось соединениями, в которых имеются дискретные молекулы бис(η 5 -циклопентадиенил)металла (и замещенные в кольце аналоги), где циклопентадиенильные кольца по существу параллельны, а металл находится в д-блок. Данная терминология НЕ применима к соединениям элементов s- или p-блока, таким как Ba(C 5 H 5 ) 2 или Sn(C 5 H 5 ) 2 .
Примерами соединений, соответствующих критериям, являются:
Примерами соединений, которые не следует называть металлоценами, являются:
В полиядерных соединениях со связями металл-металл они отображаются после названия элемента следующим образом: (3 Os — Os ) в декакарбонилдигидридотриосмии . Пара скобок содержит количество образовавшихся связей (если оно больше 1), за которым следуют выделенные курсивом атомные символы элементов, разделенные «длинным тире».
Геометрия полиядерных кластеров может различаться по сложности. Можно использовать дескриптор, например, тетраэдро, или дескриптор CEP, например, Td -(13)-Δ 4 - клозо . это определяется сложностью кластера. Ниже приведены некоторые примеры дескрипторов и эквивалентов CEP. (Дескрипторы CEP названы в честь Кейси, Эванса и Пауэлла, описавших систему. [4]
Примеры:
декакарбонилдимарганец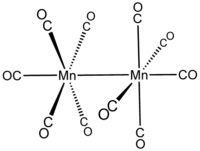 бис(пентакарбонилмарганец)( Mn — Mn )
бис(пентакарбонилмарганец)( Mn — Mn )
додекакарбонилтетрародий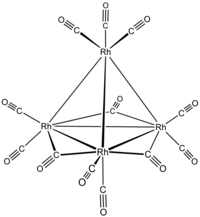 три- мк -
карбонил-1:2к2С ; 1 :3к2С ; 2 :3к2С - нонакарбонил -1к2С , 2к2С , 3к2С , 4к3С - [ Т d - (13 ) - Δ 4 - клозо ]-тетрародий(6 Rh - Rh )
или три-μ-карбонил-1:2к 2 С ;1:3к 2 С ;2:3к 2 С -нонакарбонил- 1к 2 С ,2к 2 С ,3к 2 C ,4κ 3 C -тетраэдро-тетрародий(6 Rh - Rh )
три- мк -
карбонил-1:2к2С ; 1 :3к2С ; 2 :3к2С - нонакарбонил -1к2С , 2к2С , 3к2С , 4к3С - [ Т d - (13 ) - Δ 4 - клозо ]-тетрародий(6 Rh - Rh )
или три-μ-карбонил-1:2к 2 С ;1:3к 2 С ;2:3к 2 С -нонакарбонил- 1к 2 С ,2к 2 С ,3к 2 C ,4κ 3 C -тетраэдро-тетрародий(6 Rh - Rh )
Рекомендации включают описание водородных названий кислот. Следующие примеры иллюстрируют этот метод:
Обратите внимание, что в отличие от композиционного метода наименования (сероводород), поскольку при наименовании водорода НЕТ пробела между электроположительными и электроотрицательными компонентами.
Этот метод не дает структурной информации о положении гидронов (атомов водорода). Если эта информация должна быть передана, следует использовать название добавки (примеры см. в списке ниже).
В рекомендациях приведен полный список допустимых названий обычных кислот и родственных им анионов. Выбор из этого списка показан ниже.
Стехиометрические фазы получили названия по составу. Нестехиометрические фазы более сложны. По возможности следует использовать формулы, но при необходимости можно использовать следующие названия:
Обычно названия минералов не следует использовать для указания химического состава. Однако название минерала можно использовать для указания типа структуры в формуле, например
Простые обозначения могут использоваться там, где мало информации о механизме изменчивости либо доступно, либо не требуется передавать:
Там, где существует непрерывный диапазон состава, это можно записать, например, K(Br,Cl) для смеси KBr и KCl и (Li 2 ,Mg)Cl 2 для смеси LiCl и MgCl 2 . Рекомендуется использовать следующий обобщенный метод, например
Обратите внимание, что катионные вакансии в CoO могут быть описаны как CoO 1−x
Точечные дефекты, симметрия и заселенность узлов могут быть описаны с использованием нотации Крегера-Винка , обратите внимание, что ИЮПАК предпочитает, чтобы вакансии определялись как V , а не V (элемент ванадий).
Чтобы указать кристаллическую форму соединения или элемента, можно использовать символ Пирсона . Использование Strukturbericht (например, A1 и т. д.) или греческих букв недопустимо. За символом Пирсона может следовать пространственная группа и формула-прототип. Примеры:
Рекомендуется идентифицировать полиморфы (например, для ZnS , где они образуют цинковую обманку (кубическую) и вюрцит (гексагональную)), как ZnS( c ) и ZnS( h ) соответственно.