Плавиковая кислота — это раствор фтористого водорода (HF) в воде . Растворы HF бесцветны, кислы и очень едки . Обычная концентрация составляет 49% (48-52%), но есть и более сильные растворы (например, 70%), а чистая HF имеет температуру кипения, близкую к комнатной температуре. Она используется для изготовления большинства фторсодержащих соединений; примерами служат широко используемый фармацевтический антидепрессант флуоксетин (Прозак) и материал ПТФЭ (тефлон). Из нее получают элементарный фтор . Он обычно используется для травления стекла и кремниевых пластин.
Основное применение плавиковой кислоты — в химии фторорганических соединений . Многие фторорганические соединения готовятся с использованием HF в качестве источника фтора, включая тефлон , фторполимеры , фторуглероды и хладагенты , такие как фреон . Многие фармацевтические препараты содержат фтор. [4]
Большинство неорганических фторидных соединений большого объема получают из плавиковой кислоты. Прежде всего, это Na 3 AlF 6 , криолит и AlF 3 , трифторид алюминия . Расплавленная смесь этих твердых веществ служит высокотемпературным растворителем для производства металлического алюминия . Другие неорганические фториды, полученные из плавиковой кислоты, включают фторид натрия и гексафторид урана . [4]
_0468.jpg/440px-Wet_etching_tanks_at_LAAS_(6_inches)_0468.jpg)
Он используется в полупроводниковой промышленности как основной компонент травления Райта и буферизованного оксидного травления , которые используются для очистки кремниевых пластин . Аналогичным образом он также используется для травления стекла путем обработки диоксидом кремния для образования газообразных или водорастворимых фторидов кремния. Его также можно использовать для полировки и матирования стекла. [5]
Гель плавиковой кислоты с концентрацией от 5% до 9% также обычно используется для травления всех керамических зубных реставраций для улучшения сцепления. [6] По аналогичным причинам разбавленная плавиковая кислота является компонентом бытового средства для удаления ржавчины, в автомойках в составах «очистителей колес», в ингибиторах ржавчины для керамики и тканей и в средствах для удаления пятен от воды. [5] [7] Благодаря своей способности растворять оксиды железа, а также загрязняющие вещества на основе кремния плавиковая кислота используется в предпусковых котлах, которые производят пар высокого давления. Плавиковая кислота также полезна для растворения образцов горных пород (обычно порошкообразных) перед анализом. Аналогичным образом эта кислота используется в кислотных мацерациях для извлечения органических ископаемых из силикатных пород. Ископаемая порода может быть погружена непосредственно в кислоту, или может быть нанесена пленка нитрата целлюлозы (растворенная в амилацетате ), которая прилипает к органическому компоненту и позволяет породе растворяться вокруг нее. [8]
В стандартном процессе нефтепереработки , известном как алкилирование , изобутан алкилируется низкомолекулярными алкенами (в основном смесью пропилена и бутилена ) в присутствии кислотного катализатора, полученного из плавиковой кислоты. Катализатор протонирует алкены (пропилен, бутилен) для получения реакционноспособных карбокатионов , которые алкилируют изобутан. Реакция проводится при умеренных температурах (0 и 30 °C) в двухфазной реакции.
Плавиковая кислота была впервые получена в 1771 году Карлом Вильгельмом Шееле . [9] В настоящее время ее в основном получают путем обработки минерала флюорита CaF 2 концентрированной серной кислотой при температуре около 265 °C.
Кислота также является побочным продуктом производства фосфорной кислоты из апатита и фторапатита . Вываривание минерала серной кислотой при повышенных температурах высвобождает смесь газов, включая фтористый водород, который может быть восстановлен. [4]
Из-за своей высокой реакционной способности по отношению к стеклу плавиковую кислоту хранят в контейнерах из фторированного пластика (часто из ПТФЭ ). [4] [5]
В разбавленном водном растворе фтористый водород ведет себя как слабая кислота, [10] Инфракрасная спектроскопия использовалась для того, чтобы показать, что в растворе диссоциация сопровождается образованием ионной пары H 3 O + ·F − . [11] [12]
Эта ионная пара была охарактеризована в кристаллическом состоянии при очень низкой температуре. [13] Дальнейшая ассоциация была охарактеризована как в растворе, так и в твердом состоянии. [ необходима цитата ]
Предполагается, что полимеризация происходит с ростом концентрации. Это предположение подтверждается выделением соли тетрамерного аниона H
3Ф−
4[14] и методом низкотемпературной рентгеновской кристаллографии. [13] Не все виды, присутствующие в концентрированных водных растворах фтористого водорода, были охарактеризованы; в дополнение к HF−
2который известен [11] образованием других полимерных видов, H
н −1Ф−
н, весьма вероятно.
Функция кислотности Гаммета , H 0 , для 100% HF впервые была указана как -10,2, [15], тогда как более поздние компиляции показывают -11, что сопоставимо со значениями около -12 для чистой серной кислоты . [16] [17]
В отличие от других галогенводородных кислот , таких как соляная кислота , фтористый водород является слабой кислотой только в разбавленном водном растворе. [18] Это отчасти является результатом прочности связи водород-фтор, но также и других факторов, таких как тенденция HF, H
2О и Ф−
анионы, образуя кластеры. [19] При высоких концентрациях молекулы HF подвергаются гомоассоциации , образуя многоатомные ионы (такие как бифторид , HF−
2) и протонов , таким образом значительно увеличивая кислотность. [20] Это приводит к протонированию очень сильных кислот, таких как соляная, серная или азотная кислоты, при использовании концентрированных растворов плавиковой кислоты. [21] Хотя плавиковая кислота считается слабой кислотой, она очень едкая, даже разъедающая стекло при гидратации. [20]
Разбавленные растворы слабокислые с константой кислотной ионизации K a =6,6 × 10−4 (или p K a = 3,18 ), [10] в отличие от соответствующих растворов других галогеноводородов, которые являются сильными кислотами ( p K a < 0 ). Однако концентрированные растворы фтороводорода являются гораздо более кислотными, чем подразумевает это значение, как показывают измерения функции кислотности Гаммета H 0 (или «эффективного pH»). Во время самоионизации 100% жидкого HF значение H 0 было впервые измерено как −10,2 [15] и позднее скомпилировано как −11, что сопоставимо со значениями около −12 для серной кислоты . [16] [17]
С точки зрения термодинамики растворы HF являются крайне неидеальными , при этом активность HF увеличивается гораздо быстрее, чем его концентрация. Слабая кислотность в разбавленном растворе иногда объясняется высокой прочностью связи H—F , которая в сочетании с высокой энтальпией растворения HF перевешивает более отрицательную энтальпию гидратации фторид-иона. [22] Поль Жигер и Сильвия Таррелл [11] [12] показали с помощью инфракрасной спектроскопии , что преобладающим видом растворенного вещества в разбавленном растворе является пара ионов, связанных водородом, H 3 O + ·F − . [23]
С увеличением концентрации HF концентрация иона дифторида водорода также увеличивается. [11] Реакция
является примером гомоконъюгации .
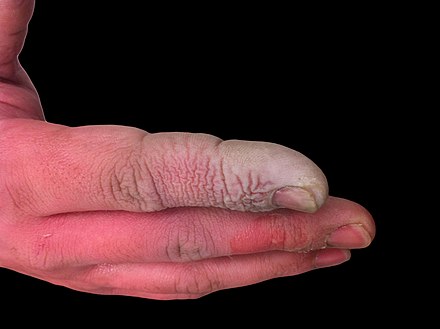
Помимо того, что плавиковая кислота является очень едкой жидкостью, она также является мощным контактным ядом . Поскольку она может проникать в ткани, отравление может легко произойти через воздействие на кожу или глаза, вдыхание или проглатывание . Симптомы воздействия плавиковой кислоты могут не проявиться сразу, и это может дать ложное успокоение жертвам, заставляя их откладывать медицинское лечение. [24] Несмотря на раздражающие пары, HF может достигать опасных уровней без явного запаха. [5] Она нарушает функцию нервов, что означает, что ожоги изначально могут быть не болезненными. Случайные воздействия могут остаться незамеченными, задерживая лечение и увеличивая степень и серьезность травмы. [24] Симптомы воздействия HF включают раздражение глаз, кожи, носа и горла, ожоги глаз и кожи, ринит , бронхит , отек легких (накопление жидкости в легких) и повреждение костей [25] из-за того, что HF сильно взаимодействует с кальцием в костях. [26] В концентрированной форме HF может вызывать серьезное разрушение тканей из-за повреждений и повреждения слизистых оболочек, но разбавленная HF все еще опасна из-за ее высокого липидного сродства, что приводит к клеточной гибели нервов, кровеносных сосудов, сухожилий, костей и других тканей. [27]
Ожоги фтористоводородной кислотой лечат гелем глюконата кальция .
молекула HF может вызывать глубокие повреждения тканей, включая разрушение костей. ... когда ионы фтора связываются с кальцием и магнием
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )