Фрустрированная пара Льюиса ( FLP ) представляет собой соединение или смесь, содержащую кислоту Льюиса и основание Льюиса , которые из-за стерических затруднений не могут объединиться с образованием классического аддукта . [1] Было изобретено множество видов FLP, и многие простые субстраты демонстрируют активацию. [2] [3]
Открытие того, что некоторые FLP расщепляют H 2 [4], вызвало быстрый рост исследований FLP. Из-за своей «неугасимой» реакционной способности такие системы реагируют на субстраты, которые могут подвергаться гетеролизу . Например, многие ФЛП расщепляют молекулы водорода . Так, смесь трициклогексилфосфина (PCy 3 ) и трис(пентафторфенил)борана реагирует с водородом с образованием соответствующих ионов фосфония и бората :
Эта реакционная способность была использована для производства FLP, которые катализируют реакции гидрирования . [5]
Было показано, что разочарованные пары Льюиса активируют многие небольшие молекулы либо путем индукции гетеролиза, либо путем координации.
Открытие того, что некоторые FLP способны расщеплять и, следовательно, активировать H 2 [4] , вызвало бурный рост исследований в этой области. Активация и, следовательно, использование H 2 важна для многих химических и биологических превращений. Использование FLP для высвобождения H 2 не содержит металлов, это выгодно из-за стоимости и ограниченности поставок некоторых переходных металлов, обычно используемых для активации H 2 (Ni, Pd, Pt). [6] Системы FLP реакционноспособны по отношению к субстратам, которые могут подвергаться гетеролизу (например, водороду) из-за «неугасимой» реакционной способности таких систем. Например, ранее было показано, что смесь трициклогексилфосфина (PCy 3 ) и трис(пентафторфенил)борана реагирует с H 2 с образованием соответствующих ионов фосфония и бората :
В этой реакции PCy 3 (основание Льюиса) и B(C 6 F 5 ) 3 (кислота Льюиса) не могут образовывать аддукт из-за стерических затруднений со стороны объемистых циклогексильных и пентафторфенильных групп. Протон фосфора и гидрид бората теперь «активируются» и впоследствии могут быть «доставлены» к органическому субстрату, что приводит к гидрированию .
Механизм активации H 2 с помощью FLP обсуждался как в межмолекулярном, так и в внутримолекулярном случаях. Межмолекулярные FLP - это когда основание Льюиса является отдельной молекулой по отношению к кислоте Льюиса. Считается, что эти отдельные молекулы взаимодействуют посредством вторичных дисперсионных взаимодействий Лондона, чтобы объединить основание Льюиса и кислоту (предорганизационный эффект), где затем могут взаимодействовать небольшие молекулы. с ФЛП. Экспериментальные доказательства такого типа взаимодействия на молекулярном уровне неясны. Однако существуют подтверждающие доказательства этого типа взаимодействия, основанные на исследованиях вычислительной теории функционала плотности . Внутримолекулярные FLP – это когда кислота Льюиса и основание Льюиса объединены в одну молекулу ковалентным линкером. Несмотря на улучшенные «предорганизационные эффекты», считается, что жесткие внутримолекулярные каркасы FLP обладают пониженной реакционной способностью по отношению к малым молекулам из-за снижения гибкости.
FLP также реактивны по отношению ко многим ненасыщенным субстратам, помимо H 2 . Некоторые FLP реагируют с CO 2 , в частности, при дезоксигенативном восстановлении CO 2 до метана. [7]
Этен также реагирует с ФЛП: [8]
Чтобы пары кислот-основных вели себя как нуклеофильно, так и электрофильно одновременно, предлагается метод раскрытия цикла циклических простых эфиров, таких как ТГФ, 2,5-дигидрофуран, кумаран и диоксан. [9]

Восстановление иминов , нитрилов и азиридинов до первичных и вторичных аминов традиционно осуществляют металлогидридными реагентами, например литийалюминийгидридом и цианоборгидридом натрия . Гидрирование этих ненасыщенных субстратов может осуществляться реакциями, катализируемыми металлами. Безметалловое каталитическое гидрирование проводили с использованием фосфонийборатного катализатора (R 2 PH)(C 6 F 4 )BH(C 6 F 5 ) 2 (R = 2,4,6-Me 3 C 6 H 2 ) 1 . Этот тип безметаллового гидрирования потенциально может заменить дорогостоящий металлический катализатор.
Предполагается, что механизм восстановления имина включает протонирование по азоту с образованием иминиевой соли. Основность азотистого центра определяет скорость реакции. Имины, богатые электронами, восстанавливаются более быстрыми темпами, чем имины, бедные электронами. Образовавшийся иминиевый центр подвергается нуклеофильной атаке борогидрид-аниона с образованием амина. Малые амины связываются с бораном, гася дальнейшие реакции. Эту проблему можно преодолеть различными методами: 1) Применением повышенных температур 2) Использованием стерически объемных иминных заместителей 3) Защитой имина группой B(C 6 F 5 ) 3 , которая также служит промотором кислоты Льюиса. [10]
Хиральная боронатная кислота Льюиса, полученная из (1 R )-( + )-камфоры, образует фрустрированную пару Льюиса с t Bu 3 P, которую можно выделить в виде соли. Этот ФЛП катализирует энантиоселективное гидрирование некоторых арилиминов с высоким выходом, но умеренным ее (до 83%).

Несмотря на концептуальный интерес, протокол страдает отсутствием общности. Установлено, что увеличение стерической массы иминных заместителей приводит к снижению выхода и э.э. аминного продукта. метоксизамещенные имины демонстрируют более высокий выход и ee 's. [10]
Разрушенные пары Льюиса хиральных алкенилборанов и фосфинов полезны для асимметричного гидросилилирования типа Пирса 1,2-дикарбонильных соединений и альфа-кетоэфиров, обеспечивая высокий выход и энантиоселективность. Однако по сравнению с традиционными гидросилилированиями типа Пирса асимметричные гидросилилирования типа Пирса не так хорошо развиты.
В следующем примере хиральный алкенилборан образуется in situ из хирального диина и HB(C 6 F 5 ) 2 . Гетеролитический разрыв связи Si-H от PhMe 2 SiH катализатором ФЛП образует ионный комплекс силилия и гидридобората. [11]
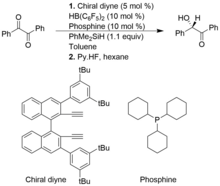
Безметалловое гидрирование неактивированных внутренних алкинов до цис- алкенов легко достигается с использованием катализаторов на основе FLP. [12] Условия этой реакции были относительно мягкими при использовании H 2 при давлении 2 бара . С точки зрения механизма, алкиновый материал сначала гидроборируется , а затем полученный FLP на основе винилборана может затем активировать дигидроген. На стадии протодеборилирования высвобождается цис -алкеновый продукт, полученный в результате процесса син -гидроборилирования, и происходит регенерация катализатора. Катализаторы на основе ФЛП, хотя и активны в гидрировании алкинов, однако не способствуют гидрированию алкенов в алканы.
Реакция представляет собой син-гидроборирование, в результате чего наблюдается высокая цис-селективность. На заключительной стадии каталитического цикла группа C 6 F 5 отщепляется легче, чем алкильная группа, вызывая деградацию катализатора, а не высвобождение алкана. Каталитический цикл состоит из трех стадий:
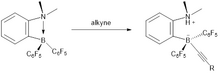
С внутренними алкинами происходит конкурентная реакция, при которой протон, связанный с азотом, может присоединяться к фторбензолам. Следовательно, это присоединение происходит не так сильно, образование алкена кажется благоприятным.
Но терминальные алкины связываются с бором не посредством гидроборирования, а скорее посредством активации CH. Таким образом, присоединение протона к алкину приведет к образованию исходного терминального алкина. Следовательно, этот процесс гидрирования не подходит для концевых алкинов и дает только пентафторбензол.
Недавно было достигнуто безметалловое гидрирование концевых алкинов до соответствующих алкенов с использованием системы на основе пиридона борана. [13] Эта система легко активирует водород при комнатной температуре, образуя пиридон-борановый комплекс. [14] Диссоциация этого комплекса позволяет гидроборировать алкин свободным бораном. При протодеборилировании свободным пиридоном образуется цис -алкен. В этой системе возможно гидрирование концевых алкинов, поскольку активация CH обратима и конкурирует с активацией водорода.
Амин-борановые ФЛП катализируют борилирование богатых электронами ароматических гетероциклов (схема 1). [15] Реакция осуществляется за счет высвобождения водорода посредством активации CH с помощью FLP. Ароматические борилирования часто используются в фармацевтических разработках, особенно из-за обилия, низкой стоимости и низкой токсичности соединений бора по сравнению с благородными металлами.

К субстрату реакции предъявляются два основных требования, тесно связанных с механизмом борилирования. Во-первых, субстрат должен быть богат электронами, примером чего является отсутствие реакции с тиофеном, тогда как его более богатые электронами производные - метокситиофен и 3,4-этилендиокситиофен - могут вступать в реакцию с аминобораном. Кроме того, замещение 1-метилпиррола (который может реагировать) сильно электроноакцепторной трет-бутилоксикарбонильной группой (Boc) в положении 2 полностью ингибирует реакцию. Второе требование заключается в отсутствии в субстрате основных аминогрупп, которые в противном случае образовали бы нежелательный аддукт. Это можно проиллюстрировать отсутствием реакции с пирролом, тогда как как 1-метил-, так и N-бензилпиррольные производные способны вступать в реакцию.
Дальнейшая работа тех же авторов показала, что просто пиперидин в качестве группы амина R (в отличие от тетраметилпиперидина, изображенного выше) ускоряет скорость реакции. С помощью кинетических исследований и методов DFT авторы предположили, что стадия активации CH была более легкой, чем с более крупными заместителями. [16]
Деароматизация также может быть достигнута в аналогичных условиях, но с использованием N-тозил-индолов. Получены син -гирдоборилированные индолины. [17]
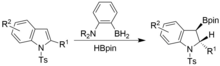
Также наблюдалось борилирование SH-связей в тиолах путем дегидрирования. Спирты и амины, такие как трет-бутанол и трет-бутиламин, образуют стабильные продукты, которые предотвращают катализ из-за сильной π-связи между неподеленной парой атома N/O и бором, тогда как то же самое нельзя сказать о тиолах, что позволяет успешно катализировать. . Кроме того, было достигнуто успешное борилирование связей Se-H. Во всех случаях образование газа H 2 является мощной движущей силой реакций. [18]
Химия ФЛП концептуально важна для улавливания углерода . [19] Для селективного захвата и выделения углекислого газа использовались как межмолекулярные (Схема 1), так и внутримолекулярные (Схема 2) ФЛП, состоящие из фосфина и борана. Когда раствор FLP был покрыт атмосферой CO 2 при комнатной температуре, соединение FLP-CO 2 немедленно выпадало в осадок в виде белого твердого вещества. [19] [20]
Нагревание межмолекулярного соединения FLP-CO 2 в бромбензоле при 80°C в вакууме в течение 5 часов вызывало высвобождение примерно половины CO 2 и регенерацию двух составляющих компонентов FLP. После еще нескольких часов пребывания при комнатной температуре в вакууме произошло полное выделение CO 2 и регенерация FLP. [19]

Внутримолекулярное соединение FLP-CO 2 , напротив, было стабильным в виде твердого вещества при комнатной температуре, но полностью разлагалось при температуре выше -20°C в виде раствора в дихлорметане, выделяя CO 2 и регенерируя молекулу FLP. [19]
Этот метод улавливания углерода FLP можно адаптировать для работы в системах проточной химии. [21]
Разрушенные радикальные пары (FRP) могут возникнуть в результате переноса одного электрона между основанием Льюиса и кислотой Льюиса (иногда после фотоактивации). Их можно изучить с помощью ЭПР-спектроскопии .
FRP были предложены в качестве промежуточных продуктов некоторых реакций FLP, таких как активация дигидрогена. Такие механизмы позже были отвергнуты, поскольку концентрация фрустрированных радикальных пар из-за спонтанного одноэлектронного переноса между FLP незначительна, что можно вывести из окислительного потенциала основания Льюиса и потенциала восстановления кислоты Льюиса.
Разрушенные радикальные пары могут иметь синтетическое применение при гомолитической активации химических связей, например, при функционализации связи CH. [22]