Реакция циклизации Назарова (часто называемая просто циклизацией Назарова ) — химическая реакция , используемая в органической химии для синтеза циклопентенонов . Реакцию обычно делят на классические и современные варианты в зависимости от используемых реагентов и субстратов . Первоначально она была открыта Иваном Николаевичем Назаровым (1906–1957) в 1941 году при изучении перегруппировок аллилвинилкетонов. [1]

Как первоначально было описано, циклизация Назарова включает активацию дивинилкетона с использованием стехиометрической кислоты Льюиса или промотора протонной кислоты . Ключевой этап механизма реакции включает катионное 4π- электроциклическое замыкание кольца , которое образует продукт циклопентенона (см. Механизм ниже). По мере развития реакции варианты, включающие субстраты, отличные от дивинилкетонов, и промоторы, отличные от кислот Льюиса, были включены под название циклизации Назарова при условии, что они следуют схожему механистическому пути .
Успех циклизации Назарова как инструмента в органическом синтезе обусловлен полезностью и повсеместностью циклопентенонов как мотивов в природных продуктах (включая жасмон , афлатоксины и подкласс простагландинов ), так и полезных синтетических промежуточных продуктов для полного синтеза . Реакция использовалась в нескольких полных синтезах, и было опубликовано несколько обзоров. [2] [3] [4] [5] [6] [7]
Механизм классической реакции циклизации Назарова был впервые экспериментально продемонстрирован Чарльзом Шоппи как внутримолекулярная электроциклизация и описан ниже. Активация кетона кислотным катализатором генерирует пентадиенильный катион, который подвергается термически разрешенной 4π конротаторной электроциклизации, как предписано правилами Вудворда-Хоффмана . Это генерирует оксиаллильный катион , который подвергается реакции элиминирования, теряя β-водород. Последующая таутомеризация енолята дает продукт циклопентенон. [8] [9]

Как отмечено выше, известны варианты, отклоняющиеся от этого шаблона; то, что обозначает циклизацию Назарова, в частности, это генерация пентадиенильного катиона с последующим электроциклическим замыканием кольца в оксиаллильный катион. Для того чтобы достичь этого преобразования, молекула должна находиться в s-транс/s-транс- конформации , размещая винильные группы в соответствующей ориентации. Склонность системы входить в эту конформацию существенно влияет на скорость реакции , причем α-замещенные субстраты имеют повышенную популяцию необходимого конформера из-за аллильного напряжения . Координация электрон-донорного α-заместителя катализатором может также увеличить скорость реакции, обеспечивая эту конформацию. [2]
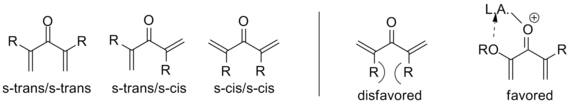
Аналогично, β-замещение, направленное внутрь, ограничивает s-транс-конформацию настолько сильно, что было показано, что EZ- изомеризация происходит до циклизации на широком диапазоне субстратов, давая транс-циклопентенон независимо от начальной конфигурации. Таким образом, циклизация Назарова является редким примером стереоселективной перициклической реакции , тогда как большинство электроциклизаций являются стереоспецифичными . В приведенном ниже примере триэтилсилан используется для улавливания оксиаллильного катиона, так что элиминирования не происходит. [2] (См. Прерванные циклизации ниже)

В том же ключе алленилвинилкетоны того типа, который подробно изучал Маркус Тиус из Гавайского университета, демонстрируют резкое ускорение скорости из-за удаления β-водородов, устраняя большое количество стерического напряжения в s-цис-конформере. [6]

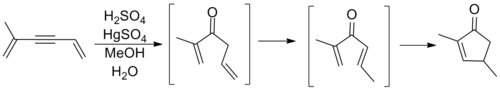
Хотя циклизации, следующие общему шаблону выше, наблюдались до участия Назарова, именно его исследование перегруппировок аллилвинилкетонов ознаменовало первое крупное исследование этого процесса. Назаров правильно рассудил, что аллильный олефин изомеризуется in situ с образованием дивинилкетона перед замыканием кольца в циклопентеноновый продукт. Реакция, показанная ниже, включает реакцию оксимеркурирования алкина для получения необходимого кетона. [10]
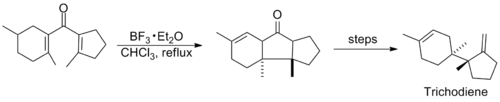
Исследования, связанные с этой реакцией, были относительно тихими в последующие годы, пока в середине 1980-х годов не были опубликованы несколько синтезов, использующих циклизацию Назарова. Ниже показаны ключевые этапы синтеза триходиена и нор-стереполида, последний из которых, как полагают, протекает через необычную алкин - алленовую изомеризацию, которая генерирует дивинилкетон. [11] [12]

Классическая версия циклизации Назарова страдает от нескольких недостатков, которые современные варианты пытаются обойти. Первые два не очевидны из самого механизма, но указывают на барьеры для циклизации; последние три вытекают из проблем селективности, связанных с элиминированием и протонированием промежуточного продукта. [2]

Отмеченные выше недостатки ограничивают полезность реакции циклизации Назарова в ее канонической форме. Однако модификации реакции, направленные на устранение ее проблем, продолжают оставаться активной областью академических исследований . В частности, исследования были сосредоточены на нескольких ключевых областях: превращение реакции в каталитическую в промоторе, воздействие на реакцию с более мягкими промоторами для улучшения толерантности к функциональной группе , управление региоселективностью этапа элиминирования и улучшение общей стереоселективности . Они были успешными в разной степени.
Кроме того, модификации были сосредоточены на изменении хода реакции, либо путем генерации пентадиенильного катиона нетрадиционным способом, либо путем «перехвата» оксиаллильного катиона различными способами. Кроме того, были разработаны энантиоселективные варианты различных видов. Огромный объем литературы по этой теме препятствует всестороннему изучению этой области; основные примеры приведены ниже.
Самые ранние попытки улучшить селективность циклизации Назарова использовали эффект β-кремния для управления региоселективностью этапа элиминирования. Эта химия была наиболее широко разработана профессором Скоттом Денмарком из Иллинойсского университета в Урбане-Шампейне в середине 1980-х годов и использует стехиометрические количества трихлорида железа для ускорения реакции. В случае бициклических продуктов цис- изомер выбирался в разной степени. [13]

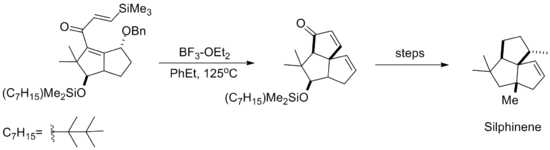
Реакция циклизации Назарова, направляемая кремнием, впоследствии была использована в синтезе природного продукта Сильфинена, показанного ниже. Циклизация происходит до удаления фрагмента бензилового спирта , так что результирующая стереохимия вновь образованного кольца возникает из-за приближения анти- силилового алкена к эфиру. [10]
Опираясь на эффекты заместителей, собранные в ходе различных испытаний реакции, профессор Элисон Фронтьер из Университета Рочестера разработала парадигму для «поляризованных» циклизаций Назарова, в которых электронодонорные и электроноакцепторные группы используются для улучшения общей селективности реакции. Создание эффективного винильного нуклеофила и винильного электрофила в субстрате позволяет проводить каталитическую активацию с трифлатом меди и региоселективное устранение. Кроме того, электроноакцепторная группа увеличивает кислотность α-протона, что позволяет селективно образовывать транс-α-эпимера посредством уравновешивания. [14]
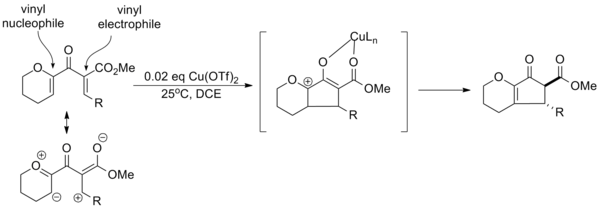
Часто каталитическую активацию можно осуществить, используя только донорную или акцепторную группу, хотя эффективность реакции (выход, время реакции и т. д.) обычно ниже.
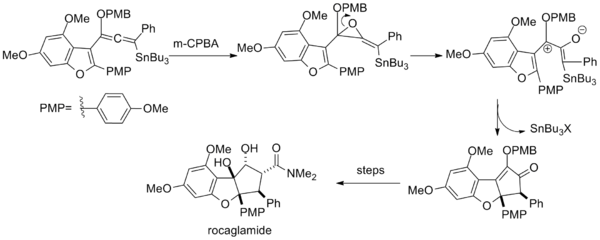
В более широком смысле, любой пентадиенильный катион, независимо от его происхождения, способен подвергаться циклизации Назарова. Было опубликовано большое количество примеров, где требуемый катион был получен путем различных перегруппировок. [2] Один из таких примеров включает в себя катализируемое серебром катионное раскрытие кольца аллильных дихлорциклопропанов. Соль серебра облегчает потерю хлорида посредством осаждения нерастворимого хлорида серебра . [15]
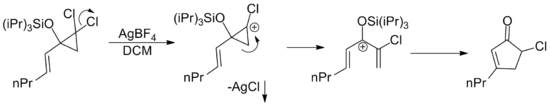
В общем синтезе рокагламида эпоксидирование винилалкоксиалленилстаннана также приводит к образованию пентадиенильного катиона посредством раскрытия кольца полученного эпоксида . [16]
После того, как циклизация произошла, образуется оксиаллильный катион. Как подробно обсуждалось выше, типичным ходом для этого промежуточного продукта является элиминирование с последующей енолятной таутомеризацией . Однако эти два этапа могут быть прерваны различными нуклеофилами и электрофилами соответственно. Захват оксиаллильного катиона был широко разработан Фредериком Г. Уэстом из Университета Альберты , и его обзор охватывает эту область. [17] Оксиаллильный катион может быть захвачен гетероатомными и углеродными нуклеофилами , а также может подвергаться катионным циклоприсоединениям с различными связанными партнерами. Ниже показана каскадная реакция, в которой последовательный захват катиона генерирует пентациклическое ядро за один шаг с полной диастереоселективностью . [18]
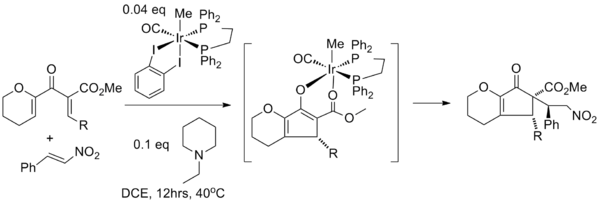
Захват енолята различными электрофилами встречается значительно реже. В одном исследовании циклизация Назарова сопряжена с реакцией Михаэля с использованием иридиевого катализатора для инициирования нуклеофильного сопряженного присоединения енолята к β-нитростиролу . В этой тандемной реакции иридиевый катализатор требуется для обоих превращений: он действует как кислота Льюиса в циклизации Назарова, а на следующем этапе нитрогруппа нитростирола сначала координируется с иридием в лигандном обмене с атомом кислорода карбонильного эфира, прежде чем происходит фактическое присоединение Михаэля к противоположной стороне R-группы. [19]
Разработка энантиоселективной циклизации Назарова является желательным дополнением к репертуару реакций циклизации Назарова. С этой целью было разработано несколько вариаций с использованием хиральных вспомогательных веществ и хиральных катализаторов . Также известны диастереоселективные циклизации, в которых существующие стереоцентры направляют циклизацию. Почти все попытки основаны на идее торквоселективности ; выбор одного направления для винильных групп для «вращения» в свою очередь устанавливает стереохимию, как показано ниже. [2]

Циклизации Назарова, направляемые кремнием, могут демонстрировать индуцированную диастереоселективность таким образом. В примере ниже силильная группа действует, направляя циклизацию, предотвращая вращение удаленного алкена «к» ней посредством неблагоприятного стерического взаимодействия . Таким образом, кремний действует как бесследное вспомогательное вещество . (Исходный материал не является энантиомерно чистым, но сохранение энантиомерного избытка предполагает, что вспомогательное вещество направляет циклизацию.) [2]

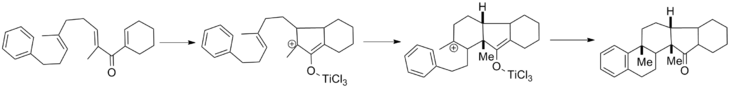
Алленильные субстраты Тиуса могут проявлять аксиальный перенос хиральности в тетраэдрический, если используются энантиомерно чистые аллены. В примере ниже получен хиральный диосфенпол с выходом 64% и энантиомерным избытком 95% . [2]

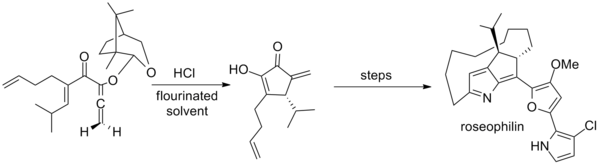
Тиус дополнительно разработал вспомогательное вещество на основе камфары для ахиральных алленов, которое использовалось в первом асимметричном синтезе розеофилина . Ключевой шаг использует необычную смесь гексафтор-2-пропанола и трифторэтанола в качестве растворителя. [2] [20]
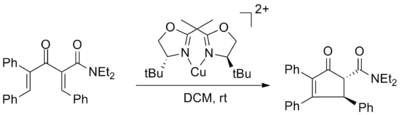
Первая хиральная кислота Льюиса, способствующая асимметричной циклизации Назарова, была описана Вариндером Аггарвалом и использовала комплексы лигандов бисоксазолина меди (II) с ее до 98%. Энантиомерный избыток не был затронут использованием 50 мол.% комплекса меди, но выход был значительно снижен. [2]
Расширения циклизации Назарова обычно также включаются под тем же названием. Например, α-β, γ-δ ненасыщенный кетон может подвергаться похожей катионной конротаторной циклизации, которая обычно называется реакцией изо-циклизации Назарова . [21] Другим таким расширениям были даны похожие названия, включая гомо -циклизации Назарова и винилогические циклизации Назарова. [22] [23]
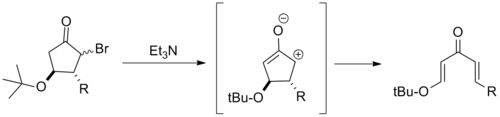
Поскольку они перестабилизируют катион пентадиенила, β-электрон-донорные заместители часто серьезно затрудняют циклизацию Назарова. Исходя из этого, сообщалось о нескольких электроциклических раскрытиях колец β-алкоксициклопентанов. Обычно их называют реакциями ретро-циклизации Назарова . [2]
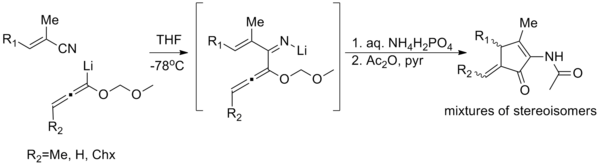
Аналоги азота реакции циклизации Назарова (известные как реакции циклизации имино-Назарова ) имеют несколько примеров; есть один пример обобщенной циклизации имино-Назарова, описанный (показан ниже), [24] и несколько реакций изо-имино-Назарова в литературе. [25] [26] Даже они, как правило, страдают от плохой стереоселективности, плохих выходов или узкой области применения. Трудность возникает из-за относительной чрезмерной стабилизации пентадиенильного катиона за счет донорства электронов, что затрудняет циклизацию. [27]
{{citation}}: Отсутствует или пусто |title=( помощь )