В химии конформационная изомерия является формой стереоизомерии , в которой изомеры могут быть взаимопревращены просто путем вращения вокруг формально одинарных связей (см. рисунок о вращении одинарной связи). В то время как любые два расположения атомов в молекуле , которые отличаются вращением вокруг одинарных связей, можно назвать различными конформациями , конформации, которые соответствуют локальным минимумам на поверхности потенциальной энергии, конкретно называются конформационными изомерами или конформерами . [1] Конформации, которые соответствуют локальным максимумам на поверхности энергии, являются переходными состояниями между локально-минимальными конформационными изомерами. Вращения вокруг одинарных связей включают преодоление вращательного энергетического барьера для взаимопревращения одного конформера в другой. Если энергетический барьер низок, происходит свободное вращение [2] , и образец соединения существует как быстро уравновешивающаяся смесь нескольких конформеров; если энергетический барьер достаточно высок, то вращение ограничено, молекула может существовать в течение относительно длительного периода времени как стабильный вращательный изомер или ротамер (изомер, возникающий из-за затрудненного вращения одинарной связи). Когда временная шкала для взаимопревращения достаточно длинна для изоляции отдельных ротамеров (обычно произвольно определяется как период полураспада взаимопревращения 1000 секунд или дольше), изомеры называются атропоизомерами ( см.: атропоизомерия ). [1] [3] [4] Переворот кольца замещенных циклогексанов представляет собой другую распространенную форму конформационной изомерии.
Конформационные изомеры, таким образом, отличаются от других классов стереоизомеров (т. е. конфигурационных изомеров), где взаимопревращение обязательно включает разрыв и реформирование химических связей. [5] Например, L / D - и R / S - конфигурации органических молекул имеют различную направленность и оптическую активность и могут быть взаимопревращены только путем разрыва одной или нескольких связей, связанных с хиральным атомом, и реформирования аналогичной связи в другом направлении или пространственной ориентации. Они также отличаются от геометрических ( цис / транс ) изомеров, другого класса стереоизомеров, которым требуется разрыв π-компоненты двойных связей для взаимопревращения. (Хотя различие не всегда четкое, поскольку некоторые связи, которые формально являются одинарными связями, на самом деле имеют характер двойной связи, который становится очевидным только при рассмотрении вторичных резонансных вкладчиков, таких как связи C–N амидов , например.) Из-за быстрого взаимопревращения конформеры обычно не изолируются при комнатной температуре.
Изучение энергетики между различными конформациями называется конформационным анализом . [6] Он полезен для понимания стабильности различных изомеров, например, принимая во внимание пространственную ориентацию и пространственные взаимодействия заместителей. Кроме того, конформационный анализ может быть использован для прогнозирования и объяснения селективности продукта, механизмов и скоростей реакций. [7] Конформационный анализ также играет важную роль в рациональном, структурно-ориентированном дизайне лекарств .

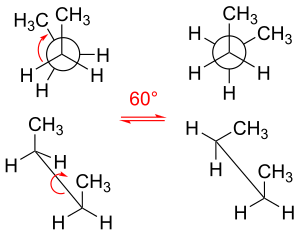
Вращая свои углерод-углеродные связи, молекулы этана и пропана имеют три локальных энергетических минимума. Они структурно и энергетически эквивалентны и называются шахматными конформерами . Для каждой молекулы три заместителя, исходящие из каждой углерод-углеродной связи, являются шахматными, причем каждый двугранный угол H–C–C–H (и двугранный угол H–C–C–CH 3 в случае пропана) равен 60° (или приблизительно равен 60° в случае пропана). Три заслоненные конформации, в которых двугранные углы равны нулю, являются переходными состояниями (максимумами энергии), соединяющими два эквивалентных энергетических минимума, шахматные конформеры.
Молекула бутана является простейшей молекулой, в которой вращения одинарных связей приводят к двум типам неэквивалентных структур, известных как анти- и гош- конформеры (см. рисунок).
Например, бутан имеет три конформера, связанных с его двумя метильными (CH 3 ) группами: два гош -конформера, в которых метильные группы находятся на расстоянии ±60° друг от друга и которые являются энантиомерами , и анти -конформер, в котором четыре углеродных центра копланарны, а заместители находятся на расстоянии 180° друг от друга (см. диаграмму свободной энергии бутана). Разница энергий между гош и анти составляет 0,9 ккал/моль, что связано с энергией деформации гош-конформера. Таким образом, анти-конформер является наиболее стабильным (≈ 0 ккал/моль). Три заслоненные конформации с двугранными углами 0°, 120° и 240° являются переходными состояниями между конформерами. [6] Обратите внимание, что две заслоненные конформации имеют разные энергии: при 0° заслонены две метильные группы, что приводит к более высокой энергии (≈ 5 ккал/моль), чем при 120°, где метильные группы заслонены водородами (≈ 3,5 ккал/моль). [9]
В то время как простые молекулы можно описать этими типами конформаций, более сложные молекулы требуют использования системы Клайна-Прелога для описания различных конформеров. [6]
Более конкретные примеры конформационной изомерии подробно описаны в другом месте:

Конформационные изомеры существуют в динамическом равновесии , где относительная свободная энергия изомеров определяет популяцию каждого изомера, а энергетический барьер вращения определяет скорость взаимопревращения между изомерами: [11]
где K — константа равновесия, Δ G° — разница в стандартной свободной энергии между двумя конформерами в ккал/моль, R — универсальная газовая постоянная (1,987×10−3 ккал /моль K), а T — температура системы в кельвинах . В единицах ккал/моль при 298 K,
Таким образом, каждые 1,36 ккал/моль соответствуют коэффициенту около 10 в константе равновесия при температурах, близких к комнатной. (« Правило 1,36 » полезно в целом для оценки констант равновесия при комнатной температуре по разнице свободной энергии. При более низких температурах для получения заданной константы равновесия требуется меньшая разность энергий.)
На диаграмме, изображающей равновесное распределение двух конформеров при разных температурах, приведены три изотермы. При разнице свободной энергии 0 ккал/моль это дает константу равновесия 1, что означает, что два конформера существуют в соотношении 1:1. У них одинаковая свободная энергия; ни один из них не более стабилен, поэтому ни один из них не преобладает по сравнению с другим. Отрицательная разница в свободной энергии означает, что конформер взаимопревращается в термодинамически более стабильную конформацию, поэтому константа равновесия всегда будет больше 1. Например, Δ G° для превращения бутана из гош -конформера в анти -конформер составляет −0,47 ккал/моль при 298 К. [12] Это дает константу равновесия около 2,2 в пользу анти -конформера или смеси гош : анти -конформеров в соотношении 31:69 в равновесии. Наоборот, положительная разница в свободной энергии означает, что конформер уже более стабилен, поэтому взаимопревращение является неблагоприятным равновесием ( K < 1). Даже для крайне неблагоприятных изменений (большие положительные Δ G° ) константа равновесия между двумя конформерами может быть увеличена путем повышения температуры, так что количество менее стабильного конформера, присутствующего в равновесии, увеличивается (хотя он всегда остается второстепенным конформером).

Распределение дробной популяции различных конформеров следует распределению Больцмана : [13]
Левая часть — доля конформера i в равновесной смеси M конформеров в термодинамическом равновесии. С правой стороны E k ( k = 1, 2, ..., M ) — энергия конформера k , R — молярная постоянная идеального газа (приблизительно равная 8,314 Дж/(моль·К) или 1,987 кал/(моль·К)), а T — абсолютная температура . Знаменатель правой части — это функция распределения.
Эффекты электростатических и стерических взаимодействий заместителей, а также орбитальные взаимодействия, такие как гиперконъюгация, отвечают за относительную стабильность конформеров и их переходных состояний. Вклад этих факторов варьируется в зависимости от природы заместителей и может вносить как положительный, так и отрицательный вклад в энергетический барьер. Вычислительные исследования малых молекул, таких как этан, показывают, что электростатические эффекты вносят наибольший вклад в энергетический барьер; однако барьер традиционно приписывается в первую очередь стерическим взаимодействиям. [14] [15]

В случае циклических систем стерический эффект и вклад в свободную энергию можно аппроксимировать значениями A , которые измеряют разницу энергий, когда заместитель на циклогексане находится в аксиальном по сравнению с экваториальным положением. В больших (>14 атомов) кольцах существует много доступных низкоэнергетических конформаций, которые соответствуют свободной от напряжений алмазной решетке. [16]
Короткий временной масштаб взаимопревращения исключает разделение конформационных изомеров в большинстве случаев. Атропоизомеры являются конформационными изомерами, которые могут быть разделены из-за ограниченного вращения. [17] Равновесие между конформационными изомерами можно наблюдать с помощью различных спектроскопических методов .
Сворачивание белка также генерирует стабильные конформационные изомеры, которые можно наблюдать. Уравнение Карплуса связывает двугранный угол вицинальных протонов с их константами J-связывания , измеренными с помощью ЯМР. Уравнение помогает в выяснении сворачивания белка, а также конформаций других жестких алифатических молекул. [18] Боковые цепи белка демонстрируют ротамеры, распределение которых определяется их стерическим взаимодействием с различными конформациями остова. [19] Это очевидно из статистического анализа конформаций боковых цепей белка в библиотеке ротамеров, зависящих от остова .
В производных циклогексана два конформера кресла быстро взаимопревращаются при комнатной температуре, при этом сам циклогексан претерпевает переворот кольца со скоростью приблизительно 10 5 переворотов кольца/сек, с общим энергетическим барьером 10 ккал/моль (42 кДж/моль), что исключает их разделение при температуре окружающей среды. [20] Однако при низких температурах ниже точки коалесценции можно напрямую контролировать равновесие с помощью ЯМР-спектроскопии и с помощью динамической, зависящей от температуры ЯМР-спектроскопии - барьерное взаимопревращение. [21]
Динамику конформационной (и других видов) изомерии можно отслеживать с помощью ЯМР- спектроскопии при различных температурах. Метод применим к барьерам 8–14 ккал/моль, и виды, демонстрирующие такую динамику, часто называют « флюксионными ».
Помимо ЯМР-спектроскопии, для измерения конформерных соотношений используется ИК-спектроскопия . Для аксиального и экваториального конформера бромциклогексана ν CBr отличается почти на 50 см −1 . [20]
Скорости реакции сильно зависят от конформации реагентов. Во многих случаях доминирующий продукт возникает в результате реакции менее распространенного конформера в силу принципа Кертина-Хаммета . Это типично для ситуаций, когда конформационное равновесие происходит намного быстрее, чем реакция с образованием продукта. Зависимость реакции от стереохимической ориентации, таким образом, обычно видна только в конфигурационных изомерах , в которых конкретная конформация заблокирована заместителями. Прогнозирование скоростей многих реакций, включающих переход между состояниями sp2 и sp3, таких как восстановление кетона, окисление спирта или нуклеофильное замещение , возможно, если учитывать все конформеры и их относительную стабильность, определяемую их напряжением . [22]
Одним из примеров конфигурационных изомеров являются реакции элиминирования , которые включают одновременное удаление протона и уходящей группы из вицинальных или антиперипланарных положений под влиянием основания.
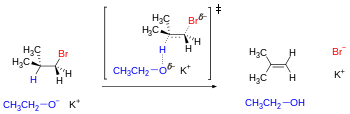
Механизм требует, чтобы отходящие атомы или группы следовали антипараллельным траекториям. Для субстратов с открытой цепью это геометрическое предварительное условие выполняется по крайней мере одним из трех смещенных конформеров. Однако для некоторых циклических субстратов, таких как циклогексан, антипараллельное расположение может быть недостижимо в зависимости от заместителей, которые могут устанавливать конформационный замок. [23] Соседние заместители на циклогексановом кольце могут достичь антиперипланарности только тогда, когда они занимают трансдиаксиальные положения (то есть оба находятся в аксиальном положении, один идет вверх, а другой идет вниз).
Одним из следствий этого анализа является то, что транс- 4- трет -бутилциклогексилхлорид не может легко элиминироваться, а вместо этого подвергается замещению (см. диаграмму ниже), поскольку наиболее стабильная конформация имеет объемную группу t -Bu в экваториальном положении, поэтому хлоридная группа не является антиперипланарной ни с одним вицинальным водородом (она гош по отношению ко всем четырем). Термодинамически невыгодная конформация имеет группу t -Bu в аксиальном положении, что выше по энергии более чем на 5 ккал/моль (см. значение A ). [24] В результате группа t -Bu «запирает» кольцо в конформации, где она находится в экваториальном положении, и наблюдается реакция замещения. С другой стороны, цис -4- трет -бутилциклогексилхлорид подвергается элиминированию, поскольку антиперипланарность Cl и H может быть достигнута, когда группа t -Bu находится в благоприятном экваториальном положении.
Отталкивание между аксиальной t -бутильной группой и атомами водорода в 1,3-диаксиальном положении настолько сильно, что циклогексановое кольцо вернется к конформации скрученной лодки . Напряжение в циклических структурах обычно характеризуется отклонениями от идеальных углов связи ( напряжение Байера ), идеальных углов кручения ( напряжение Питцера ) или трансаннулярных (Прелог) взаимодействий.

Конформеры алканов возникают из вращения вокруг sp 3 гибридизированных углерод-углеродных сигма-связей . Наименьший алкан с такой химической связью, этан , существует в виде бесконечного числа конформаций относительно вращения вокруг связи C–C. Две из них признаны формами с минимальным энергетическим значением ( затерянная конформация ) и максимальным энергетическим значением ( затменная конформация ). Существование определенных конформаций обусловлено затрудненным вращением вокруг сигма-связей, хотя конкурирующая теория предполагает роль гиперконъюгации .
Важность энергетических минимумов и энергетических максимумов видна при расширении этих концепций на более сложные молекулы, для которых стабильные конформации могут быть предсказаны как формы с минимальной энергией. Определение стабильных конформаций также сыграло большую роль в установлении концепции асимметричной индукции и способности предсказывать стереохимию реакций, контролируемых стерическими эффектами.
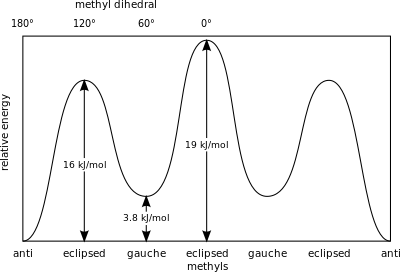
В примере с заторможенным этаном в проекции Ньюмена атом водорода на одном атоме углерода имеет 60° торсионный угол или угол кручения [25] относительно ближайшего атома водорода на другом углероде, так что стерические помехи сведены к минимуму. Заторможенная конформация более стабильна на 12,5 кДж / моль , чем заслоненная конформация, которая является максимумом энергии для этана. В заслоненной конформации торсионный угол минимизирован.

В бутане две смещенные конформации больше не эквивалентны и представляют собой два различных конформера: анти-конформацию (крайняя левая, внизу) и гош-конформацию (крайняя правая, внизу).

Обе конформации свободны от торсионной деформации, но в гош-конформации две метильные группы находятся ближе друг к другу, чем сумма их радиусов Ван-дер-Ваальса. Взаимодействие между двумя метильными группами является отталкивающим ( деформация Ван-дер-Ваальса ), и возникает энергетический барьер .
Мера потенциальной энергии, запасенной в конформерах бутана с большими стерическими препятствиями, чем основное состояние «анти»-конформера, определяется следующими значениями: [26]
Затененные метильные группы создают большее стерическое напряжение из-за большей электронной плотности по сравнению с отдельными атомами водорода .
Учебное объяснение существования максимума энергии для заслоненной конформации в этане — стерическое препятствие , но при длине связи CC 154 пм и радиусе Ван-дер-Ваальса для водорода 120 пм атомы водорода в этане никогда не мешают друг другу. Вопрос о том, ответственны ли стерические препятствия за заслоненный максимум энергии, является предметом дебатов и по сей день. Одна из альтернатив объяснению стерических препятствий основана на гиперконъюгации , проанализированной в рамках естественной орбитальной связи. [27] [28] [29] В заторможенной конформации одна сигма- связывающая орбиталь CH отдает электронную плотность антисвязывающей орбитали другой связи CH. Энергетическая стабилизация этого эффекта максимальна, когда две орбитали имеют максимальное перекрытие, происходящее в заторможенной конформации. В заторможенной конформации перекрытия нет, что приводит к неблагоприятному максимуму энергии. С другой стороны, анализ в рамках количественной теории молекулярных орбиталей показывает, что 2-орбитальные-4-электронные (стерические) отталкивания доминируют над гиперконъюгацией. [30] Исследование теории валентных связей также подчеркивает важность стерических эффектов. [31]
Наименование алканов согласно стандартам, перечисленным в Золотой книге ИЮПАК, осуществляется в соответствии с системой Клайна-Прелога для указания углов (называемых либо торсионными, либо двугранными углами ) между заместителями вокруг одинарной связи: [25]

Деформация кручения или «деформация Питцера» относится к сопротивлению скручиванию вокруг связи.
В н -пентане концевые метильные группы испытывают дополнительную пентановую интерференцию .
Замена водорода на фтор в политетрафторэтилене изменяет стереохимию с зигзагообразной геометрии на спиральную из -за электростатического отталкивания атомов фтора в позициях 1,3. Доказательства спиральной структуры в кристаллическом состоянии получены из рентгеновской кристаллографии и из ЯМР-спектроскопии и кругового дихроизма в растворе. [33]