Трихотецены представляют собой большое семейство химически родственных микотоксинов . Их продуцируют различные виды Fusarium , Myrothecium , Trichoderma / Podostroma , Trichothecium , Cephalosporium , Verticimonosporium и Stachybotrys . По химическому составу трихотецены представляют собой класс сесквитерпенов .
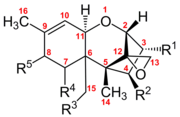
Определяющими структурными особенностями, обуславливающими биологическую активность трихотеценов, являются 12,13-эпоксидное кольцо, наличие гидроксильных или ацетильных групп в соответствующих положениях ядра трихотецена, а также строение и положение боковой цепи. Они производятся на многих различных зернах, таких как пшеница, овес или кукуруза, различными видами Fusarium , включая F. graminearum , F. sporotrichioides , F. poae и F. equiseti .
Некоторые плесени, вырабатывающие трихотеценовые микотоксины, например Stachybotryschartarum , могут расти во влажных помещениях. Было обнаружено, что макроциклические трихотецены, продуцируемые S.chartarum, могут передаваться по воздуху и, таким образом, усугублять проблемы со здоровьем жителей зданий. [1] [2] Ядовитый гриб, произрастающий в Японии и Китае , Podostroma cornu-damae , содержит шесть трихотеценов, включая сатратоксин H , роридин E и веррукарин.

Трихотецены представляют собой группу из более чем 150 химически родственных микотоксинов . [3] Каждый трихотецен имеет структуру ядра, состоящую из одного шестичленного кольца, содержащего один атом кислорода, окруженного двумя углеродными кольцами. [4] Эта основная кольцевая структура содержит эпоксид или трициклический эфир в положениях углерода 12, 13, а также двойную связь в положениях углерода 9, 10. [5] Эти две функциональные группы в первую очередь ответственны за способность трихотецена ингибировать синтез белка и вызывать общие цитотоксические эффекты. [6] Примечательно, что эта основная структура является амфипатической и содержит как полярные, так и неполярные части. [7] Все трихотецены связаны этой общей структурой, но каждый трихотецен также имеет уникальный образец замещения кислородсодержащих функциональных групп в возможных местах на атомах углерода 3,4,7,8 и 15. [5] Эти функциональные группы управляют свойств отдельного трикотецена, а также служат основой наиболее часто используемой системы классификации этого семейства токсинов. Эта система классификации разбивает семейство трихотеценов на четыре группы: тип A, B, C и D.
Трикотецены типа А имеют гидроксильные , сложноэфирные или отсутствие функциональных групповых замещений вокруг основной кольцевой структуры. [4] Распространенными примерами являются неозоланиол с гидроксильным замещением у углерода 8 и токсин Т-2 с сложноэфирным замещением у углерода 8.
Трикотецены типа B классифицируются по наличию карбонильных функциональных групп, замещенных вокруг основной кольцевой структуры. [4] Общие примеры включают ниваленол и трихотецин, оба из которых имеют кетоновую функциональную группу у углерода 8.
Трихотецены типа C имеют дополнительную эпоксидную группу углерода 7 и углерода 8. [4] Типичным примером является кротоцин. который также имеет сложноэфирную функциональную группу у углерода 4.
Трихотецены типа D имеют дополнительное кольцо между углеродом 4 и углеродом 15. [4] Эти кольца могут иметь разнообразные дополнительные функциональные группы. Типичными примерами являются роридин А и сатратоксин Н.
Хотя отдельные функциональные группы этих классификационных типов придают каждому трихотецену уникальные химические свойства, их классификационный тип не указывает явно на их относительную токсичность. [4] Хотя трихотецены типа D считаются наиболее токсичными, типы A и B обладают относительно смешанной токсичностью. [4]
Описанная выше система классификации наиболее часто используется для группировки молекул семейства трихотеценов. Однако для этих сложных молекул также существует множество альтернативных систем классификации. Трихотецены также можно охарактеризовать как простые или макроциклические. [6] Простые трихотецены включают типы A, B и C, тогда как макроциклические трикотецены включают тип D и характеризуются наличием мостика углерод 4 – углерод 15. Кроме того, Дж. Ф. Гроув предложил классификацию трикотеценов на три группы, которая также была основана на моделях функциональных замещений кольцевого скелета. [8] Трикотецены группы 1 имеют только функциональные группы, замещенные в третьем, полностью насыщенном углеродном кольце. [8] Трикотецены группы 2 содержат дополнительные функциональные группы в основном кольце, содержащем двойную связь углерода 9, 10. [8] Наконец, трихотецены группы 3 содержат кетоновую функциональную группу у углерода 8; это те же критерии для трихотеценов типа B. [8]
Достижения в области эволюционной генетики также привели к предложению систем классификации трихотеценов, основанных на пути их биосинтеза. Гены , ответственные за биосинтез микотоксина, обычно расположены группами; у Fusariumi они известны как TRI-гены. [9] Каждый из генов TRI отвечает за выработку фермента , который выполняет определенный этап биосинтеза трихотеценов. Мутации в этих генах могут привести к образованию вариантов трихотеценов, и поэтому эти молекулы можно сгруппировать на основе общих этапов биосинтеза. Например, общий этап биосинтеза трихотеценов контролируется геном TRI4 . [10] Этот ферментный продукт контролирует присоединение трех или четырех атомов кислорода к триходиену с образованием изотриходиола или изотрихотриола соответственно. [10] Затем из любого из этих промежуточных продуктов можно синтезировать различные трихотецены, и поэтому их можно классифицировать либо как t-тип, если синтезируют из изотрихотриола, либо как d-тип, если синтезируют из изотрихотриола. [4]

Токсичность трикотеценов в первую очередь является результатом их широко упоминаемого действия как ингибиторов синтеза белка; это ингибирование происходит в рибосомах на всех трех стадиях синтеза белка: инициации, элонгации и терминации. [11] Во время инициации трихотецены могут либо ингибировать ассоциацию двух субъединиц рибосомы, либо ингибировать функцию зрелой рибосомы, предотвращая ассоциацию первой тРНК со стартовым кодоном. [11] Ингибирование удлинения, скорее всего, происходит из-за трихотеценов, препятствующих функции пептидилтрансферазы , фермента, который катализирует образование новых пептидных связей на 60-й субъединице рибосомы. [12] Ингибирование во время терминации также может быть результатом ингибирования пептидилтрансферазы или способности трихотеценов предотвращать гидролиз, необходимый на этом последнем этапе. [11]
Интересно отметить, что характер замещения кольцевого ядра трихотеценов влияет на действие токсина либо как ингибитор инициации, либо как ингибитор элонгации/терминации. [11] Трихотецены также обладают способностью влиять на общую функцию клеточных ферментов из-за тенденции тиоловых групп активного центра атаковать 12,13-углеродное эпоксидное кольцо. [13] Эти ингибирующие эффекты наиболее ярко проявляются в активно пролиферирующих клетках, таких как желудочно -кишечный тракт или костный мозг .
Синтез белка происходит как в цитоплазме клетки, так и в просветном пространстве митохондрий , цитоплазматических органелл, ответственных за выработку энергии клетки. Это осуществляется посредством ферментативного пути, который генерирует сильно окисленные молекулы, называемые активными формами кислорода , например, перекисью водорода . [14] Активные формы кислорода могут вступать в реакцию и вызывать повреждение многих важных частей клетки, включая мембраны, белки и ДНК . [15] Ингибирование трихотеценом синтеза белка в митохондриях позволяет накапливаться в клетке активным формам кислорода, что неизбежно приводит к окислительному стрессу и индукции запрограммированного пути гибели клеток - апоптоза . [15]
Индукция апоптоза в клетках с высоким уровнем активных форм кислорода обусловлена разнообразием клеточных сигнальных путей. Первый — это путь р53 , который, как показано, активируется токсином Т-2. p53 — белок, отвечающий за контроль клеточного цикла, однако повышение активности этого белка приводит также к усилению активации белков BAX в клетке. [16] Эти белки BAX в первую очередь ответственны за увеличение проницаемости митохондриальной мембраны и приводят к высвобождению цитохрома с и активных форм кислорода. [16] Высвобождение цитохрома с из митохондрий вызывает апоптоз, инициируя сборку каспаз или белков, ответственных за разрушение клетки изнутри.
Кроме того, было показано, что трихотецены, такие как Т-2, усиливают сигнальный путь N-концевой киназы c-Jun в клетках. [17] Здесь N-концевая киназа c-Jun способна усиливать фосфорилирование своей мишени, c-Jun, до активной формы. Активированный c-jun действует как фактор транскрипции в ядре клетки для белков, важных для облегчения последующего апоптотического пути. [17]
Трихотеценовые микотоксины токсичны для человека, других млекопитающих, птиц, рыб, различных беспозвоночных, растений и эукариотических клеток. [18] Специфическая токсичность варьируется в зависимости от конкретного токсина и вида животных, однако путь введения играет значительно более важную роль в определении летальности. Последствия отравления будут зависеть от концентрации воздействия, продолжительности времени и способа воздействия на человека. Высококонцентрированный раствор или большое количество газообразной формы токсина с большей вероятностью вызовут серьезные последствия, включая смерть. При употреблении токсин ингибирует синтез рибосомального белка, ДНК и РНК, [19] [18] [20] функции митохондрий [21] [22] [23] деление клеток [24] [25] , одновременно активируя клеточную реакцию на стресс, называемую риботоксическая реакция на стресс. [26]
Трихотеценовые микотоксины могут всасываться местно , перорально и ингаляционно и являются высокотоксичными на субклеточном, клеточном и органическом уровне. [18]
Трихотецены отличаются от большинства других потенциальных токсинов оружия, поскольку они могут действовать через кожу, что объясняется их амфипатическими и липофильными характеристиками. Небольшая амфипатическая природа трихотеценов позволяет им легко проникать через клеточные мембраны [7] и взаимодействовать с различными органеллами, такими как митохондрии, [27] [28] эндоплазматический ретикулум (ЭР). [29] и хлоропласты [30] . Липофильная природа трихотеценов позволяет им легко всасываться через кожу [31] , слизистую оболочку легких и кишечник. Прямое кожное применение или пероральный прием трихотецена вызывает быстрое раздражение кожи или слизистой оболочки кишечника. [19] [18] Утверждается, что как средство, раздражающее кожу и вызывающее образование волдырей, он в 400 раз более опьяняет, чем сернистый иприт .

Реакция организма на микотоксин — алиментарно-токсическую алейкию — возникает через несколько дней после употребления и проходит в четыре стадии:
Инфекция может быть вызвана даже незначительной травмой, например порезом, царапиной или ссадиной. [32]
Проявляются следующие симптомы:
Когда дело доходит до продуктов питания для животных и человека, трихотецены типа А (например, токсин Т-2 , токсин НТ-2, диацетоксисцирпенол ) представляют особый интерес, поскольку они более токсичны, чем другие трихотецены пищевого происхождения, т.е. группа типа В (например, дезоксиниваленол , ниваленол , 3- и 15-ацетилдезоксиниваленол). Однако дезоксиниваленол вызывает беспокойство, поскольку он является наиболее распространенным трихотеценом в Европе. [35] Основными эффектами трихотеценов, связанными с их концентрацией в товаре, являются снижение потребления корма, рвота и иммуносупрессия. Относительно немногие страны, в первую очередь в Европейском Союзе , рекомендуют максимальные пределы содержания этих микотоксинов в пищевых продуктах и кормах для животных. Однако трихотецены часто проверяют на наличие в других местах, чтобы предотвратить их попадание в пищевую цепь и предотвратить потери в животноводстве.
Считается, что трихотецены были обнаружены Советским Союзом в 1932 году в Оренбурге, Россия, во время Второй мировой войны . Около 100 000 человек (смертность 60%) начали страдать и умирать от алиментарно-токсической алейкии — смертельного заболевания с симптомами, напоминающими радиацию. Считается, что советские мирные жители заболели в результате употребления в пищу зараженного хлеба и вдыхания плесени через загрязненное сено, пыль и системы вентиляции. Считается, что виновником являются токсины Fusarium sporotrichioides и Fusarium poae , которые являются высокими продуцентами токсина Т-2 . [36] Виды Fusarium , вероятно, являются наиболее часто упоминаемыми и одними из самых распространенных грибов, продуцирующих трихотецен. [37]
Трихотецены представляют собой идеальные биологические боевые агенты, смертельные и недорогие в производстве в больших количествах, стабильные в виде аэрозоля для распыления и не требующие эффективной вакцинации/лечения. [12] Имеющиеся данные свидетельствуют о том, что микотоксины уже использовались в качестве биологического оружия.
С тех пор о трихотеценах сообщалось во всем мире. [45] Они оказали значительное экономическое воздействие на мир из-за гибели людей и животных, увеличения затрат на здравоохранение и ветеринарную помощь, сокращения производства животноводческой продукции, утилизации загрязненных пищевых продуктов и кормов, а также инвестиций в исследования и применения для снижения серьезности последствий. проблемы микотоксинов. Эти микотоксины ежегодно приносят убытки в миллионы долларов из-за факторов, которые часто находятся вне контроля человека (окружающая среда, экология или метод хранения). [46]
Опасные концентрации трихотеценов обнаружены в кукурузе, пшенице, ячмене, овсе, рисе, ржи, овощах и других культурах. Заболевания, возникающие в результате инфекции, включают гниль семян, фитофтороз рассады, корневую гниль , гниль стебля и гниль початков. [47] Трихотецены также являются частыми загрязнителями кормов для птиц , и их неблагоприятное воздействие на здоровье и продуктивность птицы широко изучено. [48]
Некоторые исследования показали, что оптимальные условия для роста грибов не обязательно являются оптимальными для производства токсинов. [49] Наибольшее образование токсинов наблюдается при высокой влажности и температуре 6–24 °C. Размножение и производство грибков усиливаются в тропических условиях с высокими температурами и уровнями влажности; муссоны , ливневые паводки и несезонные дожди во время сбора урожая. [50] Трихотецены были обнаружены в пробах воздуха, что позволяет предположить, что они могут распыляться на спорах или мелких частицах [51] [52]
Сообщалось о естественном возникновении ТСТ в Азии , Африке , Южной Америке , Европе и Северной Америке [53].
Прямых противоядий от воздействия трихотецена не существует. Таким образом, управление рисками на загрязненных территориях в первую очередь определяется лечением симптомов воздействия, а также предотвращением будущего воздействия.
Типичные пути воздействия трихотеценовых токсинов включают местное всасывание, проглатывание и вдыхание. Тяжесть симптомов зависит от дозы и типа воздействия, но лечение в первую очередь направлено на поддержку систем организма, поврежденных микотоксином. Первым шагом в большинстве случаев заражения является снятие потенциально загрязненной одежды и тщательное промывание мест воздействия водой. [64] Это предотвращает повторное воздействие на жертву. Жертвам с тяжелыми нарушениями желудочно-кишечного тракта можно давать жидкости и электролиты, чтобы смягчить последствия снижения всасывания в желудочно-кишечном тракте. Свежий воздух и искусственная вентиляция легких также могут быть назначены при развитии легкой респираторной недостаточности. [64] Все более серьезные симптомы могут потребовать применения передовой медицинской помощи. Возникновение лейкопении или снижения количества лейкоцитов можно лечить переливанием плазмы или тромбоцитов . [64] Гипотонию можно лечить введением норадреналина или дофамина . [64] Развитие тяжелого сердечно-легочного дистресса может потребовать интубации и дополнительного медикаментозного лечения для стабилизации деятельности сердца и легких.
Кроме того, существует множество химических веществ, которые могут косвенно снизить повреждающее воздействие трихотеценов на клетки и ткани. Растворы активированного угля часто назначают при приеме внутрь в качестве адсорбента . [65] Здесь древесный уголь действует как пористое вещество для связывания токсина, предотвращая его всасывание через желудочно-кишечный тракт и увеличивая его выведение из организма через кишечник. Подобные детоксифицирующие адсорбенты также можно добавлять в корм для животных при загрязнении, чтобы снизить биодоступность токсина при употреблении в пищу. Антиоксиданты также полезны для смягчения повреждающего действия трихотеценов в ответ на увеличение количества активных форм кислорода, которые они производят в клетках. В целом считается, что хорошая диета, богатая пробиотиками, витаминами и питательными веществами, белками и липидами, эффективна для уменьшения симптомов отравления трихотеценом. [16] Например, было обнаружено, что витамин Е противодействует образованию перекисей липидов, вызванному токсином Т-2 у кур. [66] Аналогично, совместное добавление модифицированных глюкоманнанов и селена в рационы кур, также потребляющих токсин Т-2, уменьшало вредные эффекты связанного с токсином истощения антиоксидантов в печени. Несмотря на то, что эти антиоксиданты не являются прямым противоядием, они могут иметь решающее значение для снижения тяжести воздействия трихотецена.

Трихотецены – это микотоксины, вырабатываемые плесенью, которая часто загрязняет склады зерновых продуктов. Это делает загрязнение трихотеценом серьезной проблемой общественного здравоохранения, и во многих регионах действуют строгие ограничения на разрешенное содержание трихотецена. Например, в Европейском Союзе разрешено содержание токсина Т-2 только в концентрации 0,025 ppm в хлебобулочных изделиях, предназначенных для потребления человеком. [67] Плесень, которая может производить трихотецены, хорошо растет в темных местах с умеренным климатом и высоким содержанием влаги. Поэтому один из лучших способов предотвратить загрязнение пищевых продуктов трихотеценом — хранить ресурсы в надлежащих условиях, чтобы предотвратить рост плесени. [16] Например, обычно рекомендуется хранить зерно только в помещениях с влажностью менее 15%. [68] Однако, если территория уже была загрязнена трихотеценовыми токсинами, существует множество возможных стратегий дезактивации для предотвращения дальнейшего воздействия. Было показано , что обработка 1% гипохлоритом натрия (NaOCl) в 0,1 М гидроксиде натрия (NaOH) в течение 4–5 часов ингибирует биологическую активность токсина Т-2. [16] Также было показано , что инкубация с водным раствором озона при концентрации примерно 25 частей на миллион приводит к разложению различных трихотеценов по механизму, включающему окисление двойной связи углерода 9, 10. [69] Также было показано, что УФ- воздействие эффективно при правильных условиях. [16]
Помимо стратегий физического и химического обеззараживания, развитие исследований в области молекулярной генетики также привело к появлению потенциала биологического обеззараживания. Многие микробы, включая бактерии, дрожжи и грибы, выработали ферментативные генные продукты, которые способствуют специфическому и эффективному расщеплению трихотеценовых микотоксинов. [68] Многие из этих ферментов специфически разрушают эпоксидное кольцо углерода 12,13, что важно для токсичности трихотеценов. Например, штамм Eubacteria BBSH 797 вырабатывает ферменты деэпоксидазы, которые восстанавливают эпоксидное кольцо углерода 12,13 до группы двойной связи. [68] Их, наряду с другими микробами, проявляющими детоксикационные свойства трихотецена, можно использовать в магазинах кормов для предотвращения токсического воздействия загрязненных кормов при потреблении. [16] Кроме того, молекулярное клонирование генов, ответственных за выработку этих детоксифицирующих ферментов, может быть полезно для производства штаммов сельскохозяйственной продукции, устойчивых к отравлению трихотеценом. [16]
Эпокситрихотецены являются разновидностью вышеперечисленных и когда-то исследовались для военного использования в Восточной Германии и, возможно, во всем советском блоке. [70] После появления симптомов отравления эпокситихотеценом лечение невозможно, хотя последствия могут исчезнуть, не оставляя каких-либо необратимых повреждений.
От планов использования в качестве крупномасштабного биологического оружия отказались, поскольку соответствующие эпокситрихотецены очень быстро разлагаются под воздействием ультрафиолета и тепла, а также под воздействием хлора, что делает их бесполезными для открытых атак и отравления источников воды. [ нужна цитата ]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )