Реакции Фриделя–Крафтса представляют собой набор реакций, разработанных Чарльзом Фриделем и Джеймсом Крафтсом в 1877 году для присоединения заместителей к ароматическому кольцу . [1] Реакции Фриделя–Крафтса бывают двух основных типов: реакции алкилирования и реакции ацилирования . Обе протекают путем электрофильного ароматического замещения . [2] [3] [4] [5]
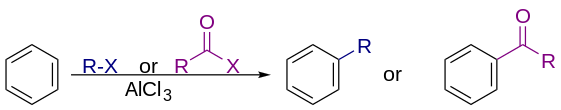
В коммерческих приложениях алкилирующие агенты обычно являются алкенами , некоторые из самых масштабных реакций, практикуемых в промышленности. Такие алкилирования имеют важное промышленное значение, например, для производства этилбензола , предшественника полистирола, из бензола и этилена и для производства кумола из бензола и пропена в кумоловом процессе :
В промышленном производстве в качестве катализатора обычно используются твердые кислоты, полученные из цеолита .
Алкилирование Фриделя-Крафтса включает алкилирование ароматического кольца . Традиционно алкилирующими агентами являются алкилгалогениды . Многие алкилирующие агенты могут быть использованы вместо алкилгалогенидов. Например, еноны и эпоксиды могут быть использованы в присутствии протонов. Реакция обычно использует сильную кислоту Льюиса , такую как хлорид алюминия в качестве катализатора, для увеличения электрофильности алкилирующего агента. [6]
Эта реакция страдает от недостатка, что продукт более нуклеофилен , чем реагент, поскольку алкильные группы являются активаторами для реакции Фриделя-Крафтса . Следовательно, может произойти сверхалкилирование. Однако стерические препятствия могут быть использованы для ограничения числа последовательных циклов алкилирования, которые происходят, как в t -бутилировании 1,4-диметоксибензола, которое дает только продукт двух циклов алкилирования и только с одним из трех возможных изомеров: [7]
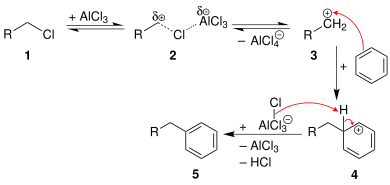
Более того, реакция полезна только для первичных алкилгалогенидов во внутримолекулярном смысле, когда образуется 5- или 6-членное кольцо. Для межмолекулярного случая реакция ограничивается третичными алкилирующими агентами, некоторыми вторичными алкилирующими агентами (теми, для которых перегруппировка карбокатиона вырождена) или алкилирующими агентами, которые дают стабилизированные карбокатионы (например, бензильные или аллильные). В случае первичных алкилгалогенидов карбокатионоподобный комплекс (R (+) ---X---Al (-) Cl 3 ) будет подвергаться реакции перегруппировки карбокатиона , давая почти исключительно перегруппированный продукт, полученный из вторичного или третичного карбокатиона. [8]
Протонирование алкенов приводит к образованию карбокатионов , электрофилов. Лабораторный пример синтеза неофилхлорида из бензола и металлилхлорида с использованием сернокислотного катализатора. [9]
Общий механизм для первичных алкилгалогенидов показан ниже. [8]
Алкилирование Фриделя-Крафтса может быть обратимым . Хотя это обычно нежелательно, его можно использовать; например, облегчая реакции трансалкилирования . [10]

Он также позволяет обратимо добавлять алкильные цепи в качестве защитных групп . Этот подход используется в промышленности при синтезе 4,4'-бифенола через окислительное связывание и последующее деалкилирование 2,6-ди-трет-бутилфенола . [11] [12]
Ацилирование по Фриделю-Крафтсу включает ацилирование ароматических колец. Типичными ацилирующими агентами являются ацилхлориды . Также жизнеспособны ангидриды кислот , а также карбоновые кислоты. Типичным катализатором кислоты Льюиса является трихлорид алюминия . Однако, поскольку полученный кетон образует довольно стабильный комплекс с кислотами Льюиса, такими как AlCl 3 , обычно необходимо использовать стехиометрическое количество или больше «катализатора», в отличие от случая алкилирования по Фриделю-Крафтсу, при котором катализатор постоянно регенерируется. [13] Условия реакции аналогичны алкилированию по Фриделю-Крафтсу. Эта реакция имеет несколько преимуществ по сравнению с реакцией алкилирования. Из-за электроноакцепторного эффекта карбонильной группы продукт кетона всегда менее реакционноспособен, чем исходная молекула, поэтому множественных ацилирований не происходит. Кроме того, не происходит никаких перегруппировок карбкатионов , поскольку ион ацилия стабилизирован резонансной структурой, в которой положительный заряд находится на кислороде.
Жизнеспособность ацилирования Фриделя-Крафтса зависит от стабильности реагента ацилхлорида. Например, формилхлорид слишком нестабилен, чтобы его можно было выделить. Таким образом, синтез бензальдегида по пути Фриделя-Крафтса требует, чтобы формилхлорид был синтезирован in situ . Это достигается с помощью реакции Гаттермана-Коха , которая осуществляется путем обработки бензола оксидом углерода и хлористым водородом под высоким давлением, катализируемой смесью хлорида алюминия и хлорида меди . Простые кетоны, которые могут быть получены ацилированием Фриделя-Крафтса, производятся альтернативными методами, например, окислением, в промышленности.
Реакция протекает через образование ацильного центра. Реакция завершается депротонированием арениевого иона AlCl 4 − , восстанавливая катализатор AlCl 3 . Однако, в отличие от истинно каталитической реакции алкилирования, образующийся кетон является умеренным основанием Льюиса, которое образует комплекс с сильной кислотой Льюиса трихлоридом алюминия. Образование этого комплекса обычно необратимо в условиях реакции. Таким образом, необходимо стехиометрическое количество AlCl 3 . Комплекс разрушается при водной обработке, давая желаемый кетон. Например, классический синтез дезоксибензоина требует 1,1 эквивалента AlCl 3 по отношению к лимитирующему реагенту, фенилацетилхлориду. [14] В некоторых случаях, как правило, когда активировано бензольное кольцо, ацилирование Фриделя-Крафтса также может быть проведено с каталитическими количествами более мягкой кислоты Льюиса (например, солей Zn(II)) или катализатора кислоты Бренстеда с использованием ангидрида или даже самой карбоновой кислоты в качестве ацилирующего агента.
При желании полученный кетон может быть впоследствии восстановлен до соответствующего заместителя алкана либо восстановлением Вольфа-Кишнера , либо восстановлением Клемменсена . Конечный результат такой же, как и при алкилировании Фриделя-Крафтса, за исключением того, что перегруппировка невозможна. [15]
Арены реагируют с некоторыми альдегидами и кетонами с образованием гидроксиалкилированных продуктов, например, в реакции мезитильного производного глиоксаля с бензолом: [16]
Как обычно, альдегидная группа является более реакционноспособным электрофилом, чем феноновая .

Эта реакция связана с несколькими классическими реакциями:
Реакции Фриделя-Крафтса использовались в синтезе нескольких триарилметановых и ксантеновых красителей . [26] Примерами являются синтез тимолфталеина (индикатора pH) из двух эквивалентов тимола и фталевого ангидрида :
Реакция фталевого ангидрида с резорцином в присутствии хлорида цинка дает флуорофор флуоресцеин . Замена резорцина на N,N-диэтиламинофенол в этой реакции дает родамин B :
Синтез Хаворта является классическим методом синтеза полициклических ароматических углеводородов. В этой реакции арен реагирует с янтарным ангидридом , последующий продукт затем восстанавливается либо по Клемменсену , либо по Вольфу-Кишнеру . Наконец, происходит второе ацилирование Фриделя-Крафтса с добавлением кислоты. [27]
Продукт, образующийся в этой реакции, затем аналогичным образом восстанавливается, после чего следует реакция дегидрирования ( например, с реагентом SeO2 ) для расширения ароматической кольцевой системы. [28]
Реакция хлороформа с ароматическими соединениями с использованием катализатора хлорида алюминия дает триарилметаны, которые часто ярко окрашены, как в случае триарилметановых красителей. Это стендовый тест для ароматических соединений. [29]
{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка )