
В молекулярной биологии агрегация белков представляет собой явление, при котором внутренне неупорядоченные или неправильно свернутые белки агрегируют (т. е. накапливаются и слипаются) либо внутри, либо вне клеток. [1] [2] Агрегаты белков участвуют в широком спектре заболеваний, известных как амилоидозы , включая БАС , болезнь Альцгеймера , болезнь Паркинсона и прионные заболевания. [3] [4]
После синтеза белки обычно сворачиваются в определенную трехмерную конформацию , которая является наиболее термодинамически благоприятной : их нативное состояние . [5] Этот процесс сворачивания обусловлен гидрофобным эффектом : тенденцией гидрофобных (боящихся воды) частей белка защищать себя от гидрофильной (любящей воду) среды клетки, погружаясь внутрь белка. Таким образом, внешняя часть белка обычно гидрофильна, тогда как внутренняя часть обычно гидрофобна.
Структуры белков стабилизируются нековалентными взаимодействиями и дисульфидными связями между двумя остатками цистеина . Нековалентные взаимодействия включают ионные взаимодействия и слабые ван-дер-ваальсовы взаимодействия . Ионные взаимодействия образуются между анионом и катионом и образуют солевые мостики , которые помогают стабилизировать белок. Ван-дер-ваальсовы взаимодействия включают неполярные взаимодействия (т. е. лондоновскую дисперсионную силу ) и полярные взаимодействия (т. е. водородные связи , диполь-дипольную связь ). Они играют важную роль во вторичной структуре белка , такой как формирование альфа-спирали или бета-слоя , и третичной структуре. Взаимодействия между аминокислотными остатками в определенном белке очень важны в окончательной структуре этого белка.
Когда происходят изменения в нековалентных взаимодействиях, как это может произойти при изменении аминокислотной последовательности, белок подвержен неправильному сворачиванию или разворачиванию. В этих случаях, если клетка не помогает белку в повторном сворачивании или не разрушает развернутый белок, развернутый/неправильно свернутый белок может агрегировать, в котором открытые гидрофобные части белка могут взаимодействовать с открытыми гидрофобными участками других белков. [6] [7] Существует три основных типа агрегатов белков, которые могут образовываться: аморфные агрегаты, олигомеры и амилоидные фибриллы. [8]
Агрегация белков может происходить по разным причинам. Существует четыре класса, на которые можно разделить эти причины, которые подробно описаны ниже.
Мутации , которые происходят в последовательности ДНК, могут или не могут повлиять на аминокислотную последовательность белка. Когда последовательность затронута, другая аминокислота может изменить взаимодействия между боковыми цепями, которые влияют на сворачивание белка. Это может привести к появлению открытых гидрофобных областей белка, которые агрегируют с тем же неправильно свернутым/развернутым белком или другим белком. [9]
Помимо мутаций в самих затронутых белках, агрегация белков может быть вызвана также косвенно через мутации в белках в регуляторных путях, таких как путь рефолдинга (молекулярные шапероны ) или путь убиквитин-протеасома (убиквитинлигазы). [10] Шапероны помогают в рефолдинге белков, предоставляя безопасную среду для сворачивания белка. Убиквитинлигазы нацеливают белки на деградацию посредством модификации убиквитина. [11]
Агрегация белка может быть вызвана проблемами, которые возникают во время транскрипции или трансляции . Во время транскрипции ДНК копируется в мРНК, образуя цепь пре-мРНК, которая подвергается процессингу РНК для образования мРНК. [12] Во время трансляции рибосомы и тРНК помогают транслировать последовательность мРНК в последовательность аминокислот. [12] Если на любом из этапов возникают проблемы, создавая неправильную цепь мРНК и/или неправильную последовательность аминокислот, это может привести к неправильному сворачиванию белка, что приводит к агрегации белка. [ необходима цитата ]
Экологические стрессы, такие как экстремальные температуры и pH или окислительный стресс , также могут привести к агрегации белков. [13] Одним из таких заболеваний является криоглобулинемия .
Экстремальные температуры могут ослабить и дестабилизировать нековалентные взаимодействия между аминокислотными остатками. Значения pH за пределами диапазона pH белка могут изменить состояние протонирования аминокислот, что может усилить или ослабить нековалентные взаимодействия. Это также может привести к менее стабильным взаимодействиям и вызвать разворачивание белка.
Окислительный стресс может быть вызван радикалами, такими как активные формы кислорода (ROS). Эти нестабильные радикалы могут атаковать аминокислотные остатки, что приводит к окислению боковых цепей (например, ароматических боковых цепей, боковых цепей метионина ) и/или расщеплению полипептидных связей. [14] Это может повлиять на нековалентные взаимодействия, которые удерживают белок вместе правильно, что может вызвать дестабилизацию белка и может привести к его разворачиванию. [13]
У клеток есть механизмы, которые могут повторно сворачивать или разрушать белковые агрегаты. Однако по мере старения клеток эти контрольные механизмы ослабевают, и клетка становится менее способной разрешать агрегаты. [13]
Гипотеза о том, что агрегация белков является причинным процессом старения, теперь может быть проверена, поскольку имеются некоторые модели замедленного старения. Если бы развитие белковых агрегатов было независимым от старения процессом, замедление старения не оказало бы никакого влияния на скорость протеотоксичности с течением времени. Однако, если старение связано со снижением активности защитных механизмов против протеотоксичности, модели медленного старения показали бы снижение агрегации и протеотоксичности. Для решения этой проблемы было проведено несколько анализов токсичности на C. elegans . Эти исследования показали, что снижение активности сигнальной системы инсулина/ИФР (ИИС), известного регуляторного пути старения, защищает от агрегации токсичных белков, связанной с нейродегенерацией. Обоснованность этого подхода была проверена и подтверждена на млекопитающих, поскольку снижение активности сигнального пути ИФР-1 защищало модельных мышей с болезнью Альцгеймера от поведенческих и биохимических нарушений, связанных с этим заболеванием. [15]
Несколько исследований показали, что клеточные реакции на агрегацию белков хорошо регулируются и организованы. Агрегаты белков локализуются в определенных областях клетки, и были проведены исследования этих локализаций у прокариот (E.coli) и эукариот (дрожжи, клетки млекопитающих). [16] С макроскопической точки зрения, трассеры позитронно-эмиссионной томографии используются для определенных неправильно свернувшихся протеинов. [17] Недавно группа исследователей под руководством доктора Алессандро Крими предложила метод машинного обучения для прогнозирования будущего отложения в мозге. [18]
Агрегаты в бактериях асимметрично оказываются на одном из полюсов клетки, «старом полюсе». После деления клетки дочерние клетки со старым полюсом получают белковый агрегат и растут медленнее, чем дочерние клетки без агрегата. Это обеспечивает естественный механизм отбора для уменьшения белковых агрегатов в популяции бактерий. [19]
Большинство белковых агрегатов в клетках дрожжей подвергаются повторной укладке молекулярными шаперонами. Однако некоторые агрегаты, такие как окислительно поврежденные белки или белки, помеченные для деградации, не могут быть повторно уложены. Скорее, есть два отсека, в которых они могут оказаться. Белковые агрегаты могут быть локализованы в отсеке контроля качества Juxtanuclear ( JUNQ ), который находится рядом с ядерной мембраной, или в отложении нерастворимого белка ( IPOD ), рядом с вакуолью в клетках дрожжей. [13] Белковые агрегаты локализуются в JUNQ, когда они убиквитинируются и направляются на деградацию. Агрегированные и нерастворимые белки локализуются в IPOD как более постоянное отложение. Есть доказательства того, что белки здесь могут быть удалены аутофагией. [20] Эти два пути работают вместе, так как белки имеют тенденцию попадать в IPOD, когда протеасомный путь перегружен. [20]
В клетках млекопитающих эти белковые агрегаты называются «агресомами», и они образуются, когда клетка больна. Это происходит потому, что агрегаты имеют тенденцию образовываться, когда в клетке присутствуют гетерологичные белки , которые могут возникнуть, когда клетка мутирует. Различные мутации одного и того же белка могут образовывать агресомы различной морфологии, начиная от диффузного рассеивания растворимых видов до крупных точек, которые, в свою очередь, несут различную патогенность. [21] Убиквитинлигаза E3 способна распознавать неправильно свернутые белки и убиквитинировать их. Затем HDAC6 может связываться с убиквитином и моторным белком динеином , чтобы доставить отмеченные агрегаты в центр организации микротрубочек ( ЦОМТ ). Там они упаковываются в сферу, которая окружает ЦОМТ. Они переносят шапероны и протеасомы и активируют аутофагию. [22]
В клетке есть две основные системы контроля качества белка, которые отвечают за устранение белковых агрегатов. Неправильно свернутые белки могут быть повторно свернуты бишаперонной системой или деградированы убиквитин-протеасомной системой или аутофагией. [23]
Система бишаперонов использует шапероны Hsp70 (DnaK-DnaJ-GrpE в E. coli и Ssa1-Ydj1/Sis1-Sse1/Fe1 в дрожжах) и Hsp100 (ClpB в E. coli и Hsp104 в дрожжах) для дезагрегации и рефолдинга белков. [24]
Hsp70 взаимодействует с белковыми агрегатами и рекрутирует Hsp100. Hsp70 стабилизирует активированный Hsp100. Белки Hsp100 имеют ароматические поровые петли, которые используются для нитевидной активности для распутывания отдельных полипептидов. Эта нитевидная активность может быть инициирована на N-конце, C-конце или в середине полипептида. Полипептид транслоцируется через Hsp100 в ряд этапов, используя АТФ на каждом этапе. [24] Полипептид разворачивается и затем может повторно сворачиваться либо сам по себе, либо с помощью белков теплового шока. [25]
Неправильно свернутые белки могут быть устранены через систему убиквитин-протеасом ( UPS ). Она состоит из пути E1-E2-E3, который убиквитинирует белки, чтобы пометить их для деградации. У эукариот белки деградируют с помощью протеасомы 26S. В клетках млекопитающих лигаза E3, карбоксиконцевой белок, взаимодействующий с Hsp70 (CHIP), нацелена на белки, связанные с Hsp70. У дрожжей лигазы E3 Doa10 и Hrd1 выполняют схожие функции в отношении белков эндоплазматического ретикулума . [26] На молекулярном уровне скорость деградации агрегатов варьируется от белка к белку из-за их различной внутренней среды и, следовательно, различной доступности для молекул протеазы. [27]

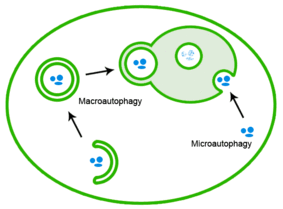
Неправильно свернутые белки также могут быть устранены посредством аутофагии, при которой белковые агрегаты доставляются в лизосому. [26]
Хотя считалось, что зрелые белковые агрегаты сами по себе токсичны, данные свидетельствуют о том, что на самом деле наиболее токсичны незрелые белковые агрегаты. [28] [29] Гидрофобные участки этих агрегатов могут взаимодействовать с другими компонентами клетки и повреждать их. Гипотезы заключаются в том, что токсичность белковых агрегатов связана с механизмами секвестрации клеточных компонентов, генерацией активных форм кислорода и связыванием со специфическими рецепторами в мембране или через разрушение мембран. [30] Количественный анализ был использован для определения того, что виды с более высокой молекулярной массой ответственны за проницаемость мембраны. [31] Известно, что белковые агрегаты in vitro могут дестабилизировать искусственные фосфолипидные бислои , что приводит к проницаемости мембраны. [ необходима цитата ]
Агрегация белков также является распространенным явлением в процессе производства биофармацевтических препаратов и может представлять опасность для пациентов, вызывая неблагоприятные иммунные реакции. [32]