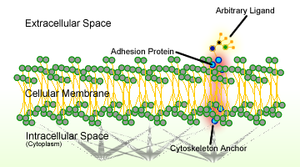
Клеточная адгезия — это процесс, посредством которого клетки взаимодействуют и прикрепляются к соседним клеткам посредством специализированных молекул клеточной поверхности. Этот процесс может происходить либо посредством прямого контакта между клеточными поверхностями, такими как клеточные соединения , либо посредством косвенного взаимодействия, когда клетки прикрепляются к окружающему внеклеточному матриксу , гелеобразной структуре, содержащей молекулы, высвобождаемые клетками в пространства между ними. [1] Клеточная адгезия происходит из-за взаимодействия между молекулами клеточной адгезии (CAM), [2] трансмембранными белками, расположенными на поверхности клетки. Клеточная адгезия связывает клетки различными способами и может участвовать в передаче сигнала для клеток, чтобы обнаруживать и реагировать на изменения в окружающей среде. [1] [3] Другие клеточные процессы, регулируемые клеточной адгезией, включают миграцию клеток и развитие тканей в многоклеточных организмах . [4] Изменения в клеточной адгезии могут нарушить важные клеточные процессы и привести к различным заболеваниям, включая рак [5] [6] и артрит . [7] Клеточная адгезия также необходима для инфекционных организмов, таких как бактерии или вирусы , чтобы вызывать заболевания . [8] [9]

CAM подразделяются на четыре основных семейства: интегрины , суперсемейство иммуноглобулинов (Ig) , кадгерины и селектины . [2] Кадгерины и IgSF являются гомофильными CAM, поскольку они напрямую связываются с тем же типом CAM на другой клетке, в то время как интегрины и селектины являются гетерофильными CAM, которые связываются с разными типами CAM. [2] [ необходима цитата ] Каждая из этих молекул адгезии имеет свою функцию и распознает разные лиганды . Дефекты клеточной адгезии обычно объясняются дефектами экспрессии CAM.
В многоклеточных организмах связи между CAM позволяют клеткам прилипать друг к другу и создают структуры, называемые клеточными соединениями . В соответствии с их функциями клеточные соединения можно классифицировать следующим образом: [1]
С другой стороны, клеточные соединения можно разделить на два основных типа в зависимости от того, что взаимодействует с клеткой: соединения клетка-клетка, в основном опосредованные кадгеринами, и соединения клетка-матрикс, в основном опосредованные интегринами.
Клеточно-клеточные соединения могут встречаться в разных формах. В якорных соединениях между клетками, таких как адгезионные соединения и десмосомы, основными присутствующими CAM являются кадгерины. Это семейство CAM представляет собой мембранные белки, которые опосредуют межклеточную адгезию через свои внеклеточные домены и требуют внеклеточных ионов Ca 2+ для правильного функционирования. [2] Кадгерины образуют гомофильное присоединение между собой, что приводит к слипанию клеток схожего типа и может приводить к избирательной клеточной адгезии, позволяя клеткам позвоночных собираться в организованные ткани. [1] Кадгерины необходимы для межклеточной адгезии и клеточной сигнализации у многоклеточных животных и могут быть разделены на два типа: классические кадгерины и неклассические кадгерины. [2]

Адгезивные соединения в основном функционируют для поддержания формы тканей и удержания клеток вместе. В адгезивных соединениях кадгерины между соседними клетками взаимодействуют через свои внеклеточные домены, которые разделяют консервативную кальций-чувствительную область в своих внеклеточных доменах. Когда эта область вступает в контакт с ионами Ca 2+ , внеклеточные домены кадгеринов претерпевают конформационные изменения от неактивной гибкой конформации к более жесткой конформации, чтобы подвергнуться гомофильному связыванию. Внутриклеточные домены кадгеринов также высококонсервативны, поскольку они связываются с белками, называемыми катенинами , образуя комплексы катенин-кадгерин. Эти белковые комплексы связывают кадгерины с актиновыми нитями . Эта ассоциация с актиновыми нитями необходима для адгезивных соединений для стабилизации межклеточной адгезии. [10] [11] [12] Взаимодействия с актиновыми нитями также могут способствовать кластеризации кадгеринов, которые участвуют в сборке адгезивных соединений. Это происходит потому, что кластеры кадгерина способствуют полимеризации актиновых филаментов , что, в свою очередь, способствует образованию адгезионных соединений путем связывания с комплексами кадгерин-катенин, которые затем образуются в соединении. [ необходима цитата ]
Десмосомы структурно похожи на адгезионные соединения, но состоят из других компонентов. Вместо классических кадгеринов в качестве молекул адгезии действуют неклассические кадгерины, такие как десмоглеины и десмоколлины , и они связаны с промежуточными филаментами вместо актиновых филаментов. [13] В десмосомах катенин отсутствует, поскольку внутриклеточные домены десмосомных кадгеринов взаимодействуют с белками десмосомных бляшек, которые образуют толстые цитоплазматические бляшки в десмосомах и связывают кадгерины с промежуточными филаментами. [14] Десмосомы обеспечивают прочность и устойчивость к механическому напряжению, разгружая силы на гибкие, но упругие промежуточные филаменты, чего не может произойти с жесткими актиновыми филаментами. [13] Это делает десмосомы важными в тканях, которые сталкиваются с высокими уровнями механического напряжения, такими как сердечная мышца и эпителий , и объясняет, почему он часто появляется в этих типах тканей.
Плотные соединения обычно присутствуют в эпителиальных и эндотелиальных тканях, где они запечатывают щели и регулируют парацеллюлярный транспорт растворенных веществ и внеклеточных жидкостей в этих тканях, которые функционируют как барьеры. [15] Плотные соединения образованы трансмембранными белками, включая клаудины , окклюдины и трицеллюлины, которые тесно связываются друг с другом на соседних мембранах гомофильным образом. [1] Подобно якорным соединениям, внутриклеточные домены этих белков плотных соединений связаны с белками-каркасами , которые удерживают эти белки в кластерах и связывают их с актиновыми нитями для поддержания структуры плотного соединения. [16] Клаудины, необходимые для образования плотных соединений, образуют парацеллюлярные поры, которые позволяют избирательно проходить определенным ионам через плотные соединения, делая барьер избирательно проницаемым. [15]

Щелевые контакты состоят из каналов, называемых коннексонами , которые состоят из трансмембранных белков, называемых коннексинами, сгруппированных в группы по шесть. [17] Коннексоны из соседних клеток образуют непрерывные каналы, когда они вступают в контакт и выравниваются друг с другом. Эти каналы позволяют транспортировать ионы и небольшие молекулы между цитоплазмой двух соседних клеток, помимо удержания клеток вместе и обеспечения структурной стабильности, такой как якорные соединения или плотные соединения. [1] Каналы щелевых контактов избирательно проницаемы для определенных ионов в зависимости от того, какие коннексины образуют коннексоны, что позволяет щелевым контактам участвовать в передаче сигналов клетками, регулируя перенос молекул, участвующих в сигнальных каскадах . [18] Каналы могут реагировать на множество различных стимулов и регулируются динамически либо быстрыми механизмами, такими как стробирование напряжения , либо медленными механизмами, такими как изменение количества каналов, присутствующих в щелевых соединениях. [17]
Селектины — это семейство специализированных CAM, участвующих в транзиторной межклеточной адгезии, происходящей в кровеносной системе. Они в основном опосредуют движение белых кровяных клеток (лейкоцитов) в кровотоке, позволяя белым кровяным клеткам «катиться» по эндотелиальным клеткам посредством обратимого связывания селекций. [19] Селектины подвергаются гетерофильным связываниям, поскольку их внеклеточный домен связывается с углеводами на соседних клетках вместо других селектинов, при этом для его функционирования также требуются ионы Ca 2+ , как и кадгеринам. [1] Межклеточная адгезия лейкоцитов к эндотелиальным клеткам важна для иммунных реакций , поскольку лейкоциты могут перемещаться к местам инфекции или травмы с помощью этого механизма. [20] В этих местах интегрины на катящихся белых кровяных клетках активируются и прочно связываются с местными эндотелиальными клетками, позволяя лейкоцитам прекратить миграцию и пересечь эндотелиальный барьер. [20]
Суперсемейство иммуноглобулинов (IgSF) является одним из крупнейших суперсемейств белков в организме и содержит множество разнообразных CAM, участвующих в различных функциях. Эти трансмембранные белки имеют один или несколько доменов, подобных иммуноглобулинам, в своих внеклеточных доменах и подвергаются кальций-независимому связыванию с лигандами на соседних клетках. [21] Некоторые CAM IgSF, такие как молекулы адгезии нейронных клеток (NCAM), могут осуществлять гомофильное связывание, в то время как другие, такие как молекулы адгезии межклеточных клеток (ICAM) или молекулы адгезии сосудистых клеток (VCAM), подвергаются гетерофильному связыванию с молекулами, такими как углеводы или интегрины. [22] Как ICAM, так и VCAM экспрессируются на сосудистых эндотелиальных клетках и взаимодействуют с интегринами на лейкоцитах, способствуя прикреплению лейкоцитов и их перемещению через эндотелиальный барьер. [22]
Клетки создают внеклеточный матрикс, высвобождая молекулы в окружающее его внеклеточное пространство. У клеток есть специфические CAM, которые связываются с молекулами во внеклеточном матриксе и связывают матрикс с внутриклеточным цитоскелетом . [1] Внеклеточный матрикс может выступать в качестве опоры при организации клеток в ткани, а также может участвовать в передаче сигналов клетками, активируя внутриклеточные пути при связывании с CAM. [2] Соединения клетка-матрикс в основном опосредуются интегринами, которые также кластеризуются, как кадгерины, образуя прочные адгезии. Интегрины представляют собой трансмембранные гетеродимеры, образованные различными субъединицами α и β, обе субъединицы имеют различную структуру доменов. [23] Интегрины могут передавать сигналы в обоих направлениях: сигнализация изнутри наружу, внутриклеточные сигналы, модифицирующие внутриклеточные домены, могут регулировать сродство интегринов к их лигандам, в то время как сигнализация снаружи внутрь, внеклеточные лиганды, связывающиеся с внеклеточными доменами, могут вызывать конформационные изменения в интегринах и инициировать каскады сигнализации. [23] Внеклеточные домены интегринов могут связываться с различными лигандами посредством гетерофильного связывания, в то время как внутриклеточные домены могут быть связаны либо с промежуточными филаментами, образуя гемидесмосомы, либо с актиновыми филаментами, образуя фокальные адгезии . [24]

В гемидесмосомах интегрины прикрепляются к белкам внеклеточного матрикса, называемым ламининами, в базальной пластинке , которая представляет собой внеклеточный матрикс, секретируемый эпителиальными клетками. [1] Интегрины связывают внеклеточный матрикс с кератиновыми промежуточными филаментами, которые взаимодействуют с внутриклеточным доменом интегринов через адаптерные белки, такие как плектины и BP230. [25] Гемидесмосомы играют важную роль в поддержании структурной стабильности эпителиальных клеток, косвенно связывая их вместе через внеклеточный матрикс.
В очаговых спайках интегрины прикрепляют фибронектины , компонент внеклеточного матрикса, к актиновым нитям внутри клеток. [24] Адаптерные белки, такие как талины , винкулины , α-актинины и филамины , образуют комплекс во внутриклеточном домене интегринов и связываются с актиновыми нитями. [26] Этот многобелковый комплекс, связывающий интегрины с актиновыми нитями, важен для сборки сигнальных комплексов, которые действуют как сигналы для роста клеток и подвижности клеток. [26]
Клетки растений плотно прилегают друг к другу и соединяются посредством плазмодесм — каналов, которые пересекают стенки растительных клеток и соединяют цитоплазму соседних растительных клеток. [27] Молекулы, которые являются либо питательными веществами, либо сигналами, необходимыми для роста, транспортируются, пассивно или избирательно, между растительными клетками через плазмодесмы. [27]
Простейшие экспрессируют несколько молекул адгезии с различной специфичностью, которые связываются с углеводами, расположенными на поверхности их клеток-хозяев. [28] Межклеточная адгезия является ключом к прикреплению патогенных простейших и проникновению в их клетки-хозяева. Примером патогенного простейшего является малярийный паразит ( Plasmodium falciparum ), который использует одну молекулу адгезии, называемую циркумспорозоитным белком, для связывания с клетками печени, [29] и другую молекулу адгезии, называемую мерозоитным поверхностным белком, для связывания эритроцитов . [30]
Патогенные грибы используют молекулы адгезии, присутствующие на их клеточной стенке, для прикрепления посредством белок-белковых или белок-углеводных взаимодействий к клеткам-хозяевам [31] или фибронектинам во внеклеточном матриксе. [32]
Прокариоты имеют молекулы адгезии на поверхности своих клеток, называемые бактериальными адгезинами , помимо использования своих пилей ( фимбрий ) и жгутиков для клеточной адгезии. [8] Прокариоты могут иметь один или несколько жгутиков, расположенных либо в одном, либо в нескольких местах на поверхности клетки. Патогенные виды, такие как Escherichia coli и Vibrio cholera, обладают жгутиками для облегчения адгезии. [33]
Адгезины могут распознавать различные лиганды, присутствующие на поверхности клеток хозяина, а также компоненты внеклеточного матрикса. Эти молекулы также контролируют специфичность хозяина и регулируют тропизм (ткане- или клеточно-специфические взаимодействия) посредством взаимодействия со своими лигандами. [34]
Вирусы также имеют молекулы адгезии, необходимые для связывания вируса с клетками хозяина. Например, вирус гриппа имеет гемагглютинин на своей поверхности, который необходим для распознавания сахарной сиаловой кислоты на молекулах поверхности клетки хозяина. [35] ВИЧ имеет молекулу адгезии, называемую gp120 , которая связывается со своим лигандом CD4 , который экспрессируется на лимфоцитах . [36] Вирусы также могут нацеливаться на компоненты клеточных соединений, чтобы проникнуть в клетки хозяина, что и происходит, когда вирус гепатита С нацеливается на окклюдины и клаудины в плотных соединениях, чтобы проникнуть в клетки печени. [9]
Дисфункция клеточной адгезии происходит во время метастазирования рака . Потеря межклеточной адгезии в метастатических опухолевых клетках позволяет им покидать место своего происхождения и распространяться по кровеносной системе. [5] Одним из примеров CAM, нерегулируемых при раке, являются кадгерины, которые инактивируются либо генетическими мутациями, либо другими онкогенными сигнальными молекулами, что позволяет раковым клеткам мигрировать и становиться более инвазивными. [6] Другие CAM, такие как селектины и интегрины, могут способствовать метастазированию, опосредуя межклеточные взаимодействия между мигрирующими метастатическими опухолевыми клетками в кровеносной системе с эндотелиальными клетками других отдаленных тканей. [37] Из-за связи между CAM и метастазами рака эти молекулы могут быть потенциальными терапевтическими мишенями для лечения рака.
Существуют также другие генетические заболевания человека, вызванные неспособностью экспрессировать специфические молекулы адгезии. Примером является дефицит адгезии лейкоцитов -I (LAD-I), при котором экспрессия субъединицы β 2 интегрина снижается или теряется. [38] Это приводит к снижению экспрессии гетеродимеров β 2 интегрина, которые необходимы лейкоцитам для прочного прикрепления к эндотелиальной стенке в местах воспаления с целью борьбы с инфекциями. [39] Лейкоциты у пациентов с LAD-I не способны прилипать к эндотелиальным клеткам, и у пациентов наблюдаются серьезные эпизоды инфекции , которые могут быть опасны для жизни.
Аутоиммунное заболевание , называемое пузырчаткой, также вызывается потерей клеточной адгезии, поскольку оно возникает из-за того, что аутоантитела воздействуют на собственные десмосомальные кадгерины человека, что приводит к отслоению эпидермальных клеток друг от друга и образованию волдырей на коже. [40]
Патогенные микроорганизмы, включая бактерии, вирусы и простейшие, должны сначала прикрепиться к клеткам-хозяевам, чтобы заразить и вызвать заболевания. Антиадгезивная терапия может использоваться для предотвращения инфекции путем воздействия на молекулы адгезии либо на патоген, либо на клетку-хозяина. [41] Помимо изменения продукции молекул адгезии, также могут использоваться конкурентные ингибиторы, которые связываются с молекулами адгезии, чтобы предотвратить связывание между клетками, действуя как антиадгезивные агенты. [42]
{{cite book}}: |journal=проигнорировано ( помощь )