Альдольная конденсация — это реакция конденсации в органической химии , в которой два карбонильных фрагмента ( альдегидов или кетонов ) реагируют с образованием β-гидроксиальдегида или β-гидроксикетона ( альдольная реакция ), а затем следует дегидратация с образованием сопряженного енона . .
Общее уравнение реакции выглядит следующим образом (где Rs может быть H):
Альдольные конденсации важны в органическом синтезе и биохимии как способ образования углерод-углеродных связей . [2] [3] [4] [5]
В своей обычной форме он включает нуклеофильное присоединение енолята кетона к альдегиду с образованием β-гидроксикетона или альдола ( альдегид + спирт ) , структурной единицы, встречающейся во многих природных молекулах и фармацевтических препаратах . [6] [7] [8]

Термин «альдольная конденсация» также широко используется, особенно в биохимии , для обозначения только первой стадии (присоединения) процесса — самой альдольной реакции — катализируемой альдолазами . Однако формально первый шаг представляет собой реакцию присоединения , а не реакцию конденсации, поскольку он не предполагает потери небольшой молекулы.
Первая часть этой реакции — реакция Альдоля , вторая часть — реакция дегидратации — реакция элиминирования (включает удаление молекулы воды или молекулы спирта ). Дегидратация может сопровождаться декарбоксилированием при наличии активированной карбоксильной группы. Продукт присоединения альдола может быть дегидратирован по двум механизмам; сильное основание, такое как трет - бутоксид калия , гидроксид калия или гидрид натрия, депротонирует продукт до енолята , который удаляется по механизму E1cB , [9] [10] , в то время как дегидратация в кислоте протекает по механизму реакции E1 . В зависимости от природы желаемого продукта альдольную конденсацию можно проводить в двух широких типах условий: кинетическом контроле или термодинамическом контроле . [11] И кетоны, и альдегиды подходят для реакций альдольной конденсации. В приведенных ниже примерах используются альдегиды.


Скрещенная альдольная конденсация является результатом альдольной конденсации двух разнородных карбонильных соединений, содержащих α-водород(ы). Обычно это приводит к образованию четырех возможных продуктов, поскольку любое карбонильное соединение может действовать как нуклеофил и возможна самоконденсация, что делает смесь синтетически бесполезной. Однако этой проблемы можно избежать, если одно из соединений не содержит α-водород, что делает его неенолизируемым. При альдольной конденсации между альдегидом и кетоном кетон действует как нуклеофил, так как его карбонильный углерод не обладает высоким электрофильным характером из-за эффекта +I и стерических затруднений . Обычно скрещенное произведение является старшим. Любые следы самоальдольного продукта из альдегида можно исключить, сначала приготовив смесь подходящего основания и кетона, а затем медленно добавляя альдегид к указанной реакционной смеси. Использование слишком концентрированной основы может привести к конкурирующей реакции Канниццаро . [12]
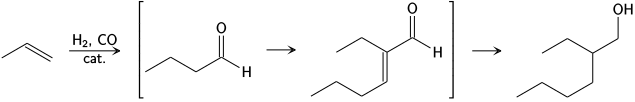
Процесс Aldox , разработанный Royal Dutch Shell и Exxon , преобразует пропен и синтез-газ в 2-этилгексанол посредством гидроформилирования в бутиральдегид , альдольной конденсации в 2-этилгексеналь и, наконец, гидрирования . [13]
Пентаэритрит производится в больших масштабах, начиная с перекрестно-альдольной конденсации ацетальдегида и трех эквивалентов формальдегида с образованием пентаэритрозы, которая далее восстанавливается в реакции Канниццаро . [14]

Этил-2-метилацетоацетат и камфоленовый альдегид реагируют в результате альдольной конденсации. [15] Методика синтеза [16] типична для этого типа реакций. При этом, помимо воды, при декарбоксилировании теряется эквивалент этанола и углекислого газа .

Этилглиоксилат 2 и глутаконат (диэтил-2-метилпент-2-ендиоат) 1 реагируют с изопренетрикарбоновой кислотой 3 ( изопреновый (2-метилбута-1,3-диеновый) скелет) с этоксидом натрия . Этот продукт реакции очень нестабилен, с первоначальной потерей углекислого газа и последующим множеством вторичных реакций. Считается, что это происходит из-за стерического напряжения , возникающего из-за метильной группы и карбоксильной группы в цис -диеноидной структуре. [17]

Иногда альдольная конденсация скрывается в многостадийной реакции или каталитическом цикле , как в следующем примере: [18]
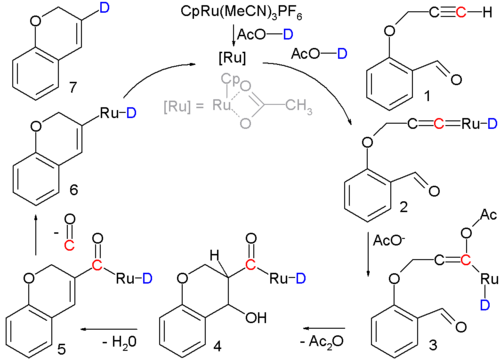
В этой реакции алкиналь 1 превращается в циклоалкен 7 с помощью рутениевого катализатора, и происходит фактическая конденсация с промежуточными соединениями 3-5 . Подтверждение механизма реакции основано на мечении изотопов . [б]
Реакция между ментоном ((2S , 5R ) -2-изопропил-5-метилциклогексаноном) и анисальдегидом (4-метоксибензальдегидом) затруднена из-за стерического экранирования кетоновой группы. Это препятствие преодолевается за счет использования сильного основания, такого как гидроксид калия , и очень полярного растворителя, такого как ДМСО, в реакции, представленной ниже: [19]

Продукт может эпимеризоваться с помощью обычного промежуточного продукта — енолята А — для превращения исходного ( S , R ) и ( R , R ) эпимеров. Продукт ( R , R ) нерастворим в растворителе реакции, тогда как ( S , R ) растворим. Осаждение продукта ( R , R ) запускает равновесную реакцию эпимеризации , в результате которой он становится основным продуктом.
Существуют и другие реакции карбонильных соединений, аналогичные альдольной конденсации: