Ацетилацетон — органическое соединение с химической формулой CH 3 −C(=O)−CH 2 −C(=O)−CH 3 . Он классифицируется как 1,3- дикетон . Он существует в равновесии с таутомером CH 3 −C(=O)−CH=C(−OH)−CH 3 . Смесь представляет собой бесцветную жидкость. Эти таутомеры взаимопревращаются так быстро в большинстве условий, что в большинстве приложений их рассматривают как единое соединение. [2] Ацетилацетон является строительным блоком для синтеза многих координационных комплексов , а также гетероциклических соединений .
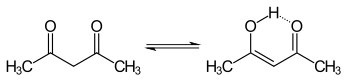
Кето- и енольные таутомеры ацетилацетона сосуществуют в растворе. Енольная форма имеет симметрию C2v , что означает, что атом водорода делится поровну между двумя атомами кислорода. [4] В газовой фазе константа равновесия , K кето→енол , составляет 11,7, что благоприятствует енольной форме. Две таутомерные формы можно различить с помощью ЯМР-спектроскопии , ИК-спектроскопии и других методов. [5] [6]
Константа равновесия имеет тенденцию быть высокой в неполярных растворителях; когда K кето→енол равен или больше 1, форма енола является предпочтительной. Форма кето становится более предпочтительной в полярных растворителях с водородными связями, таких как вода. [7] Форма енола является винилогическим аналогом карбоновой кислоты . [ требуется цитата ]
Ацетилацетон — слабая кислота . Образует анион ацетилацетоната C5H7O .−2(обычно сокращенно acac − ):

В ацетилацетонат-анионе обе связи C - O эквивалентны. Обе центральные связи CC также эквивалентны, при этом один атом водорода связан с центральным атомом углерода ( атом C3 ). Эти две эквивалентности обусловлены тем, что существует резонанс между четырьмя связями в связи O-C2-C3-C4-O в ацетилацетонат-анионе, где порядок связи этих четырех связей составляет около 1,5. Оба атома кислорода в равной степени разделяют отрицательный заряд . Ацетилацетонат-анион является бидентатным лигандом .
Рекомендованные ИЮПАК значения p K a для этого равновесия в водном растворе при 25 °C составляют 8,99 ± 0,04 ( I = 0), 8,83 ± 0,02 ( I = 0,1 M NaClO 4 ) и 9,00 ± 0,03 ( I = 1,0 M NaClO 4 ; I = ионная сила ). [9] Значения для смешанных растворителей доступны. Очень сильные основания , такие как литийорганические соединения, будут депротонировать ацетилацетон дважды. Полученные дилитиевые виды затем могут быть алкилированы по атому углерода в положении 1 .
Ацетилацетон получают в промышленности путем термической перегруппировки изопропенилацетата . [10]
Лабораторные пути получения ацетилацетона также начинаются с ацетона . Ацетон и уксусный ангидрид ( (CH 3 C(O)) 2 O ) при добавлении катализатора трифторида бора ( BF 3 ): [11]
Второй синтез включает конденсацию, катализируемую основанием (например, этоксидом натрия CH 3 CH 2 O − Na + ) ацетона и этилацетата с последующим подкислением ацетилацетоната натрия (например, хлористым водородом HCl): [11]
Из-за простоты этих синтезов известны многие аналоги ацетилацетонатов. Некоторые примеры — бензоилацетон , дибензоилметан (dbaH) [ необходимо разъяснение ] и трет- бутиловый аналог 2,2,6,6-тетраметил-3,5-гептандион. Трифторацетилацетон и гексафторацетилацетонат также используются для получения летучих комплексов металлов .
Ацетилацетон является универсальным бифункциональным предшественником гетероциклов, поскольку обе кетогруппы могут подвергаться конденсации . Например, конденсация с гидразином дает пиразолы , а конденсация с мочевиной дает пиримидины . Конденсация с двумя арил- или алкиламинами дает NacNac , в которых атомы кислорода в ацетилацетоне заменяются на NR (R = арил, алкил).

Ацетилацетонат натрия , Na(acac), является предшественником многих ацетилацетонатных комплексов . Общий метод синтеза заключается в обработке соли металла ацетилацетоном в присутствии основания : [ 12]
Оба атома кислорода связываются с металлом, образуя шестичленное хелатное кольцо. В некоторых случаях хелатный эффект настолько силен, что для образования комплекса не требуется добавления основания.
Фермент ацетилацетондиоксигеназа расщепляет углерод-углеродную связь ацетилацетона, образуя ацетат и 2-оксопропаналь . Фермент зависит от железа (II) , но доказано, что он также связывается с цинком . Распад ацетилацетона был охарактеризован в бактерии Acinetobacter johnsonii . [13]