Bacillus anthracis — грамположительная палочковидная бактерия , вызывающая сибирскую язву — смертельное заболевание домашнего скота, а иногда и человека. Это единственный постоянный ( облигатный ) возбудитель рода Bacillus . Его заражение является разновидностью зооноза , так как передается от животных к человеку. [1] Он был открыт немецким врачом Робертом Кохом в 1876 году и стал первой бактерией, экспериментально продемонстрированной как патоген. Это открытие стало также первым научным доказательством микробной теории болезней . [2]
B. anthracis имеет длину от 3 до 5 мкм и ширину от 1 до 1,2 мкм. Эталонный геном состоит из кольцевой хромосомы длиной 5 227 419 п.н. и двух внехромосомных ДНК- плазмид , pXO1 и pXO2, длиной 181 677 и 94 830 п.н. соответственно [3] , которые ответственны за патогенность. Он образует защитный слой, называемый эндоспорой , благодаря которому может оставаться неактивным в течение многих лет и внезапно становится инфекционным при подходящих условиях окружающей среды. Благодаря устойчивости эндоспор бактерия является одним из самых популярных видов биологического оружия . Белковая капсула (поли-D-гамма-глутаминовая кислота) является ключом к уклонению от иммунного ответа. Он питается гемом белка крови гемоглобина, используя два секреторных белка- сидерофора , IsdX1 и IsdX2.

Без лечения инфекция B. anthracis обычно смертельна. На инфекцию указывают воспалительные, черные, некротические поражения ( струпы ). Язвы обычно появляются на лице, шее, руках или кистях. Фатальные симптомы включают гриппоподобную лихорадку, дискомфорт в груди, потливость (чрезмерное потоотделение) и боли в теле. Первая вакцина против сибирской язвы для животных была разработана французским химиком Луи Пастером в 1881 году. В настоящее время доступны различные вакцины для животных и человека. Инфекцию можно лечить обычными антибиотиками, такими как пенициллины , хинолоны и тетрациклины .

B. anthracis представляют собой палочковидные бактерии длиной примерно от 3 до 5 мкм и шириной от 1 до 1,2 мкм. [4] При выращивании в культуре они имеют тенденцию образовывать длинные цепочки бактерий. На чашках с агаром они образуют большие колонии диаметром несколько миллиметров, обычно белого или кремового цвета. [4] Большинство штаммов B. anthracis образуют капсулу , которая придает колониям слизистый вид, похожий на слизь. [4]
Это одна из немногих бактерий, которые, как известно, синтезируют слабоиммуногенную и антифагоцитарную белковую капсулу (поли-D-гамма-глутаминовую кислоту), которая маскирует вегетативную бактерию от иммунной системы хозяина. [5] Большинство бактерий окружены полисахаридной капсулой, а не поли-gD-глутаминовой кислотой, что обеспечивает эволюционное преимущество B. anthracis . Полисахариды связаны с адгезией дефензинов , секретируемых нейтрофилами , которые инактивируют и разрушают бактерии. Не содержащая эту макромолекулу в капсуле, B. anthracis может избежать нейтрофильной атаки и продолжить распространение инфекции. Разница в составе капсул также значительна, поскольку предполагалось, что поли-gD-глутаминовая кислота создает отрицательный заряд, который защищает вегетативную фазу бактерий от фагоцитоза макрофагов . [6] Капсула разлагается до более низкой молекулярной массы и высвобождается с поверхности бактериальных клеток, действуя как приманка для защиты бактерий от комплемента . [7]
Подобно Bordetella pertussis , он образует кальмодулин -зависимый экзотоксин аденилатциклазы, известный как фактор отека сибирской язвы , наряду с летальным фактором сибирской язвы . Он имеет близкое генотипическое и фенотипическое сходство с Bacillus cereus и Bacillus thuringiensis . Все три вида имеют общие размеры и морфологию клеток . Все образуют овальные споры , расположенные в центре ненабухшего спорангия . Эндоспоры B. anthracis , в частности, обладают высокой устойчивостью, выдерживают экстремальные температуры, среду с низким содержанием питательных веществ и суровую химическую обработку на протяжении десятилетий или столетий. [ нужна цитата ]
Эндоспора представляет собой обезвоженную клетку с толстыми стенками и дополнительными слоями, образующимися внутри клеточной мембраны. Он может оставаться неактивным в течение многих лет, но если попадает в благоприятную среду, то снова начинает расти. Первоначально он развивается внутри палочковидной формы. Такие особенности, как расположение внутри палочки, размер и форма эндоспоры, а также то, вызывает ли это выпячивание стенки палочки, характерны для определенных видов Bacillus . В зависимости от вида эндоспоры имеют круглую, овальную или иногда цилиндрическую форму. Они обладают высокой преломляемостью и содержат дипиколиновую кислоту . Срезы электронных микрофотографий показывают, что они имеют тонкую внешнюю оболочку эндоспор, толстую кору спор и внутреннюю споровую мембрану, окружающую содержимое эндоспор. Эндоспоры устойчивы к теплу, высыханию и воздействию многих дезинфицирующих средств (включая 95% этанол). [8] Благодаря этим свойствам эндоспоры B. anthracis чрезвычайно хорошо подходят для использования (в порошкообразной и аэрозольной форме) в качестве биологического оружия . Подобная вепонизация осуществлялась в прошлом как минимум пятью государственными программами по биологическому оружию – программами Великобритании , Японии , США , России и Ирака – а также предпринимались попытки нескольких других. [9]
B. anthracis имеет одну хромосому, которая представляет собой кольцевую молекулу ДНК длиной 5 227 293 п.н. [10] Он также имеет две кольцевые внехромосомные двухцепочечные ДНК-плазмиды, pXO1 и pXO2. Плазмиды pXO1 и pXO2 необходимы для полной вирулентности и представляют два разных семейства плазмид. [11]
Плазмида pXO1 (182 т.п.н.) содержит гены, кодирующие компоненты сибиреязвенного токсина : pag (защитный антиген, PA), lef (летальный фактор, LF) и cya (фактор отека, EF). Эти факторы содержатся в острове патогенности (PAI) размером 44,8 т.п.н. Летальный токсин представляет собой комбинацию PA с LF, а отечный токсин представляет собой комбинацию PA с EF. PAI также содержит гены, которые кодируют активатор транскрипции AtxA и репрессор PagR, оба из которых регулируют экспрессию генов токсина сибирской язвы. [11]
pXO2 кодирует пятигенный оперон ( capBCADE ), который синтезирует капсулу поли-γ-D-глутаминовой кислоты (полиглутамата). Эта капсула позволяет B. anthracis уклоняться от иммунной системы хозяина, защищая себя от фагоцитоза . Экспрессия капсульного оперона активируется регуляторами транскрипции AcpA и AcpB, расположенными на острове патогенности pXO2 (35 т.п.н.). Экспрессия AcpA и AcpB находится под контролем AtxA из pXO1. [11]
К 89 известным штаммам B. anthracis относятся:
Полногеномное секвенирование сделало реконструкцию филогении B. anthracis чрезвычайно точной. Фактором, способствующим реконструкции, является мономорфность B. anthracis , что означает низкое генетическое разнообразие, включая отсутствие какого-либо измеримого латерального переноса ДНК с момента его возникновения как вида. Отсутствие разнообразия связано с короткой эволюционной историей, которая препятствовала мутационному насыщению однонуклеотидных полиморфизмов . [13]
Короткое эволюционное время не обязательно означает короткое хронологическое время. При репликации ДНК возникают ошибки, которые становятся генетическими мутациями. Накопление этих мутаций с течением времени приводит к эволюции вида. В течение жизненного цикла B. anthracis он проводит значительное количество времени на стадии почвенного резервуара спор, на которой репликация ДНК не происходит. Эти длительные периоды покоя значительно снизили скорость эволюции организма. [13]
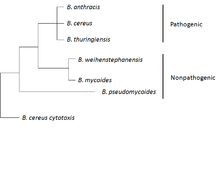
B. anthracis принадлежит к группе B. cereus , состоящей из штаммов: B. cereus , B. anthracis , B. thuringiensis , B. mycoides и B. pseudomycoides . Первые три штамма являются патогенными или условно-патогенными для насекомых и млекопитающих, а последние три не считаются патогенными. Штаммы этой группы в целом генетически и фенотипически гетерогенны, но некоторые из штаммов более тесно связаны и филогенетически перемешаны на хромосомном уровне. Группа B. cereus обычно имеет сложные геномы и большинство из них несут различное количество плазмид. [11]
B. cereus — почвенная бактерия, которая может колонизировать кишечник беспозвоночных в качестве симбионта [14] и является частой причиной пищевых отравлений [15]. Она продуцирует рвотный токсин, энтеротоксины и другие факторы вирулентности. [16] Энтеротоксины и факторы вирулентности кодируются на хромосоме, тогда как рвотный токсин кодируется на плазмиде pCER270 размером 270 т.п.н. [11]
B. thuringiensis является микроорганизмом-возбудителем и характеризуется продукцией параспоральных кристаллов инсектицидных токсинов Cry и Cyt. [17] Гены, кодирующие эти белки, обычно расположены на плазмидах, которые могут быть потеряны из организма, что делает его неотличимым от B. cereus . [11]
Филогеномный анализ клады Cereus в сочетании с анализом средней нуклеотидной идентичности (ANI) показал, что виды B. anthracis также включают штаммы, обозначенные как B. cereus и B. thuringiensis. [18]
PlcR является глобальным регулятором транскрипции, который контролирует большинство секретируемых факторов вирулентности у B. cereus и B. thuringiensis . Он кодируется хромосомами и присутствует повсеместно в клетке. [19] Однако у B. anthracis ген plcR содержит единственное изменение основания в положении 640, нонсенс-мутацию, которая создает дисфункциональный белок. Хотя 1% группы B. cereus несет инактивированный ген plcR , ни один из них не несет специфической мутации, обнаруженной только у B. anthracis . [20]
Ген plcR является частью двухгенного оперона с papR . [21] [22] Ген papR кодирует небольшой белок, который секретируется из клетки, а затем реимпортируется в виде процессированного гептапептида, образующего систему определения кворума. [22] [23] Отсутствие PlcR у B. anthracis является основной характеристикой, отличающей его от других членов группы B. cereus . В то время как экспрессия факторов вирулентности B. cereus и B. thuringiensis зависит от гена plcR , вирулентность B. anthracis зависит от плазмид pXO1 и pXO2. [11] Bacillus cereus biovar anthracis , то есть B. cereus с двумя плазмидами, также способен вызывать сибирскую язву.
B. anthracis обладает антифагоцитарной капсулой, необходимой для полной вирулентности. Организм также вырабатывает три экзотоксина, кодируемых плазмидами: фактор отека, кальмодулин-зависимую аденилатциклазу, которая вызывает повышение внутриклеточного цАМФ и ответственна за тяжелые отеки, обычно наблюдаемые при инфекциях B. anthracis , летальный токсин, вызывающий некроз тканей, и защитный антиген, названный так из-за его использования в производстве защитных вакцин против сибирской язвы, который опосредует проникновение в клетки фактора отека и летального токсина. [ нужна цитата ]
Симптомы сибирской язвы зависят от типа инфекции и могут проявиться от 1 дня до более 2 месяцев. Все виды сибирской язвы, если их не лечить, могут распространиться по всему организму и вызвать тяжелое заболевание и даже смерть. [24]
Выделяют четыре формы сибирской язвы человека в зависимости от их входных ворот.
Ряд вакцин против сибирской язвы был разработан для профилактического применения у домашнего скота и людей. Адсорбированная вакцина против сибирской язвы (AVA) может защитить от кожной и ингаляционной формы сибирской язвы. Однако эта вакцина используется только для взрослых из группы риска до заражения сибирской язвой и не одобрена для использования после заражения. [25] Инфекции, вызванные B. anthracis, можно лечить с помощью β-лактамных антибиотиков , таких как пенициллин , и других, которые активны против грамположительных бактерий. [26] Устойчивый к пенициллину B. anthracis можно лечить фторхинолонами , такими как ципрофлоксацин , или антибиотиками тетрациклинового ряда, такими как доксициклин . [ нужна цитата ]
Компоненты чая , такие как полифенолы , обладают способностью значительно ингибировать активность как B. anthracis , так и его токсина; споры, однако, не затрагиваются. Добавление молока в чай полностью подавляет его антибактериальную активность в отношении сибирской язвы. [27] Лабораторная активность против B. anthracis не доказывает , что употребление чая влияет на течение инфекции, поскольку неизвестно, как эти полифенолы всасываются и распределяются в организме. B. anthracis можно культивировать на агаре PLET, селективной и дифференциальной среде, предназначенной специально для отбора B. anthracis .
Достижения в методах генотипирования привели к улучшению генетического анализа изменчивости и родства. Эти методы включают анализ тандемных повторов с переменным числом множественных локусов ( MLVA ) и системы типирования с использованием канонических однонуклеотидных полиморфизмов . Предковая хромосома Эймса была секвенирована в 2003 году [10] и способствует идентификации генов, участвующих в вирулентности B. anthracis . Недавно изолят B. anthracis H9401 был выделен от корейского пациента, страдающего желудочно-кишечной сибирской язвой. Цель Республики Корея — использовать этот штамм в качестве контрольного штамма для разработки рекомбинантной вакцины против сибирской язвы. [12]
Штамм H9401, выделенный в Республике Корея, был секвенирован с использованием технологии 454 GS-FLX и проанализирован с использованием нескольких инструментов биоинформатики для сопоставления, аннотирования и сравнения H9401 с другими штаммами B. anthracis . Уровень покрытия секвенирования предполагает молекулярное соотношение pXO1:pXO2:хромосома как 3:2:1, что идентично штаммам Ames Florida и Ames Ancestor. H9401 имеет 99,679% гомологию последовательности с Ames Ancestor с гомологией аминокислотной последовательности 99,870%. H9401 имеет кольцевую хромосому (5 218 947 п.н. с 5 480 предсказанными ORF ), плазмиду pXO1 (181 700 п.н. с 202 предсказанными ORF) и плазмиду pXO2 (94 824 п.н. с 110 предсказанными ORF). [12] По сравнению с хромосомой предка Эймса, описанной выше, хромосома H9401 примерно на 8,5 т.п.н. меньше. Благодаря высокой патогенности и сходству последовательностей с предком Эймса, H9401 будет использоваться в качестве эталона для тестирования эффективности вакцин-кандидатов против сибирской язвы в Республике Корея. [12]
Поскольку геном B. anthracis был секвенирован, предпринимаются попытки альтернативных способов борьбы с этим заболеванием. Бактерии разработали несколько стратегий, позволяющих избежать распознавания иммунной системой. Преобладающим механизмом уклонения от обнаружения, используемым всеми бактериями, является молекулярный камуфляж. Небольшие модификации внешнего слоя делают бактерии практически невидимыми для лизоцимов. [28] Три из этих модификаций были идентифицированы и охарактеризованы. К ним относятся (1) N-гликозилирование N-ацетилмурамовой кислоты, (2) O-ацетилирование N-ацетилмурамовой кислоты и (3) N-деацетилирование N-ацетилглюкозамина. Исследования последних нескольких лет были сосредоточены на подавлении таких модификаций. [29] В результате исследуется ферментативный механизм полисахариддеацетилаз, которые катализируют удаление ацетильной группы из N-ацетилглюкозамина и N-ацетилмурамовой кислоты, компонентов пептидогликанового слоя. [ нужна цитата ]
Как и большинству других патогенных бактерий, B. anthracis должен приобретать железо, чтобы расти и размножаться в среде хозяина. Наиболее доступными источниками железа для патогенных бактерий являются гемовые группы, используемые хозяином при транспортировке кислорода. Чтобы удалить гем из гемоглобина и миоглобина хозяина , B. anthracis использует два секреторных белка- сидерофора , IsdX1 и IsdX2. Эти белки могут отделять гем от гемоглобина, позволяя поверхностным белкам B. anthracis транспортировать его в клетку. [30]
B. anthracis должен уклоняться от иммунной системы, чтобы успешно заразиться. Споры B. anthracis сразу же фагоцитируются макрофагами и дендритными клетками после попадания в хозяина. Дендритные клетки могут контролировать инфекцию посредством эффективной внутриклеточной элиминации, но макрофаги могут транспортировать бактерии непосредственно внутрь хозяина, пересекая тонкий слой эпителиальных или эндотелиальных клеток и достигая системы кровообращения. [31] Обычно в процессе фагоцитоза возбудитель переваривается после интернализации макрофагами. Однако вместо того, чтобы разлагаться, споры сибирской язвы нарушают функцию макрофагов, уклоняясь от распознавания иммунной системой хозяина. Фагоцитоз спор B. anthracis начинается при взаимодействии трансмембранных рецепторов на внеклеточной мембране фагоцита с молекулой на поверхности споры. CD14, внеклеточный белок, внедренный в мембрану хозяина, связывается с остатками рамнозы BclA, гликопротеина экзоспория B. anthracis , что способствует активации интегрина Mac-1 изнутри наружу , усиливая интернализацию спор макрофагами. Этот каскад приводит к фагоцитарной клеточной активации и индукции воспалительной реакции. [32]
Присутствие B. anthracis можно определить по пробам, взятым с непористых поверхностей.

Французский врач Казимир Давен (1812-1882) доказал, что симптомы сибирской язвы неизменно сопровождались микробом B. anthracis . [33] Открытие приписывают немецкому врачу Алоису Поллендеру (1799–1879). B. anthracis была первой бактерией, вызывающей заболевание, убедительно продемонстрированной Робертом Кохом в 1876 году. [34] Название вида anthracis происходит от греческого слова сибирская язва (ἄνθραξ), что означает «уголь» и относится к наиболее распространенной форме заболевания, кожная сибирская язва, при которой образуются крупные черные поражения кожи. На протяжении XIX века сибирская язва была инфекцией, которая потребовала нескольких очень важных медицинских разработок. Первой вакциной, содержащей живые организмы, была ветеринарная вакцина Луи Пастера от сибирской язвы. [35]