Пуриновый метаболизм относится к метаболическим путям синтеза и расщепления пуринов , которые присутствуют во многих организмах.
Пурины биологически синтезируются в виде нуклеотидов и, в частности, в виде риботидов, т.е. оснований, присоединенных к рибозо-5-фосфату . И аденин , и гуанин происходят из нуклеотида инозинмонофосфата (ИМФ), который является первым соединением на пути, имеющим полностью сформированную пуриновую кольцевую систему.
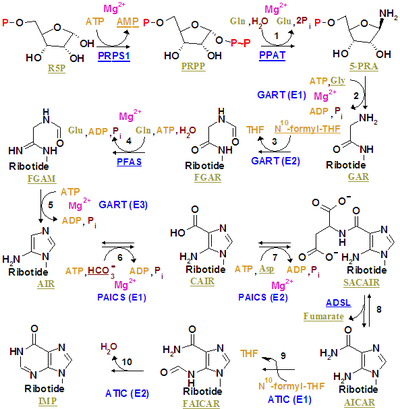
Инозинмонофосфат синтезируется на основе уже существующего рибозофосфата сложным путем (как показано на рисунке справа). Источником атомов углерода и азота пуринового кольца, 5 и 4 соответственно, являются различные источники. Аминокислота глицин вносит все свои атомы углерода (2) и азота (1), а также дополнительные атомы азота от глутамина (2) и аспарагиновой кислоты (1), а также дополнительные атомы углерода от формильных групп (2), которые переносятся из коэнзим тетрагидрофолат как 10-формилтетрагидрофолат и атом углерода из бикарбоната (1). Формильные группы образуют углерод-2 и углерод-8 в пуриновой кольцевой системе, которые действуют как мостики между двумя атомами азота.
Ключевым регуляторным этапом является производство 5-фосфо-α- D -рибозил-1-пирофосфата ( PRPP ) рибозофосфатпирофосфокиназой, которая активируется неорганическим фосфатом и инактивируется пуриновыми рибонуклеотидами. Это не обязательный шаг к синтезу пуринов, поскольку PRPP также используется в синтезе и путях утилизации пиримидинов.
Первым обязательным шагом является реакция PRPP, глутамина и воды с 5'-фосфорибозиламином (PRA), глутаматом и пирофосфатом , катализируемая амидофосфорибозилтрансферазой , которая активируется PRPP и ингибируется AMP , GMP и IMP .
На втором этапе происходит реакция PRA , глицина и АТФ с образованием GAR , ADP и пирофосфата, катализируемая фосфорибозиламин-глицинлигазой (GAR-синтетазой). Из-за химической лабильности PRA, период полураспада которого составляет 38 секунд при pH 7,5 и 37 °C, исследователи предположили, что соединение передается от амидофосфорибозилтрансферазы к GAR-синтетазе in vivo. [1]
Третий катализируется фосфорибозилглицинамидформилтрансферазой .
Четвертый катализируется фосфорибозилформилглицинамидинсинтазой .
Пятый катализируется AIR-синтетазой (FGAM-циклазой) .
Шестой катализируется фосфорибозиламиноимидазолкарбоксилазой .
Седьмой катализируется фосфорибозиламиноимидазолсукцинокарбоксамидсинтазой .
Восьмерка катализируется аденилосукцинатлиазой .
Продукты AICAR и фумарат распространяются двумя разными путями. AICAR служит реагентом на девятом этапе, в то время как фумарат транспортируется в цикл лимонной кислоты, который затем может пропускать этапы выделения углекислого газа с образованием малата. Превращение фумарата в малат катализируется фумаразой. Таким образом, фумарат связывает синтез пуринов с циклом лимонной кислоты. [2]
Девятый катализируется фосфорибозиламиноимидазолкарбоксамидформилтрансферазой .
Последний этап катализируется инозинмонофосфатсинтазой .
У эукариот второй, третий и пятый этапы катализируются трифункциональным пуриновым биосинтетическим белком аденозин-3 , который кодируется геном GART.
И девятый, и десятый этап выполняются с помощью одного белка, называемого бифункциональным белком биосинтеза пуринов PURH, кодируемого геном ATIC.
Пурины метаболизируются несколькими ферментами :
Образование 5'-фосфорибозиламина из глутамина и PRPP, катализируемое аминотрансферазой PRPP, является точкой регуляции синтеза пуринов. Фермент является аллостерическим ферментом, поэтому он может превращаться из ИМФ, ГМФ и АМФ в высокой концентрации, связывая фермент и оказывая ингибирующее действие, в то время как PRPP в больших количествах связывается с ферментом, вызывающим активацию. Таким образом, IMP, GMP и AMP являются ингибиторами, а PRPP — активатором. Между образованием 5'-фосфорибозила, аминоимидазола и ИМФ не существует известной стадии регуляции.
Пурины, образующиеся в клеточных нуклеиновых кислотах (или из пищи), также можно сохранить и повторно использовать в новых нуклеотидах.
Когда дефектный ген приводит к появлению пробелов в процессе метаболической переработки пуринов и пиримидинов, эти химические вещества не метаболизируются должным образом, и взрослые или дети могут страдать от любого из двадцати восьми наследственных заболеваний, возможно, еще некоторых, пока неизвестных. Симптомы могут включать подагру , анемию, эпилепсию, задержку развития, глухоту, компульсивное самокусание, почечную недостаточность или камни или потерю иммунитета.
Пуриновый обмен может иметь дисбаланс, который может возникнуть из-за включения вредных нуклеотид-трифосфатов в ДНК и РНК, что в дальнейшем приводит к генетическим нарушениям и мутациям и, как следствие, приводит к нескольким типам заболеваний. Некоторые из заболеваний:
Модуляция пуринового обмена имеет фармакотерапевтическое значение.
Ингибиторы синтеза пуринов подавляют пролиферацию клеток, особенно лейкоцитов . Эти ингибиторы включают азатиоприн , иммунодепрессант, используемый при трансплантации органов , аутоиммунных заболеваниях , таких как ревматоидный артрит , или воспалительных заболеваниях кишечника, таких как болезнь Крона и язвенный колит .
Микофенолата мофетил — иммунодепрессант, используемый для предотвращения отторжения при трансплантации органов; он ингибирует синтез пуринов, блокируя инозинмонофосфатдегидрогеназу (IMPDH). [5] Метотрексат также косвенно ингибирует синтез пуринов, блокируя метаболизм фолиевой кислоты (он является ингибитором дигидрофолатредуктазы ) .
Аллопуринол – препарат, который ингибирует фермент ксантиноксидоредуктазу и, таким образом, снижает уровень мочевой кислоты в организме. Это может быть полезно при лечении подагры — заболевания, вызванного избытком мочевой кислоты, образующим кристаллы в суставах.
Чтобы понять, как возникла жизнь , необходимы знания о химических путях, которые позволяют формировать ключевые строительные блоки жизни в вероятных пребиотических условиях . Нам и др. [6] продемонстрировали прямую конденсацию пуриновых и пиримидиновых азотистых оснований с рибозой с образованием рибонуклеозидов в водных микрокапельках, что является ключевым этапом, ведущим к образованию РНК. Кроме того, Becker et al. представили возможный пребиотический процесс синтеза пуриновых рибонуклеозидов. [7]
Организмы во всех трех сферах жизни — эукариоты , бактерии и археи — способны осуществлять биосинтез пуринов de novo . Эта способность отражает необходимость пуринов для жизни. Биохимический путь синтеза очень похож у эукариот и бактерий, но более изменчив у архей. [8] Было установлено, что почти полный или полный набор генов, необходимых для биосинтеза пуринов, присутствует у 58 из 65 изученных видов архей. [8] Однако также были идентифицированы семь видов архей, у которых полностью или почти полностью отсутствовали гены, кодирующие пурин. По-видимому, виды архей, неспособные синтезировать пурины, способны приобретать экзогенные пурины для роста [8] и, таким образом, подобны пуриновым мутантам эукариот, например, пуриновым мутантам гриба Ascomycete Neurospora crassa [9] , которым также необходимы экзогенные пурины для роста. рост.