Вирусный квазивид — это популяционная структура вирусов с большим количеством вариантов геномов (связанных мутациями). Квазивиды возникают из-за высоких скоростей мутаций , поскольку мутанты возникают постоянно и изменяют свою относительную частоту по мере репликации и отбора вируса . [1]
Теория предсказывает, что вирусный квазивид, находящийся в низкой, но эволюционно нейтральной и высокосвязанной (то есть плоской) области ландшафта приспособленности, вытеснит квазивид, находящийся в более высокой, но более узкой точке пика приспособленности, в которой окружающие мутанты непригодны. [2] [3] Это явление было названо «эффектом квазивида» или, в последнее время, «выживанием самых плоских». [4]
Термин «квазивиды» был заимствован из теории происхождения жизни , в которой примитивные репликоны состояли из мутантных распределений, как было экспериментально обнаружено с современными РНК-вирусами внутри их хозяина . [5] [6] Теория предоставила новое определение дикого типа при описании вирусов и концептуальную основу для более глубокого понимания адаптивного потенциала РНК-вирусов, чем это предлагается классическими исследованиями, основанными на упрощенных консенсусных последовательностях . [1]
Модель квазивидов наиболее применима, когда размер генома ограничен, а скорость мутаций высока, и поэтому наиболее актуальна для РНК-вирусов (включая важные патогены ), поскольку они имеют высокие скорости мутаций (приблизительно одна ошибка на раунд репликации) [7], хотя эти концепции могут применяться и к другим биологическим объектам, таким как обратно транскрибирующие ДНК-вирусы, такие как гепатит B. [8] В таких сценариях сложные распределения близкородственных вариантных геномов подвергаются генетической изменчивости , конкуренции и отбору и могут выступать в качестве единицы отбора . Следовательно, эволюционная траектория вирусной инфекции не может быть предсказана исключительно на основе характеристик наиболее приспособленной последовательности. Высокие скорости мутаций также устанавливают верхний предел, совместимый с наследуемой информацией. Пересечение такого предела приводит к вымиранию РНК-вируса , переходу, который является основой противовирусного дизайна, называемого летальным мутагенезом , и имеет отношение к противовирусной медицине. [1]
Значимость квазивидов в вирусологии была предметом длительных дебатов. Однако стандартные клональные анализы и методы глубокого секвенирования подтвердили наличие множества мутантных геномов в вирусных популяциях и их участие в адаптивных процессах . [1]
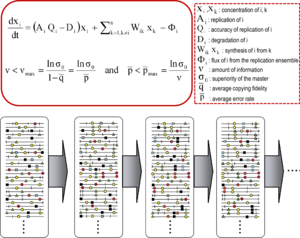
Теория квазивидов была разработана в 1970-х годах Манфредом Эйгеном и Питером Шустером для объяснения самоорганизации и адаптивности примитивных репликонов (термин, используемый для обозначения любой реплицирующейся сущности), как ингредиента гиперциклических организаций, которые связывают генотипическую и фенотипическую информацию, как существенный шаг в происхождении жизни. [11] [9] Теория изображала ранние популяции репликонов как организованные спектры мутантов, в которых доминирует главная последовательность, наделенная наивысшей приспособленностью (репликативной способностью) в распределении. Она ввела понятие ансамбля мутантов как единицы отбора, тем самым подчеркивая важность внутрипопуляционных взаимодействий для понимания реакции на селективные ограничения . Одним из ее следствий является отношение порога ошибки , которое отмечает максимальную скорость мутации, при которой главная (или доминирующая) последовательность может стабилизировать ансамбль мутантов. Нарушение порога ошибки приводит к потере доминирования главной последовательности и дрейфу популяции в пространстве последовательностей . [9] [12] [13] [14]
Основные концепции квазивидов описываются двумя фундаментальными уравнениями: репликация с образованием ошибочных копий и отношение порога ошибки. Они охватывают две основные особенности РНК-вирусов на уровне популяции: наличие спектра мутантов и неблагоприятное воздействие увеличения скорости мутаций на выживаемость вируса, каждое из которых имеет несколько производных. [1]
Существование спектра мутантов было экспериментально доказано впервые с помощью клональных анализов популяций РНК-бактериофага Qβ , репликация которых была инициирована одной вирусной частицей. Отдельные геномы отличались от консенсусной последовательности в среднем от одной до двух мутаций на отдельный геном. [15] Приспособленность биологических клонов была ниже, чем у родительской, неклонированной популяции, разница также документирована для вируса везикулярного стоматита (VSV). [16] Репликативная способность ансамбля популяции не обязательно должна совпадать с репликативной способностью ее отдельных компонентов. Открытие того, что вирусная популяция по сути является пулом мутантов, пришло в то время, когда мутации в общей генетике считались редкими событиями, и вирусологи связывали вирусный геном с определенной нуклеотидной последовательностью , как это все еще подразумевается сегодня в содержании банков данных . [17] Облачная природа Qβ была понята как следствие его высокой скорости мутаций, рассчитанной в 10 −4 мутаций, введенных на копируемый нуклеотид, [18] вместе с толерантностью отдельных геномов к принятию неопределенной доли вновь возникающих мутаций, несмотря на затраты на приспособленность. Оцененная скорость ошибок для бактериофага Qβ была подтверждена и сопоставима со значениями, рассчитанными для других РНК-вирусов. [7] [19]
Высокие скорости мутаций и квазивиды были подтверждены для других РНК-вирусов на основе рассечения вирусных популяций с помощью молекулярного или биологического клонирования и анализа последовательностей отдельных клонов. Джон Холланд и его коллеги были первыми, кто осознал, что быстро развивающийся мир РНК, вставленный в биосферу на основе ДНК, имел множественные эволюционные и медицинские последствия. [1] [16] [20] [21] [22] Пластичность генома РНК-вирусов предполагалась в течение многих десятилетий. Ключевыми ранними наблюдениями были вариации вирусных признаков, описанные Финдли в 1930-х годах, исследования Граноффа по переходам морфологии бляшек вируса болезни Ньюкасла или высокая частота конверсий между лекарственной устойчивостью и зависимостью у вируса Коксаки А9 , среди других исследований с вирусами животных и растений в середине 20-го века. [23] Если рассматривать их в контексте современных знаний, мы понимаем, что эти наблюдения за фенотипическими изменениями были вершиной айсберга чрезвычайно сложной реальности вирусных популяций. Высокие скорости мутаций и гетерогенность популяции характеризуют РНК-вирусы, что имеет последствия для вирусного патогенеза и контроля вирусных заболеваний. Подробные исследования динамики квазивидов in vivo были проведены с вирусом иммунодефицита человека типа 1 (ВИЧ-1) и вирусом гепатита С. [ 10] [24] [25]
Первая математическая формулировка квазивидов была детерминированной; она предполагала устойчивое состояние распределения мутантов в генетическом равновесии без возмущений, полученных из-за изменений окружающей среды или размера популяции . [26] Эти условия являются общими в начальных теоретических формулировках сложных явлений, поскольку они придают математическую трактовку. С тех пор было разработано несколько расширений теории на неравновесные условия со стохастическими компонентами с целью нахождения общих решений для ландшафтов приспособленности с несколькими пиками . Эти цели приближают квазивиды к реальному случаю РНК-вирусов, которые вынуждены иметь дело с резкими изменениями в размере популяции и окружающей среде. [27] Исследования квазивидов проводились по нескольким теоретическим и экспериментальным направлениям, которые включают в себя продолжающиеся исследования эволюционной оптимизации и происхождения жизни, взаимодействия РНК-РНК и репликаторных сетей, порога ошибки в ландшафтах переменной приспособленности, рассмотрение химического мутагенеза и механизмов корректуры, эволюции опухолевых клеток , бактериальных популяций или стволовых клеток , хромосомной нестабильности , устойчивости к лекарственным препаратам и распределения конформаций в прионах (класс белков с патогенным потенциалом, зависящим от конформации; в этом случае квазивид определяется распределением конформаций). [10] [28] Новые вклады в экспериментальные исследования квазивидов пришли из глубокого секвенирования для исследования вирусных и клеточных популяций, распознавания взаимодействий в мутантных спектрах, моделей динамики вирусной популяции , связанных с прогрессированием заболеваний и передачей патогенов, и новых учений из вариантов верности вирусов. [28] Здесь мы суммируем основные аспекты динамики квазивидов и недавние разработки, имеющие отношение к эволюции и патогенезу вирусов.
Молекулярной основой высоких показателей ошибок является ограниченная точность копирования шаблонов РНК-зависимых РНК-полимераз (RdRps) и РНК-зависимых ДНК-полимераз (также называемых обратными транскриптазами, RT). Кроме того, эти ферменты дефектны при корректуре [29], поскольку у них отсутствует 3'-5' экзонуклеазный домен, присутствующий в репликативных клеточных ДНК-полимеразах. [30] Кроме того, пути пострепликативной репарации, обильные для исправления генетических повреждений при репликации клеточной ДНК, кажутся неэффективными для двухцепочечных РНК или гибридов РНК-ДНК. Наличие активности корректуры-репарации у коронавирусов увеличивает их точность копирования примерно в 15 раз. [31] Эта и другие виды репарационной активности, которые могут воздействовать на стандартные РНК или ретровирусные геномы, [32] [33] [34] [35] не предотвращают образование мутантных спектров, хотя их амплитуда может быть ниже, чем у других РНК-вирусов, по крайней мере, в популяциях, близких к клональному (единому геному) происхождению. Динамика квазивидов будет работать в любой вирусной или клеточной системе, в которой из-за высоких скоростей мутаций (в результате низкоточных полимераз нуклеиновых кислот или изменений окружающей среды) мутантные спектры быстро генерируются. [10] [36] [37] [38] [39] [40]
Исследования с различными системами вирус-хозяин установили некоторые общие наблюдения относительно механизмов генерации мутантов и последствий динамики квазивидов. [10] [41] [42] [43] [44] [45] [46] [47] [ 48] [49] [50] В генетике РНК-вирусов, когда мы говорим о «мутанте», сущность, с которой мы имеем дело, является облаком мутантов, в которых конкретная мутация, на которую мы направляем наше внимание, присутствует во всех (или в подавляющем большинстве) индивидуальных геномов. Не существует такого понятия, как «дикий тип» или «мутантный» вирус. Это всегда облака мутантов. Изменения в относительном доминировании компонентов мутантных спектров особенно серьезны во время инфекций in vivo , со сложной динамикой внутрихозяйственной гетерогенности и вариаций. Биоинформатические процедуры были разработаны для выявления взаимосвязей между различными, но тесно связанными типами геномов, которые могут предполагать некоторый иерархический порядок приобретения мутаций или идентификации кластеров передачи (примерами являются Partition Analysis of QUasispecies , PAQ [ 51 ] или QUasispecies Evolution , Network -based Transmission Inference , QUENTIN [52] ).
Суть вопроса относительно последствий квазивидов заключается в том, что в любой момент времени вирусная популяция включает в себя резервуар не только генотипических , но и фенотипических вариантов, что придает популяции некоторую адаптивную плюрипотентность . Накопление лабораторных и клинических данных делает несостоятельным то, что миноритарные компоненты мутантных спектров должны быть отклонены на основании их нейтральности . Они могут участвовать в селективных процессах и не могут быть исключены из интерпретаций поведения вируса. Изменчивость универсально включает точечные мутации , а также может включать рекомбинацию (в ее репликативном и нерепликативном режимах) и реассортацию сегментов генома . [42] Все режимы молекулярной изменчивости совместимы, ограничены только объемом механизмов, доступных репликативному аппарату, и необходимостью сохранения функциональности вирусных геномов. Дэвид Эванс и его коллеги идентифицировали множество событий рекомбинации, связанных с репликацией энтеровирусов , и только несколько рекомбинантов проложили себе путь к продолжению репликации. [53] Рекомбинация может опосредовать адаптивность и вирулентность . [54] Высокие показатели мутаций и рекомбинации привели к концептуальному различию между механистически неизбежными и эволюционно значимыми вариациями в связи с проблемой клональной и неклональной природы эволюции вирусов (микробной эволюции в целом). [55] [56] Только меньшая часть возникающих вариаций во время репликации может быть успешно распространена. В пределах, установленных биологическими ограничениями, каждая популяция состоит из массива вариантных геномов, общее число которых соизмеримо с размером популяции вируса. Заражение растения, животного или культуры клеток 10 3 инфекционными единицами может иметь совершенно иные последствия, чем заражение 10 10 инфекционными единицами, не только потому, что защитные системы хозяина могут быть подавлены высокой инфекционной дозой, но и потому, что репертуар мутантов, который участвует в адаптивных исследованиях, больше. Часть вариантов спектра мутантов, как в изоляции, так и в консорциуме с другими, [57] может работать лучше, чем другие члены той же популяции в случае изменения окружающей среды. Селективное давление благоприятствует репликации некоторых компонентов спектра мутантов по сравнению с другими, несмотря на то, что все они связаны мутацией. Дифференциальная производительность может быть на уровне вирусных геномов (во время репликации, внутриклеточной экспрессии генов, взаимодействие с факторами хозяина и т. д.) или вирусных частиц (для термостабильности, входа в клетки или выхода из них, для противостояния нейтрализующим антителам и т. д.). [22] [10] [23] [24 ] [25] [42] [43] [44] Адаптивность РНК-вирусов связана с параметрами, которые облегчают исследование пространства последовательностей: размер генома (от 1,8 до 33 Кб), размер популяции (изменчивый, но может достигать впечатляющих 1012 индивидуальных геномов у инфицированного хозяина в определенный момент времени), скорость репликации, скорость мутаций, плодовитость (выход вирусных частиц на клетку) и количество мутаций, необходимых для фенотипического изменения (удивительно низкое для нескольких соответствующих признаков [58] ).
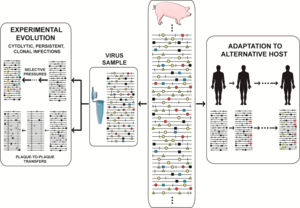
Динамика спектра мутантов изображалась по-разному, и мы выбрали тот, который охватывает частые события в естественных популяциях и исследовательских проектах, такие как изоляция вируса от инфицированного хозяина, адаптация к клеточной культуре для изучения экспериментальной эволюции или адаптация к альтернативным хозяевам in vivo. Реальность еще сложнее, учитывая большие размеры популяции, с неопределенной долей геномов, активно реплицирующихся в любой момент времени (иногда приравниваемой к эффективному размеру популяции в общей генетике), и наличием множественных мутаций на геном. Сценарии, предлагаемые текущими экспериментальными данными, бросают вызов нашему воображению. Относительная частота индивидуальных мутаций колеблется в непрерывном исследовании пространства последовательностей, [59] [60] [10] причем фенотипические изменения (не только генотипические изменения) происходят гораздо чаще, чем считалось ранее. Экспериментальный эволюционный проект, который состоит из пассирования вирусных популяций в течение длительных периодов времени (множество последовательных инфекций), часто чрезвычайно показателен. В случае вируса ящура (FMDV) такой дизайн привел к заметной фенотипической диверсификации в субпопуляции колонизаторов и конкурентов, что модулировало вирулентность ансамбля мутантов. [61] В случае вируса гепатита С такой дизайн выявил непрерывные волны мутаций и более точное понимание типов ландшафтов приспособленности, занимаемых высокоприспособленными вирусами. [60] [62]
Нуклеотидная последовательность индивидуального генома из популяции (независимо от степени сложности популяции) может быть определена либо после биологического или молекулярного клонирования, либо путем глубокого секвенирования целых вирусных геномов таким образом, что может быть установлена мутационная связь (назначение различных мутаций одной и той же молекуле генома). Каждая из этих процедур подразумевает некоторые ограничения: биологическое клонирование может смещать представление в пользу инфекционных геномов, в то время как молекулярное клонирование может вводить неинфекционные (дефектные) геномы в анализ. [22] [58] [59] Описание квазивидов всего генома по-прежнему технически сложно из-за артефактного введения мутаций. Большинство современных платформ глубокого секвенирования выдают последовательности коротких прочтений для данного ампликона (анализируемой последовательности); минорные мутации в ампликоне не могут быть надежно связаны с мутациями в другом ампликоне того же генома; в лучшем случае можно предложить статистические выводы о сцеплении. Несмотря на эти ограничения, контрольные эксперименты и усовершенствования биоинформатических процедур подтверждают, что большая часть гетерогенности последовательностей, проанализированных в вирусных популяциях, действительно отражает различия в популяциях естественных шаблонов. Если сцепление мутаций может быть решено на рутинной основе, новая волна молекулярной информации, относящейся к эпистатическим взаимодействиям, выйдет на сцену.
Существуют дополнительные уровни неопределенности в последовательном анализе вирусных популяций, в частности, тех, которые реплицируются in vivo. Компоненты спектра мутантов, представленные в данный момент времени в образце, взятом для секвенирования, могут отличаться от компонентов в следующей временной точке из-за неопределенностей выборки или добросовестных колебаний частот генома. Неправомерно принимать грубое сходство, поскольку даже одна мутация в данном контексте последовательности может повлиять на биологические свойства. [10] По словам Джона Холланда и коллег: «Важно помнить, что каждый рой геномов квазивидов в инфицированном индивидууме уникален и «нов» в том смысле, что ни одна идентичная популяция геномов никогда не существовала ранее и никогда не будет существовать снова». [63] Помимо мимолетной природы любого мутантного распределения, стандартные методы, доступные для характеристики квазивидов, предоставляют геномные последовательности меньшинства популяции (оцениваемые в 10−8–10−13 для молекулярного клонирования -секвенирования по Сэнгеру и в 10−6–10−11 для глубокого секвенирования ). [58] Мы можем иметь только приблизительное представление о вирусных популяциях и их динамике, о чем свидетельствуют многочисленные экспериментальные исследования. [15] [20] [10] [43] [44] [ 58] [60] [64]
Обобщенные в предыдущих разделах пункты полностью оправдывают обращение к аналитическим инструментам в отношении мутантного спектра, а не игнорирование его или рассмотрение его присутствия как побочного вопроса. Использование консенсусных последовательностей для описания генома вирусного изолята, несмотря на то, что оно оправдано трудностями передачи информации, воспроизведенной в мутантном спектре, размывает и ослабляет биологические интерпретации. Экспериментальные результаты продемонстрировали, что меньшинство геномов из мутантного спектра (которые не могут быть идентифицированы путем изучения консенсусной последовательности) может включать мутации, которые придают устойчивость к противовирусным ингибиторам , нейтрализующим антителам или цитотоксическим Т-клеткам , или которые могут изменять способность индуцировать интерферон (IFN) или реагировать на IFN, вирулентность или стабильность частиц, среди других фенотипических признаков. [10] [42] [46] [60] [64] [65] [66] [67] Мутантные спектры также могут опосредовать циклическую адаптацию к различным типам клеток. [41] Мутантный спектр определяет консенсус, но консенсус является абстракцией; он может не быть представлен в популяции. Многие события в вирусном патогенезе и эволюции обусловлены модификациями мутантного спектра или взаимодействиями, которые не могут быть правильно интерпретированы исключительно на основе консенсусных последовательностей. [15] [10] [22] [23] [28] [41] [40] [ 43] [ 44] [53] [54] [57] [60] [63]
Мутантные спектры — это не просто совокупности мутантов, действующих независимо. Они часто вовлечены в коллективные реакции. [1] Два основных типа — это те, которые зависят от наличия наборов вариантов, и те, которые полагаются на внутримутантные спектральные взаимодействия.
В некоторых случаях выметающего отбора (очень сильный отбор для признака) особь (или ограниченное число особей), которая кодирует сигнатуры, склонные к отбору, может приблизиться к доминированию, становясь при этом основателем мутантного облака (потому что образование облака присуще репликации). Условия доминирования (в этом случае в ответ на отбор) заключаются в том, что геном чувствует селективный вымет и что его репликация в новой селективной среде разрешена. В других случаях выбирается набор мутантов. Это было проиллюстрировано на примере квазивида вируса ящура, который был реконструирован в лаборатории с несколькими антигенными вариантами (каждый с низкой частотой), которые принадлежали к двум разным категориям и имели общую устойчивость к одному и тому же моноклональному антителу . [68] Одна категория включала мутантов с заменой аминокислоты, которая влияла на распознавание рецептора (поскольку антигенная детерминанта перекрывалась с сайтом распознавания рецептора интегрина ); в другой категории замены влияли на антигенную детерминанту, но не на сайт распознавания рецептора. Пассажи вируса в отсутствие моноклонального антитела привели к доминированию антигенных вариантов, которые сохранили способность распознавания рецептора, но доминирующие варианты были окружены облаком мутантов другой категории антигенных вариантов. Наоборот, пассажи в присутствии антитела привели к отбору вариантов с измененным распознаванием рецептора, окруженных облаком антигенных вариантов, которые сохранили распознавание рецептора. Результаты подчеркнули роль мутантных облаков в селективных событиях и раскрыли новый механизм антигенной гибкости. [68]
Память квазивидов — это тип молекулярной памяти, зависящий от недавней истории эволюционной линии и целостности спектра мутантов. [69] [70] Поиск памяти был вызван сложным адаптивным системным поведением вирусного квазивида, предполагаемым наличием основной информации (считающейся той, которая определяет вирусную идентичность), несмотря на вариации конститутивных элементов (спектр мутантов). Хорошо известным примером является память в иммунной системе , которая мобилизует и расширяет компоненты меньшинства в ответ на стимулы, с которыми ранее сталкивалась система. [71] В экспериментах, разработанных для выявления памяти в вирусных квазивидах, члены спектра мутантов увеличились в частоте в результате их репликации во время события отбора, которое привело их к доминированию. Когда селективное ограничение было снято, геномы памяти оставались на уровнях, которые были в 10-100 раз выше базальных уровней, приписываемых исключительно их генерации мутацией, как это было задокументировано с независимыми генетическими маркерами FMDV и с ВИЧ-1 in vivo . [69] [70] [72] [73] Таким образом, память является зависящим от истории коллективным свойством квазивида, которое дает селективное преимущество для реагирования на изменения окружающей среды, ранее испытанные той же эволюционной линией. Это может проявиться только в том случае, если спектр мутантов сохраняет свою полноту, поскольку память теряется, когда популяция подвергается событию бутылочного горлышка , которое исключает меньшинства. Соответствующий пример последствий памяти происходит в противовирусной фармакологии при повторном введении того же или родственного противовирусного агента (способного вызывать общие мутации устойчивости), используемого в предыдущем лечении. Второе вмешательство может столкнуться с геномами памяти, устойчивыми к ингибиторам, от предыдущего лечения, тем самым способствуя ускользанию вируса. [69] Этому аспекту не уделялось должного внимания при планировании противовирусных вмешательств для пациентов, у которых первое лечение оказалось неэффективным и которым пришлось пройти повторное лечение.
Отдельные геномы, окруженные облаком родственных мутантов, могут быть либо подавлены, чтобы поддерживаться на низкой частоте, либо им может быть оказано содействие в поддержании в популяции. Две альтернативные судьбы зависят от нескольких факторов, одним из которых является окружающий спектр мутантов на тех этапах инфекционного цикла, на которых устанавливается эффективная конкуренция между вариантами, например, в репликационных комплексах. Эта важная концепция была впервые выведена теоретически, [12] [74] , а затем экспериментально исследована с несколькими вирусами. В раннем исследовании Хуан Карлос де ла Торре и Джон Холланд описали подавление высокоприспособленного VSV мутантными спектрами с низкой приспособленностью. [12] С тех пор подавляющие эффекты были задокументированы для стандартных и мутагенизированных вирусных популяций. Вот некоторые примеры:
Противоположностью подавлению является поддержание мутанта либо за счет благоприятного положения в ландшафте приспособленности, либо за счет взаимодействий комплементации или кооперации с членами спектра мутантов. Положение в ландшафте приспособленности влияет на уязвимость к мутациям, что популяризируется терминами «преимущество самого плоского» или «выживание самого плоского», указывая на то, что вариант, расположенный на вершине острого пика приспособленности, имеет более высокую вероятность снижения приспособленности в результате новых мутаций, чем тот же вариант, расположенный на плато приспособленности . [3] [81] [82] Выживание самого плоского также было предложено в качестве ингредиента в некоторых моделях порога ошибки. [83]
Коллективное поведение вирусов было задокументировано с мутантными РНК-вирусами, устойчивыми к аналогам нуклеотидов. Изучение этого класса мутантов сыграло важную роль в понимании молекулярной основы точности копирования шаблона и последствий изменений точности в адаптивной способности и патогенном потенциале РНК-вирусов. [84] [85] [86] У первого изученного мутанта замена аминокислоты G46S в полимеразе PV привела к примерно четырехкратному увеличению точности копирования шаблона. Эта модификация снизила адаптивность PV и инфекционный потенциал in vivo. [84] [85] Мутант в изоляции не реплицировался эффективно в мозге восприимчивых мышей, но это происходило, когда его мутантный спектр был расширен мутагенезом 5-фторурацила или когда он был ко-инокулирован с диким типом PV. [85]
Комплементация (часто возникающая, когда функциональный белок, кодируемый набором геномов, используется другим набором геномов, кодируемый белок которого не является функциональным) может лежать в основе некоторых коллективных реакций квазивидов, таких как приспособленность особей, изолированных от популяции, которая ниже приспособленности популяции. [15] [30] Комплементация была описана между двумя укороченными геномными формами FMDV. [87] Геномы с внутренними делециями стали обнаруживаться при пассаже с высокой множественностью клонированной популяции стандартного FMDV, вируса с моночастным одноцепочечным РНК-геномом. Инфекционность была вызвана комплементацией двух укороченных форм в отсутствие стандартных полноразмерных геномов FMDV. Для того, чтобы комплементация была эффективной, требовалось предварительное исследование пространства последовательностей посредством точечных мутаций. [88] Система претерпела замечательный эволюционный переход, родственный сегментации генома. Резкие генетические повреждения в вирусных геномах трудно обнаружить, если только такой механизм, как комплементация, не придет на помощь девиантным геномам. Были зарегистрированы дополнительные примеры комплементации среди РНК-вирусов. [89] [90] [91] [42] [44] Комплементация — это способ поддержания дефектных геномов на обнаруживаемых частотах в вирусных популяциях.
Было проведено различие между комплементарностью и кооперацией, при которых два разных генома дают начало новому фенотипу посредством взаимодействия двух вариантов белков. [92] Пример кооперации был охарактеризован во время исследований с вирусом кори по слиянию мембран, которое необходимо для проникновения вируса в клетки. Для этого слияние вируса опосредовано двумя белками, называемыми H и F. Укороченный H был недостаточным для слияния клеток, но активность восстанавливалась, когда укороченный H сопровождался двумя формами F, но не одной из форм по отдельности. [92]
Таким образом, комплементация, кооперация, интерференция и подавление могут возникать из взаимодействий между компонентами спектров мутантов, которые берут свое начало в случайных мутациях. Отбор действует на любые наборы мутантов, которые могут предоставить полезный признак, чтобы превратить случайные события в биологический смысл.

Средство прерывания участия индивидуальных геномов во взаимодействиях со спектром их мутантов заключается в том, что рой квазивидов подвергается резкому сокращению размера популяции, которое изолирует один или несколько индивидуальных геномов от их окружения. Такие сокращения называются бутылочными горлышками, и они играют важную роль в формировании эволюционных линий для всех видов организмов, а также для вирусов. Они часто происходят не только при передаче от хозяина к хозяину, но и внутри инфицированных хозяев, [93] [94] [95] и они могут нарушать события положительного и отрицательного отбора в процессах, которые трудно идентифицировать и охарактеризовать.
Резкие события бутылочного горлышка были воспроизведены с лабораторными популяциями вирусов в форме переносов от бляшки к бляшке. [96] [97] Эта конструкция служила для экспериментальной проверки работы храповика Мюллера , или снижения приспособленности за счет необратимого включения мутаций в бесполые организмы при отсутствии компенсаторных механизмов. [98] Серийные переносы бутылочного горлышка выявили наличие редких мутаций, не наблюдаемых в стандартных лабораторных или естественных вирусных популяциях. При отсутствии вынужденных событий бутылочного горлышка такие редкие мутации были бы потеряны отрицательным отбором из-за их стоимости приспособленности. [99] Исследование того, как клоны FMDV, ослабленные храповиком Мюллера, восстанавливали репликативную приспособленность, выявило несколько альтернативных молекулярных путей для восстановления приспособленности. [100] Последствия этого наблюдения оставались в значительной степени незамеченными до недавних результатов с вирусом гепатита С (HCV), которые также предположили доступность множественных путей для увеличения приспособленности. [60] [62] Кроме того, обширный пассаж биологического клона FMDV в клетках BHK-21 предоставил возможность инфицировать несколько линий клеток человека в дополнение к ожидаемому увеличению приспособленности для размножения в клетках BHK-21. [101] Таким образом, несколько линий доказательств предполагают, что усиление приспособленности в определенной среде может парадоксальным образом расширить фенотипический потенциал вируса. Будет интересно исследовать, может ли целенаправленная адаптация других вирусов к определенной среде также повлечь за собой расширение разнообразия, при этом многие фенотипические варианты достигают схожих уровней приспособленности. Если обобщить, это расширение фенотипического пространства обеспечит новую интерпретацию молекулярной основы адаптации и объяснит, почему адаптация к альтернативным средам может не привести к ослаблению .
Лишение отдельного вируса возможности подавления, комплементации или кооперации может представлять собой освобождение для начала нового эволюционного процесса или приговор к вымиранию. Если освободиться от подавления, изолированный геном должен реплицироваться и быть в состоянии реконструировать мутантное облако, чтобы восстановить адаптивную способность. Это привело к предположению, что высокие скорости мутаций эволюционировали, чтобы обеспечить такое восстановление спектра мутантов после узких мест. Другие модели приписывают высокие скорости мутаций адаптивной оптимизации, независимой от узких мест, или механистическому следствию быстрой репликации. [58] Независимо от их конечного происхождения, высокие скорости мутаций служат цели адаптации в различных обстоятельствах, а не только после узких мест. Вирус-основатель может ввести другой фенотип для последующей эволюции. Эволюцию вирусов в природе и как возбудителей болезней можно рассматривать как последовательность изменений спектра мутантов, подверженных расширениям и сокращениям размера популяции в непрерывном взаимодействии положительного и отрицательного отбора и случайного дрейфа. В то время как краткосрочная (например, внутрихозяинная) эволюция поддается наблюдению и измерению, вирусы могут казаться относительно статичными в долгосрочной перспективе в течение десятилетий (как это видно на примере антигенных вариантов вируса ящура [102] ) или дольше. Внутрихозяинная эволюция, как правило, происходит быстрее, чем межхозяинная эволюция, как это было задокументировано на примере вирусов [10] и других биологических систем. [103] Очевидная инвариантность может быть результатом отбора для долгосрочного выживания популяций, которые ранее лихорадочно проверяли эволюционные результаты в краткосрочных процессах. [58]
Вскоре после того, как квазивиды были доказаны для вирусов, некоторые медицинские выводы были сделаны явными. [20] [104] Несколько конкретных и общих моментов ниже. [10] [43] [66] [28]
Во всех взаимодействиях, ведущих к заболеванию, клетки-хозяева по отдельности и как группы в тканях и органах играют решающую роль. Последствия вирусной инфекции всегда зависят от хозяина. Однако сам вирус представляет собой серьезную проблему, с которой помогает справиться более глубокое понимание динамики квазивидов. [28]
Растет понимание того, что дарвиновские принципы должны помогать в планировании противовирусных разработок. [105] Цель вакцинации — вызвать защитную реакцию, которая либо предотвращает репликацию вируса, либо заболевание. Целью противовирусного фармакологического вмешательства является подавление репликации вируса, чтобы предоставить иммунной системе возможность избавиться от вируса. Выражаясь проще, прямая опасность для вакцинации и лечения заключается в том, что вирус может ускользнуть через отбор мутантов, устойчивых к компонентам защиты, запускаемым вакциной, или к вводимым извне ингибиторам. Это привело к нескольким предложениям по борьбе с вирусными заболеваниями, которые можно суммировать ниже. [58]
Вакцины должны включать репертуары эпитопов В-клеток и Т-клеток , чтобы вызывать обильный иммунный ответ . Широкий ответ должен минимизировать выбор мутантов-ускользателей, которые могут присутствовать в качестве второстепенных компонентов в спектрах мутантов, как неоднократно документировалось экспериментально. [10] [22] [44] [69] При нынешних типах доступных вакцин те, которые лучше всего соответствуют требованию множественных эпитопов , в порядке ожидаемой эффективности для обеспечения защиты от высоковариабельных вирусов: ослабленные > инактивированный целый вирус > несколько экспрессированных белков > один экспрессированный белок > несколько синтетических пептидных антигенов > один пептидный антиген. Дефицит эффективных синтетических вакцин для РНК-вирусных патогенов, несмотря на огромные научные и экономические усилия, является отражением основных проблем.
Следует избегать противовирусной монотерапии (использования одного противовирусного средства). Были даны следующие рекомендации, которые в некоторых случаях были успешно реализованы:
Эти стратегии имеют своей главной целью избежать отбора мутантов, избегающих лечения, с помощью множественных селективных ограничений, которые вирус не может преодолеть. [58] [106] Контроль эффективен либо потому, что исследование пространства последовательностей не может достичь требуемых множественных мутаций (даже когда доступна рекомбинация), либо потому, что множественные мутации приводят к серьезным издержкам приспособленности. [106] Вакцины, подвергающие воздействию множественных эпитопов, и комбинированная терапия следуют той же стратегии, цель которой состоит в ограничении возможных путей избегания вирусными квазивидами перед лицом подавляющего ограничения.
Летальный мутагенез — это процесс вымирания вируса с частотой ошибок, при которой вирус больше не может поддерживать свою генетическую информацию. [10] [28] [44] [58] [62] [83] [107] [108] Применение летального мутагенеза в качестве противовирусной стратегии заслуживает внимания в контексте настоящей статьи, поскольку его истоки лежат в теории квазивидов в форме отношения порога ошибки. Как порог ошибки, так и летальный мутагенез в значительной степени зависят от ландшафта приспособленности, но оба могут происходить в сложных ландшафтах приспособленности, таких как те, которые относятся к вирусным популяциям. [83] Термин летальный мутагенез был придуман Лоуренсом Лебом и его коллегами, [107] и в настоящее время он широко используется для описания противовирусной активности аналогов оснований и нуклеозидов, которые увеличивают частоту вирусных мутаций. Хотя было предложено несколько моделей для объяснения вымирания вируса избыточными мутациями, [83] расширение нарушения порога ошибки выступает в качестве вероятного механизма. [109] [108] Интересно, что некоторые антивирусные агенты, лицензированные для использования человеком, которые изначально считались действующими только как ингибиторы репликации вирусов, на самом деле могут оказывать свою антивирусную активность против некоторых РНК-вирусов, по крайней мере частично, посредством летального мутагенеза. Это случай фавипиравира (T-705; 6-фтор-3-гидрокси-2-пиразинкарбоксамид) и рибавирина (1-β-D-рибофуранозил-1-H-1,2,4-триазол-3-карбоксамид), которые в настоящее время интенсивно исследуются как летальные мутагены. [108]
Защитные механизмы, основанные на модификации генома вторгающихся генетических паразитов, такие как редактирование клеточной активности, которая задействуется как часть врожденного иммунного ответа ( ADAR , APOBEC , RIP и т. д.) [110], представляют собой естественный аналог принципа, используемого летальным мутагенезом. Применимость к патогенным клеточным элементам является реальной возможностью, а летальный мутагенез для контроля опухолевых клеток является активной областью исследований. [111] [112] Таким образом, признание динамики квазивидов предложило некоторые фундаментальные руководящие принципы для профилактики и контроля заболеваний, которые постепенно проникают в клиническую практику. Это соответствует признанной необходимости применения дарвиновских принципов к контролю инфекционных заболеваний.
Это можно определить как «неспособность генетического элемента сохраняться в популяции, поскольку точность его репликационного аппарата снижается ниже определенного порогового значения» [113] .
Теоретически, если бы скорость мутации была достаточно высокой, вирусная популяция не смогла бы поддерживать генотип с наивысшей приспособленностью, и, следовательно, способность популяции адаптироваться к окружающей среде была бы скомпрометирована. Практическое применение этой динамики — в противовирусных препаратах, использующих летальный мутагенез. Например, повышенные дозы мутагена рибавирина снижают инфекционность полиовируса. [114]
Однако эти модели предполагают, что только мутации, которые происходят в наиболее приспособленной последовательности, являются вредными, и, более того, что они нелетальны. Утверждалось, что если мы примем во внимание вредное воздействие мутаций на популяцию вариантов и тот факт, что многие мутации являются летальными, то порог ошибки исчезнет, т. е. наиболее приспособленная последовательность всегда сохранится. [115] [113] [116] Эмпирические данные о влиянии мутаций на вирусы редки, но, по-видимому, соответствуют этому сценарию. [117]
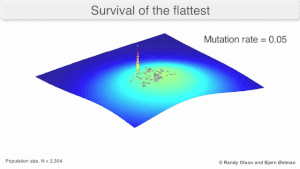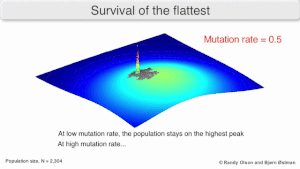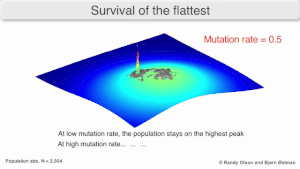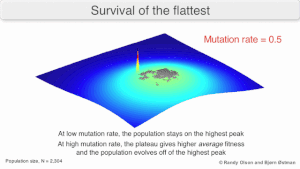
Долгосрочная эволюция вируса может быть затронута тем, что может быть более эволюционно стабильной стратегией создать широкий квазивид с членами примерно равной приспособленности, чем иметь четко определенный «наиболее приспособленный» один генотип (с мутационными соседями, существенно менее приспособленными). Это было названо «выживанием самых плоских» — имея в виду профили приспособленности двух стратегий соответственно. [3]
В долгосрочной перспективе более плоский профиль приспособленности может лучше позволить квазивиду использовать изменения в давлении отбора , аналогично тому, как половые организмы используют рекомбинацию для сохранения разнообразия в популяции. По крайней мере, в симуляциях можно показать, что более медленный репликатор способен превзойти более быстрый в случаях, когда он более устойчив, а скорость мутаций высока. [2]
Однако не подтверждено, возникла ли мутационная устойчивость в результате эволюции или она присуща генетическим системам, поскольку базовый механизм устойчивости зависит от особенностей каждой системы. [4]
Экспериментальные манипуляции с полиовирусом с целью придания им полимеразы с более высокой точностью и, следовательно, снижения скорости их мутаций, показали, что эти варианты обладают более низкой патогенностью, чем последовательности дикого типа . [85] Патогенность затем можно было восстановить путем применения мутагена. Это было интерпретировано как то, что более низкие скорости мутаций снизили адаптивность (или широту) квазивидов. Мутантные вирусы, извлеченные из мозговой ткани, сами по себе не были патогенными, и авторы предполагают, что может существовать комплементация между вариантными членами квазивидов, которая может позволить вирусам колонизировать различные ткани и системы хозяина.
![]() Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2000) (отчеты рецензента): Esteban Domingo Solans, Celia Perales (17 октября 2019 г.). "Viral quadrspecies". PLOS Genetics . 15 (10): e1008271. doi : 10.1371/JOURNAL.PGEN.1008271 . ISSN 1553-7390. PMC 6797082. PMID 31622336. Wikidata Q86320171 .
Эта статья была адаптирована из следующего источника по лицензии CC BY 4.0 (2000) (отчеты рецензента): Esteban Domingo Solans, Celia Perales (17 октября 2019 г.). "Viral quadrspecies". PLOS Genetics . 15 (10): e1008271. doi : 10.1371/JOURNAL.PGEN.1008271 . ISSN 1553-7390. PMC 6797082. PMID 31622336. Wikidata Q86320171 .
{{cite book}}: |journal=проигнорировано ( помощь ){{cite book}}: |journal=проигнорировано ( помощь )