Ион водорода образуется , когда атом водорода теряет электрон . Положительно заряженный ион водорода (или протон ) может легко объединяться с другими частицами и поэтому виден изолированным только тогда, когда он находится в газообразном состоянии или в пространстве, почти свободном от частиц. [1] Из-за чрезвычайно высокой плотности заряда , примерно в 2×10 10 раз превышающей плотность заряда иона натрия, голый ион водорода не может свободно существовать в растворе, поскольку он легко гидратируется, т. е. быстро связывается. [2] Ион водорода рекомендован ИЮПАК как общий термин для всех ионов водорода и его изотопов . [3] В зависимости от заряда иона можно выделить два разных класса: положительно заряженные ионы и отрицательно заряженные ионы.

Атом водорода состоит из ядра с зарядом +1 и одного электрона. Следовательно, единственный возможный положительно заряженный ион имеет заряд +1. Отмечается Н + .
В зависимости от рассматриваемого изотопа катион водорода имеет разные названия:
Кроме того, ионы, образующиеся в результате реакции этих катионов с водой, а также их гидраты, называются ионами водорода:
Катионы Цунделя и собственные катионы играют важную роль в диффузии протонов по механизму Гроттуса .
В отношении кислот «ионы водорода» обычно относятся к гидронам.
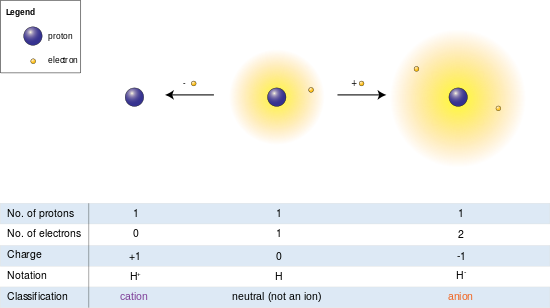
На изображении слева атом водорода (в центре) содержит один протон и один электрон. Удаление электрона дает катион (слева), тогда как присоединение электрона дает анион (справа). Анион водорода с его рыхлым двухэлектронным облаком имеет больший радиус, чем нейтральный атом, который, в свою очередь, намного больше, чем голый протон катиона. Водород образует единственный катион, не имеющий электронов, но даже катионы, которые (в отличие от водорода) все еще сохраняют один или несколько электронов, все равно меньше нейтральных атомов или молекул, из которых они произошли.
Анионы водорода образуются при присоединении дополнительных электронов:
Ионы водорода управляют АТФ-синтазой при фотосинтезе . Это происходит, когда ионы водорода проходят через мембрану, создавая высокую концентрацию внутри тилакоидной мембраны и низкую концентрацию в цитоплазме. Однако из-за осмоса H + вытесняется из мембраны посредством АТФ-синтазы. Используя свою кинетическую энергию для выхода, протоны вращают АТФ-синтазу, которая, в свою очередь, создает АТФ . Это происходит и при клеточном дыхании , хотя концентрированная мембрана вместо этого будет внутренней мембраной митохондрий .
Концентрация ионов водорода, измеряемая как pH, также отвечает за кислотную или основную природу соединения. Молекулы воды расщепляются с образованием H + и гидроксид-анионов. Этот процесс называется самоионизацией воды .
Концентрация ионов водорода и pH обратно пропорциональны; в водном растворе повышенная концентрация ионов водорода приводит к низкому pH и, как следствие, к кислому продукту. По определению, кислота – это ион или молекула, которая может отдавать протон и при введении в раствор вступает в реакцию с молекулами воды (H 2 O) с образованием иона гидроксония (H 3 O + ), кислоты, сопряженной с водой. . [4] Для упрощения, ион водорода (H + ) часто используется для сокращения иона гидроксония.
Закисление океана является прямым следствием повышенных концентраций ионов водорода и насыщения карбонатами в результате значительного поглощения углекислого газа (CO 2 ) мировым океаном. [5] Доиндустриальное состояние карбонатной химии океана было особенно стабильным, включая баланс его pH. [6] После промышленной революции антропогенные выбросы от сжигания ископаемого топлива , производства цемента и изменения в землепользовании увеличили поглощение океанами углекислого газа из атмосферы на 30%. [7] В океане поглощающая способность этого парникового газа в 59 раз выше, чем в атмосфере; [8] Океан выступает крупнейшим поглотителем углерода на планете, играя значительную роль в регулировании климата. [9] Помимо потоков углерода, естественному процессу связывания углерода из атмосферы в глубины океана способствуют две системы: биологический насос и насос растворимости. Насос растворимости представляет собой физико-химический процесс, который перекачивает CO 2 на границе раздела воздух-море. [10] Согласно закону Генри, количество растворенного CO 2 в водном растворе прямо пропорционально парциальному давлению CO 2 в атмосфере. [11] Для поддержания равновесия состояние высокого атмосферного парциального давления CO 2 приводит к увеличению океанического обмена этого газа за счет молекулярной диффузии.
В поверхностных водах растворенный углекислый газ воздуха (CO 2(aq) ) реагирует с молекулами воды с образованием угольной кислоты (H 2 CO 3 ), слабой дипротонной кислоты. Дипротоновые кислоты состоят из двух ионизируемых атомов водорода в каждой молекуле. [12] В водном растворе при частичной диссоциации угольной кислоты высвобождаются протон водорода (H + ) и ион бикарбоната (HCO 3 - ), а затем ион бикарбоната диссоциирует на дополнительный протон водорода и ион карбоната (CO 3 2- ). [13] Растворение и диссоциация этих неорганических видов углерода приводит к увеличению концентрации ионов водорода и обратно пропорционально снижает pH окружающей поверхности океана. Карбонатная буферная система регулирует кислотность морской воды, поддерживая растворенные неорганические виды углерода в химическом равновесии.
Химическое уравнение состоит из реагентов и продуктов, которые могут реагировать в любом направлении. Добавление большего количества реагентов в систему приводит к увеличению производства продукта (химическая реакция смещается вправо), и если добавляется больше продукта, образуются дополнительные реагенты, сдвигая химическую реакцию влево. Следовательно, в этой модели высокая концентрация начального реагента, диоксида углерода, приводит к увеличению количества конечного продукта (H + и CO 3 2- ), тем самым снижая pH и создавая более кислый раствор. Естественная буферная система океана сопротивляется изменению pH, производя больше ионов бикарбоната, генерируемых протонами свободной кислоты, реагирующими с ионами карбоната, образуя щелочной характер. [14] Однако увеличение концентрации CO 2 в атмосфере может превысить порог буферной способности, что, как следствие, приведет к более высоким темпам закисления океана. Изменения в карбонатной химии океана могут манипулировать биогеохимическими циклами океана для многих элементов и соединений, оказывая глубокое воздействие на морские экосистемы. Более того, растворимость CO 2 зависит от температуры; повышенная температура поверхностных вод снижает растворимость CO 2 . Постоянное повышение парциального давления CO 2 в атмосфере потенциально может превратить океан из функции поглотителя (вертикальный перенос углерода в глубины океана) в источник (дегазация CO 2 из океана), что приведет к дальнейшему повышению глобальной температуры. [15]