

Вторичная структура нуклеиновой кислоты — это взаимодействия пар оснований в пределах одного полимера нуклеиновой кислоты или между двумя полимерами. Ее можно представить в виде списка оснований, которые спарены в молекуле нуклеиновой кислоты. [1]
Вторичные структуры биологических ДНК и РНК , как правило, различаются: биологическая ДНК в основном существует в виде полностью спаренных оснований двойных спиралей, в то время как биологическая РНК является одноцепочечной и часто образует сложные и запутанные взаимодействия пар оснований из-за ее повышенной способности образовывать водородные связи, обусловленные дополнительной гидроксильной группой в сахаре рибозы . [ необходима цитата ]
В небиологическом контексте вторичная структура является жизненно важным фактором при проектировании структур нуклеиновых кислот для ДНК-нанотехнологий и ДНК-вычислений , поскольку схема спаривания оснований в конечном итоге определяет общую структуру молекул.
В молекулярной биологии два нуклеотида на противоположных комплементарных цепях ДНК или РНК , которые соединены водородными связями , называются парой оснований (часто сокращенно bp). В каноническом спаривании оснований Уотсона-Крика аденин (A) образует пару оснований с тимином (T), а гуанин (G) образует пару оснований с цитозином (C) в ДНК. В РНК тимин заменяется урацилом (U). Альтернативные модели водородных связей, такие как пара оснований качания и пара оснований Хугстина , также встречаются — особенно в РНК — приводя к образованию сложных и функциональных третичных структур . Важно отметить, что спаривание — это механизм, с помощью которого кодоны на молекулах информационной РНК распознаются антикодонами на транспортной РНК во время трансляции белка . Некоторые ДНК- или РНК-связывающие ферменты могут распознавать определенные модели спаривания оснований, которые идентифицируют определенные регуляторные области генов. Водородная связь — это химический механизм, который лежит в основе правил спаривания оснований, описанных выше. Соответствующее геометрическое соответствие доноров и акцепторов водородных связей позволяет стабильно образовываться только «правильным» парам. ДНК с высоким содержанием GC более стабильна, чем ДНК с низким содержанием GC , но вопреки распространенному мнению, водородные связи не стабилизируют ДНК в значительной степени, а стабилизация в основном обусловлена взаимодействиями при стэкинге . [2]
Более крупные азотистые основания , аденин и гуанин, являются членами класса двухкольцевых химических структур, называемых пуринами ; более мелкие азотистые основания, цитозин и тимин (и урацил), являются членами класса однокольцевых химических структур, называемых пиримидинами . Пурины комплементарны только пиримидинам: пары пиримидин-пиримидин энергетически невыгодны, поскольку молекулы находятся слишком далеко друг от друга для образования водородных связей; пары пурин-пурин энергетически невыгодны, поскольку молекулы находятся слишком близко, что приводит к перекрывающемуся отталкиванию. Единственными другими возможными парами являются GT и AC; эти пары являются несоответствиями, поскольку паттерны доноров и акцепторов водорода не соответствуют друг другу. Пара оснований GU с двумя водородными связями довольно часто встречается в РНК .
Гибридизация — это процесс связывания комплементарных пар оснований с образованием двойной спирали . Плавление — это процесс, при котором взаимодействия между цепями двойной спирали разрываются, разделяя две цепи нуклеиновой кислоты. Эти связи слабые, легко разделяются при легком нагревании, ферментами или физической силой. Плавление происходит преимущественно в определенных точках нуклеиновой кислоты. [3] Последовательности, богатые T и A, плавятся легче, чем области, богатые C и G. Определенные ступени оснований также подвержены плавлению ДНК, особенно ступени оснований TA и TG . [4] Эти механические особенности отражаются в использовании последовательностей, таких как TATAA, в начале многих генов, чтобы помочь РНК-полимеразе плавить ДНК для транскрипции.
Разделение цепей путем осторожного нагревания, как это используется в ПЦР , является простым, если молекулы имеют менее 10 000 пар оснований (10 килобаз или 10 кбн). Переплетение цепей ДНК затрудняет разделение длинных сегментов. Клетка избегает этой проблемы, позволяя своим ферментам, плавящим ДНК ( хеликазам ), работать одновременно с топоизомеразами , которые могут химически расщеплять фосфатный остов одной из цепей, чтобы она могла вращаться вокруг другой. Хеликазы раскручивают цепи, чтобы облегчить продвижение ферментов, считывающих последовательность, таких как ДНК-полимераза .

Вторичная структура нуклеиновой кислоты обычно делится на спирали (смежные пары оснований) и различные виды петель (неспаренные нуклеотиды, окруженные спиралями). Часто эти элементы или их комбинации далее классифицируются по дополнительным категориям, включая, например, тетрапетли , псевдоузлы и стебель-петли . Топологические подходы могут использоваться для категоризации и сравнения сложных структур, которые возникают в результате объединения этих элементов в различных расположениях.
Двойная спираль — важная третичная структура в молекулах нуклеиновых кислот, которая тесно связана с вторичной структурой молекулы. Двойная спираль образована областями многих последовательных пар оснований.
Двойная спираль нуклеиновой кислоты представляет собой спиральный полимер, обычно правосторонний, содержащий две нуклеотидные нити, которые спариваются вместе. Один виток спирали составляет около десяти нуклеотидов и содержит большую и малую бороздки, большая бороздка шире малой бороздки. [5] Учитывая разницу в ширине большой и малой бороздки, многие белки, которые связываются с ДНК, делают это через более широкую большую бороздку. [6] Возможны многие формы двойной спирали; для ДНК тремя биологически значимыми формами являются A-ДНК , B-ДНК и Z-ДНК , в то время как двойные спирали РНК имеют структуры, похожие на форму A ДНК.
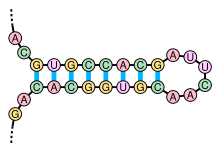
Вторичная структура молекул нуклеиновых кислот часто может быть однозначно разложена на стебли и петли. Структура стебель-петля (также часто называемая «шпилькой»), в которой спаренная спираль заканчивается короткой неспаренной петлей, чрезвычайно распространена и является строительным блоком для более крупных структурных мотивов, таких как структуры клеверного листа, которые представляют собой четырехспиральные соединения, такие как те, что встречаются в транспортной РНК . Внутренние петли (короткая серия неспаренных оснований в более длинной парной спирали) и выпуклости (области, в которых одна нить спирали имеет «дополнительные» вставленные основания без аналогов в противоположной нити) также часто встречаются.
Существует множество элементов вторичной структуры, имеющих функциональное значение для биологических РНК; некоторые известные примеры — Rho-независимые терминаторные петли-стебли и тРНК-клеверный лист . Продолжаются активные исследования по определению вторичной структуры молекул РНК, с подходами, включающими как экспериментальные , так и вычислительные методы (см. также Список программного обеспечения для прогнозирования структуры РНК ).
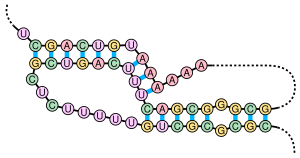
Псевдоузел — это вторичная структура нуклеиновой кислоты, содержащая по крайней мере две структуры стебель-петля , в которых половина одного стебля вставлена между двумя половинами другого стебля. Псевдоузлы складываются в трехмерные конформации в форме узла, но не являются истинными топологическими узлами . Спаривание оснований в псевдоузлах не является хорошо вложенным; то есть пары оснований встречаются так, что «перекрывают» друг друга в положении последовательности. Это делает невозможным предсказание наличия общих псевдоузлов в последовательностях нуклеиновых кислот стандартным методом динамического программирования , который использует рекурсивную систему подсчета для идентификации парных стеблей и, следовательно, не может обнаружить невложенные пары оснований с помощью общих алгоритмов. Однако ограниченные подклассы псевдоузлов можно предсказать с помощью модифицированных динамических программ. [8] Более новые методы предсказания структуры, такие как стохастические контекстно-свободные грамматики, также не способны рассматривать псевдоузлы.
Псевдоузлы могут образовывать различные структуры с каталитической активностью [9] , и несколько важных биологических процессов зависят от молекул РНК, которые образуют псевдоузлы. Например, РНК-компонент человеческой теломеразы содержит псевдоузел, который имеет решающее значение для ее активности. [7] Рибозим вируса гепатита дельта является хорошо известным примером каталитической РНК с псевдоузлом в ее активном центре. [10] [11] Хотя ДНК также может образовывать псевдоузлы, они, как правило, не присутствуют в стандартных физиологических условиях .
Большинство методов предсказания вторичной структуры нуклеиновых кислот основаны на термодинамической модели ближайшего соседа. [12] [13] Обычный метод определения наиболее вероятных структур с учетом последовательности нуклеотидов использует алгоритм динамического программирования , который стремится найти структуры с низкой свободной энергией. [14] Алгоритмы динамического программирования часто запрещают псевдоузлы или другие случаи, в которых пары оснований не полностью вложены, поскольку рассмотрение этих структур становится вычислительно очень дорогим даже для небольших молекул нуклеиновых кислот. Другие методы, такие как стохастические контекстно-свободные грамматики, также могут использоваться для предсказания вторичной структуры нуклеиновых кислот.
Для многих молекул РНК вторичная структура очень важна для правильной функции РНК — часто даже важнее, чем фактическая последовательность. Этот факт помогает в анализе некодирующих РНК, иногда называемых «РНК-генами». Одно из приложений биоинформатики использует предсказанные вторичные структуры РНК для поиска в геноме некодирующих, но функциональных форм РНК. Например, микроРНК имеют канонические длинные структуры стебля-петли, прерываемые небольшими внутренними петлями.
Вторичная структура РНК применяется в сплайсинге РНК у некоторых видов. Было показано, что у людей и других четвероногих без белка U2AF2 процесс сплайсинга подавляется. Однако у данио-рерио и других костистых процесс сплайсинга РНК все еще может происходить на определенных генах в отсутствие U2AF2. Это может быть связано с тем, что 10% генов у данио-рерио имеют чередующиеся пары оснований TG и AC в 3'-сайте сплайсинга (3'ss) и 5'-сайте сплайсинга (5'ss) соответственно на каждом интроне, что изменяет вторичную структуру РНК. Это говорит о том, что вторичная структура РНК может влиять на сплайсинг, потенциально без использования белков, таких как U2AF2, которые, как считалось, необходимы для сплайсинга. [15]
Вторичная структура РНК может быть определена из атомных координат (третичная структура), полученных с помощью рентгеновской кристаллографии , часто депонированной в Protein Data Bank . Текущие методы включают 3DNA/DSSR [16] и MC-аннотацию. [17]