
Хлоропластная ДНК ( cpDNA ), также известная как пластидная ДНК ( ptDNA ), представляет собой ДНК, расположенную в хлоропластах, которые являются фотосинтетическими органеллами, расположенными внутри клеток некоторых эукариотических организмов. Хлоропласты, как и другие типы пластид , содержат геном, отдельный от генома в ядре клетки . Существование хлоропластной ДНК было идентифицировано биохимически в 1959 году [1] и подтверждено электронной микроскопией в 1962 году. [2] Открытия того, что хлоропласт содержит рибосомы [3] и выполняет синтез белка [4], показали, что хлоропласт генетически полуавтономен. Первые полные последовательности генома хлоропласта были опубликованы в 1986 году, Nicotiana tabacum (табак) Сугиурой и коллегами и Marchantia polymorpha (печеночница) Озеки и др. [5] [6] С тех пор были секвенированы десятки тысяч геномов хлоропластов различных видов .
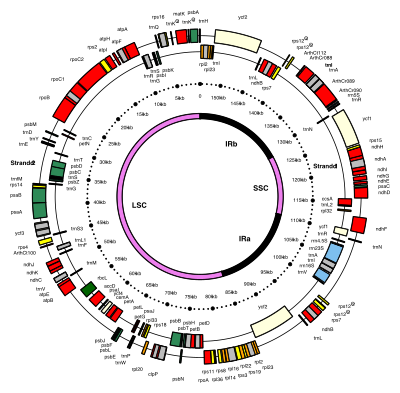
ДНК хлоропластов имеют кольцевую форму и обычно имеют длину 120 000–170 000 пар оснований . [7] [8] [9] Длина их контура может составлять около 30–60 микрометров, а масса — около 80–130 миллионов дальтон . [10]
У большинства хлоропластов весь хлоропластный геном объединен в одно большое кольцо, хотя геном динофитовых водорослей является заметным исключением — их геном разбит примерно на сорок небольших плазмид , каждая длиной 2000–10 000 пар оснований . [11] Каждое мини-кольцо содержит от одного до трех генов, [11] но также были обнаружены пустые плазмиды без кодирующей ДНК .
Долгое время считалось, что хлоропластная ДНК имеет кольцевую структуру, но некоторые данные свидетельствуют о том, что хлоропластная ДНК чаще всего принимает линейную форму. [12] Было обнаружено, что более 95% хлоропластной ДНК в хлоропластах кукурузы имеют разветвленную линейную форму, а не отдельные кольца. [11]
Многие хлоропластные ДНК содержат два инвертированных повтора , которые разделяют длинный однокопийный участок (LSC) от короткого однокопийного участка (SSC). [9]
Длина инвертированных повторов сильно различается, от 4000 до 25000 пар оснований каждый. [11] Инвертированные повторы в растениях, как правило, находятся на верхнем конце этого диапазона, каждый из них имеет длину 20000–25000 пар оснований. [9] [13] Области инвертированных повторов обычно содержат три гена рибосомальной РНК и два гена тРНК , но их можно расширить или сократить , чтобы содержать всего четыре или более 150 генов. [11] Хотя данная пара инвертированных повторов редко бывает полностью идентичной, они всегда очень похожи друг на друга, по-видимому, в результате согласованной эволюции . [11]
Инвертированные повторы высококонсервативны среди наземных растений и накапливают мало мутаций. [9] [13] Похожие инвертированные повторы существуют в геномах цианобактерий и двух других хлоропластных линий ( glaucophyta и rhodophyceæ ), что позволяет предположить, что они предшествуют хлоропластам, [11] хотя некоторые хлоропластные ДНК, такие как ДНК гороха и нескольких красных водорослей [11], с тех пор утратили инвертированные повторы. [13] [14] Другие, такие как красная водоросль Porphyra, перевернули один из своих инвертированных повторов (сделав их прямыми повторами). [11] Возможно, что инвертированные повторы помогают стабилизировать остальную часть хлоропластного генома, поскольку хлоропластные ДНК, которые утратили некоторые из инвертированных повторных сегментов, имеют тенденцию перестраиваться больше. [14]
Каждый хлоропласт содержит около 100 копий своей ДНК в молодых листьях, уменьшаясь до 15–20 копий в старых листьях. [15] Они обычно упакованы в нуклеоиды , которые могут содержать несколько идентичных колец хлоропластной ДНК. В каждом хлоропласте можно найти много нуклеоидов. [10]
Хотя хлоропластная ДНК не связана с истинными гистонами , [16] в красных водорослях был обнаружен гистоноподобный хлоропластный белок (HC), кодируемый хлоропластной ДНК, который плотно упаковывает каждое кольцо хлоропластной ДНК в нуклеоид . [17]
У примитивных красных водорослей нуклеоиды хлоропластной ДНК сгруппированы в центре хлоропласта, тогда как у зеленых растений и зеленых водорослей нуклеоиды рассеяны по всей строме . [17]
Более 5000 геномов хлоропластов были секвенированы и доступны через базу данных геномов органелл NCBI. [18] Первые геномы хлоропластов были секвенированы в 1986 году у табака ( Nicotiana tabacum ) [19] и печеночника ( Marchantia polymorpha ). [20] Сравнение последовательностей генов цианобактерий Synechocystis с геномом хлоропластов Arabidopsis подтвердило эндосимбиотическое происхождение хлоропластов. [21] [22] Оно также продемонстрировало значительную степень переноса генов от предка цианобактерий в ядерный геном.
У большинства видов растений геном хлоропласта кодирует приблизительно 120 генов. [23] [24] Гены в основном кодируют основные компоненты фотосинтетического аппарата и факторы, участвующие в их экспрессии и сборке. [25] У разных видов наземных растений набор генов, кодируемых геномом хлоропласта, довольно консервативен. Он включает четыре рибосомальные РНК , приблизительно 30 тРНК , 21 рибосомальный белок и 4 субъединицы комплекса РНК-полимеразы , кодируемой пластидами , которые участвуют в экспрессии генов пластид. [25] Большая субъединица Рубиско и 28 фотосинтетических тилакоидных белков кодируются в геноме хлоропласта. [25]
Со временем многие части генома хлоропласта были перенесены в ядерный геном хозяина, [7] [8] [26] этот процесс называется эндосимбиотическим переносом генов . В результате геном хлоропласта сильно сокращен по сравнению с геномом свободноживущих цианобактерий. Хлоропласты могут содержать 60–100 генов, тогда как цианобактерии часто имеют более 1500 генов в своем геноме. [27] Паразитические пилостили даже утратили свои пластидные гены для тРНК . [28] Напротив, известно лишь несколько случаев, когда гены были перенесены в хлоропласт от различных доноров, включая бактерии. [29] [30] [31]
Эндосимбиотический перенос генов — это то, как мы узнаем об утраченных хлоропластах во многих хромальвеолятных линиях. Даже если хлоропласт в конечном итоге теряется, гены, которые он передал ядру бывшего хозяина, сохраняются, что свидетельствует о существовании утраченного хлоропласта. Например, в то время как диатомовые водоросли ( гетероконтофит ) теперь имеют хлоропласт, полученный из красной водоросли , наличие многих генов зеленых водорослей в ядре диатомовых водорослей свидетельствует о том, что предок диатомовых водорослей (вероятно, также предок всех хромальвеолят) в какой-то момент имел хлоропласт, полученный из зеленой водоросли , который впоследствии был заменен красным хлоропластом. [32]
У наземных растений около 11–14% ДНК в их ядрах можно проследить до хлоропласта, [33] до 18% у Arabidopsis , что соответствует примерно 4500 генам, кодирующим белки. [34] Недавно было несколько случаев переноса генов из ДНК хлоропласта в ядерный геном у наземных растений. [8]
Из приблизительно трех тысяч белков, обнаруженных в хлоропластах, около 95% кодируются ядерными генами. Многие белковые комплексы хлоропласта состоят из субъединиц как из генома хлоропласта, так и из ядерного генома хозяина. В результате синтез белка должен быть скоординирован между хлоропластом и ядром. Хлоропласт в основном находится под ядерным контролем, хотя хлоропласты также могут выдавать сигналы, регулирующие экспрессию генов в ядре, что называется ретроградной сигнализацией . [35]
Синтез белка в хлоропластах зависит от РНК-полимеразы, кодируемой собственным геномом хлоропласта, которая связана с РНК-полимеразами, обнаруженными в бактериях. Хлоропласты также содержат загадочную вторую РНК-полимеразу, кодируемую ядерным геномом растения. Две РНК-полимеразы могут распознавать и связываться с различными видами промоторов в геноме хлоропласта. [36] Рибосомы в хлоропластах похожи на бактериальные рибосомы. [37]
Редактирование РНК — это вставка, удаление и замена нуклеотидов в транскрипте мРНК перед трансляцией в белок. Высокоокислительная среда внутри хлоропластов увеличивает скорость мутации, поэтому для сохранения функциональных последовательностей необходимы посттранскрипционные репарации. Хлоропластная эдитосома заменяет C -> U и U -> C в очень специфических местах транскрипта. Это может изменить кодон на аминокислоту или восстановить нефункциональный псевдоген, добавив стартовый кодон AUG или удалив преждевременный стоп-кодон UAA. [38]
Эдитосома распознает и связывается с цис-последовательностью выше сайта редактирования. Расстояние между сайтом связывания и сайтом редактирования варьируется в зависимости от гена и белков, участвующих в эдитосоме. Сотни различных белков PPR из ядерного генома участвуют в процессе редактирования РНК. Эти белки состоят из 35-мерных повторяющихся аминокислот, последовательность которых определяет сайт связывания цис для отредактированного транскрипта. [38]
Базальные наземные растения, такие как печеночники, мхи и папоротники, имеют сотни различных участков редактирования, в то время как цветковые растения обычно имеют от тридцати до сорока. Паразитические растения, такие как Epifagus virginiana, демонстрируют потерю редактирования РНК, что приводит к потере функции генов фотосинтеза. [39]
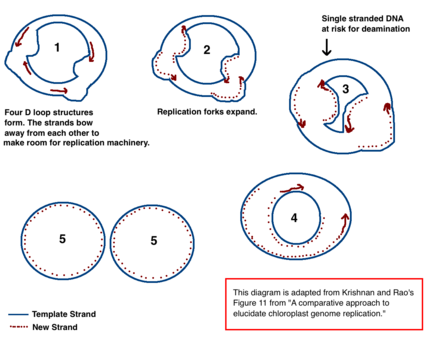
Механизм репликации хлоропластной ДНК (cpDNA) окончательно не определен, но были предложены две основные модели. Ученые пытались наблюдать репликацию хлоропластов с помощью электронной микроскопии с 1970-х годов. [40] [41] Результаты экспериментов с микроскопией привели к идее, что хлоропластная ДНК реплицируется с использованием двойной петли смещения (D-петли). Когда D-петля движется по кольцевой ДНК, она принимает форму тета-посредника, также известную как промежуточное звено репликации Кэрнса, и завершает репликацию с помощью механизма катящегося круга. [40] [12] Репликация начинается в определенных точках происхождения. Открываются множественные репликационные вилки , позволяя репликационному аппарату реплицировать ДНК. По мере продолжения репликации вилки растут и в конечном итоге сходятся. Новые структуры cpDNA разделяются, создавая дочерние хромосомы cpDNA.
В дополнение к ранним экспериментам по микроскопии эта модель также подтверждается количеством дезаминирования , наблюдаемым в хпДНК. [40] Дезаминирование происходит, когда теряется аминогруппа , и является мутацией , которая часто приводит к изменению оснований. Когда аденин дезаминируется, он становится гипоксантином (H). Гипоксантин может связываться с цитозином , и когда пара оснований HC реплицируется, он становится GC (таким образом, происходит изменение основания A → G). [42]

В хпДНК существует несколько градиентов дезаминирования A → G. ДНК становится восприимчивой к событиям дезаминирования, когда она одноцепочечная. Когда образуются репликационные вилки, некопируемая нить становится одноцепочечной и, таким образом, подвержена риску дезаминирования A → G. Таким образом, градиенты в дезаминировании указывают на то, что репликационные вилки, скорее всего, присутствовали, и на направление, в котором они изначально открылись (самый высокий градиент, скорее всего, находится ближе всего к стартовой точке, поскольку она была одноцепочечной в течение самого длительного периода времени). [40] Этот механизм по-прежнему является ведущей теорией сегодня; однако вторая теория предполагает, что большая часть хпДНК на самом деле линейна и реплицируется посредством гомологичной рекомбинации. Она также утверждает, что только меньшая часть генетического материала хранится в кольцевых хромосомах, в то время как остальная часть находится в разветвленных, линейных или других сложных структурах. [40] [12]
Одна из основных конкурирующих моделей для хпДНК утверждает, что большая часть хпДНК линейна и участвует в гомологичной рекомбинации и репликационных структурах, подобных бактериофагу T4 . [12] Было установлено, что некоторые растения имеют линейную хпДНК, например, кукуруза, и что еще больше растений содержат сложные структуры, которые ученые пока не понимают; [12] однако, сегодня преобладает мнение, что большая часть хпДНК является кольцевой. Когда проводились первоначальные эксперименты с хпДНК, ученые заметили линейные структуры; однако они приписали эти линейные формы разорванным кругам. [12] Если разветвленные и сложные структуры, наблюдаемые в экспериментах с хпДНК, являются реальными, а не артефактами конкатенированной кольцевой ДНК или разорванных кругов, то механизм репликации D-петли недостаточен для объяснения того, как эти структуры будут реплицироваться. [12] В то же время гомологичная рекомбинация не объясняет множественные градиенты A → G, наблюдаемые в пластомах. [40] Этот недостаток является одним из самых больших для теории линейной структуры.
Перемещение стольких хлоропластных генов в ядро означает, что многие хлоропластные белки , которые должны были транслироваться в хлоропласте, теперь синтезируются в цитоплазме. Это означает, что эти белки должны быть направлены обратно в хлоропласт и импортированы по крайней мере через две хлоропластные мембраны. [43]
Любопытно, что около половины белковых продуктов перенесенных генов даже не направляются обратно в хлоропласт. Многие стали экзаптациями , взяв на себя новые функции, такие как участие в клеточном делении , маршрутизация белков и даже устойчивость к болезням . Несколько генов хлоропластов нашли новое пристанище в митохондриальном геноме — большинство из них стали нефункциональными псевдогенами , хотя несколько генов тРНК все еще работают в митохондрии . [27] Некоторые перенесенные белковые продукты ДНК хлоропластов направляются в секреторный путь [27] (хотя многие вторичные пластиды ограничены самой внешней мембраной, полученной из клеточной мембраны хозяина , и, следовательно, топологически находятся вне клетки, потому что для того, чтобы добраться до хлоропласта из цитозоля , вам нужно пересечь клеточную мембрану , как если бы вы направлялись во внеклеточное пространство . В этих случаях нацеленные на хлоропласт белки изначально перемещаются по секреторному пути). [44]
Поскольку клетка, приобретающая хлоропласт, уже имела митохондрии (и пероксисомы , и клеточную мембрану для секреции), новому хозяину хлоропласта пришлось разработать уникальную систему нацеливания белков , чтобы избежать отправки хлоропластных белков в неправильную органеллу . [43]
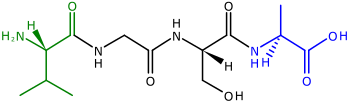
Полипептиды , предшественники белков , представляют собой цепи аминокислот . Два конца полипептида называются N-концом , или аминоконцом , и C-концом , или карбоксильным концом . [45] Для многих (но не всех) [46] хлоропластных белков, кодируемых ядерными генами, к N-концам полипептидов добавляются расщепляемые транзитные пептиды , которые используются для направления полипептида в хлоропласт для импорта [43] [47] (N-концевые транзитные пептиды также используются для направления полипептидов в митохондрии растений ). [48] N-концевые транзитные последовательности также называются препоследовательностями [43], потому что они расположены на «переднем» конце полипептида — рибосомы синтезируют полипептиды от N-конца к C-концу. [45]
Транзитные пептиды хлоропласта демонстрируют огромные различия в длине и аминокислотной последовательности . [47] Они могут быть длиной от 20 до 150 аминокислот [43] — необычно большая длина, предполагающая, что транзитные пептиды на самом деле представляют собой наборы доменов с различными функциями. [47] Транзитные пептиды, как правило, положительно заряжены , [43] богаты гидроксилированными аминокислотами, такими как серин , треонин и пролин , и бедны кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота . [47] В водном растворе транзитная последовательность образует случайную спираль. [43]
Однако не все хлоропластные белки включают N-концевой отщепляемый транзитный пептид. [43] Некоторые включают транзитную последовательность в функциональную часть самого белка. [43] У некоторых транзитная последовательность вместо этого присоединена к их C-концу . [49] Большинство полипептидов, у которых отсутствуют N-концевые целевые последовательности, — это те, которые отправляются на внешнюю мембрану хлоропласта , плюс по крайней мере один отправляется на внутреннюю мембрану хлоропласта . [43]
После того, как хлоропластный полипептид синтезирован на рибосоме в цитозоле , энергия АТФ может быть использована для фосфорилирования или добавления фосфатной группы ко многим (но не ко всем) из них в их транзитных последовательностях. [43] Серин и треонин (оба очень распространены в транзитных последовательностях хлоропласта — составляя 20–30% последовательности) [50] часто являются аминокислотами , которые принимают фосфатную группу . [48] [50] Фермент , который осуществляет фосфорилирование, специфичен для хлоропластных полипептидов и игнорирует те, которые предназначены для митохондрий или пероксисом . [50]
Фосфорилирование изменяет форму полипептида, [50] облегчая присоединение белков 14-3-3 к полипептиду. [43] [51] В растениях белки 14-3-3 связываются только с препротеинами хлоропласта. [48] Он также связан с белком теплового шока Hsp70 , который удерживает полипептид от преждевременного сворачивания . [43] Это важно, поскольку не позволяет белкам хлоропласта принимать активную форму и выполнять свои функции хлоропласта в неправильном месте — цитозоле . [48] [ 51] В то же время они должны сохранять достаточную форму, чтобы их можно было распознать и импортировать в хлоропласт. [48]
Белок теплового шока и белки 14-3-3 вместе образуют цитозольный комплекс управления, который облегчает импорт полипептида хлоропласта в хлоропласт. [43]
В качестве альтернативы, если транзитный пептид препротеина хлоропласта не фосфорилирован, препротеин хлоропласта все еще может прикрепляться к белку теплового шока или Toc159. Эти комплексы могут связываться с комплексом TOC на внешней мембране хлоропласта, используя энергию GTP . [43]
Комплекс TOC , или транслокон на внешней мембране хлоропласта , представляет собой набор белков, которые импортируют препротеины через внешнюю оболочку хлоропласта . Было идентифицировано пять субъединиц комплекса TOC — два GTP - связывающих белка Toc34 и Toc159, туннель импорта белка Toc75, а также белки Toc64 [43] и Toc12. [46]
Первые три белка образуют комплекс ядра, состоящий из одного Toc159, четырех-пяти Toc34 и четырех Toc75, которые образуют четыре отверстия в диске диаметром 13 нанометров . Весь комплекс ядра весит около 500 килодальтон . Два других белка, Toc64 и Toc12, связаны с комплексом ядра, но не являются его частью. [46]
Toc34 — это интегральный белок внешней мембраны хлоропласта, закрепленный в ней своим гидрофобным [53] C-концевым хвостом. [43] [51] Однако большая часть белка, включая его большой домен , связывающий гуанозинтрифосфат (ГТФ), выступает в строму. [51]
Работа Toc34 заключается в том, чтобы поймать некоторые препротеины хлоропласта в цитозоле и передать их остальной части комплекса TOC. [43] Когда GTP , энергетическая молекула, похожая на АТФ, присоединяется к Toc34, белок становится гораздо более способным связываться со многими препротеинами хлоропласта в цитозоле . [43] Присутствие препротеина хлоропласта заставляет Toc34 расщеплять GTP на гуанозиндифосфат (GDP) и неорганический фосфат . Эта потеря GTP заставляет белок Toc34 высвобождать препротеин хлоропласта, передавая его следующему белку TOC. [43] Затем Toc34 высвобождает истощенную молекулу GDP, вероятно, с помощью неизвестного фактора обмена GDP . Домен Toc159 может быть фактором обмена, который осуществляет удаление GDP. Затем белок Toc34 может захватить другую молекулу GTP и начать цикл заново. [43]
Toc34 можно отключить посредством фосфорилирования . Протеинкиназа, дрейфующая по внешней мембране хлоропласта, может использовать АТФ для добавления фосфатной группы к белку Toc34, не давая ему возможности получить другую молекулу ГТФ , ингибируя активность белка. Это может обеспечить способ регулирования импорта белка в хлоропласты. [43] [51]
Arabidopsis thaliana имеет два гомологичных белка, AtToc33 и AtToc34 ( At означает A rabidopsis t haliana ), [43] [51] каждый из которых примерно на 60% идентичен по аминокислотной последовательности Toc34 в горохе (называется ps Toc34). [51] AtToc33 является наиболее распространенным в Arabidopsis , [51] и является функциональным аналогом Toc34, поскольку его можно отключить фосфорилированием. AtToc34, с другой стороны, не может быть фосфорилирован. [43] [51]
Toc159 — это еще одна субъединица TOC, связывающая GTP , как и Toc34. Toc159 имеет три домена . На N- конце находится A-домен, который богат кислыми аминокислотами и занимает около половины длины белка. [43] [53] A-домен часто отщепляется , оставляя фрагмент в 86 килодальтон , называемый Toc86. [53] В середине находится его домен связывания GTP , который очень похож на гомологичный домен связывания GTP в Toc34. [43] [53] На C- конце находится гидрофильный M-домен, [43] который прикрепляет белок к внешней мембране хлоропласта. [53]
Toc159, вероятно, работает во многом подобно Toc34, распознавая белки в цитозоле с помощью GTP . Он может регулироваться посредством фосфорилирования , но другой протеинкиназой, нежели та, которая фосфорилирует Toc34. [46] Его M-домен образует часть туннеля, по которому перемещаются препротеины хлоропласта, и, по-видимому, обеспечивает силу, которая проталкивает препротеины, используя энергию GTP . [43]
Toc159 не всегда обнаруживается как часть комплекса TOC — его также находили растворенным в цитозоле . Это говорит о том, что он может действовать как челнок, который находит препротеины хлоропласта в цитозоле и переносит их обратно в комплекс TOC. Однако прямых доказательств такого поведения немного. [43]
Семейство белков Toc159, Toc159, Toc132, Toc120 и Toc90 были обнаружены в Arabidopsis thaliana . Они различаются по длине своих A-доменов, которые полностью исчезли в Toc90. Toc132, Toc120 и Toc90, по-видимому, имеют специализированные функции по импорту таких вещей, как нефотосинтетические препротеины, и не могут заменить Toc159. [43]

Toc75 — наиболее распространенный белок на внешней оболочке хлоропласта. Это трансмембранная трубка, которая образует большую часть самой поры TOC. Toc75 — это β-бочкообразный канал, выстланный 16 β-складчатыми листами . [43] Отверстие, которое он образует, имеет ширину около 2,5 нанометров на концах и сжимается до диаметра около 1,4–1,6 нанометров в самой узкой точке — достаточно широкое, чтобы пропускать частично свернутые препротеины хлоропласта. [43]
Toc75 также может связываться с препротеинами хлоропластов, но делает это гораздо хуже, чем Toc34 или Toc159. [43]
Arabidopsis thaliana имеет несколько изоформ Toc75, которые названы по хромосомным позициям генов , которые их кодируют. AtToc75 III является наиболее распространенной из них. [43]
Транслокон TIC , или транслокон на внутренней мембране хлоропласта , транслокон [ 43] — это еще один белковый комплекс, который импортирует белки через внутреннюю оболочку хлоропласта . Полипептидные цепи хлоропласта, вероятно, часто проходят через два комплекса одновременно, но комплекс TIC также может извлекать препротеины, потерянные в межмембранном пространстве . [43]
Как и транслокон TOC , транслокон TIC имеет большой комплекс ядра , окруженный некоторыми слабо связанными периферическими белками, такими как Tic110, Tic40 и Tic21. [54] Комплекс ядра весит около одного миллиона дальтон и содержит Tic214, Tic100, Tic56 и Tic20 I, возможно, по три каждого. [54]
Tic20 — это интегральный белок, который, как полагают, имеет четыре трансмембранные α-спирали . [43] Он обнаружен в комплексе TIC массой 1 миллион дальтон . [54] Поскольку он похож на бактериальные транспортеры аминокислот и митохондриальный импортный белок Tim17 [ 43 ] ( транслоказа на внутренней митохондриальной мембране ), [55] было предложено, что он является частью импортного канала TIC. [43] Однако in vitro доказательств этого нет . [43] Известно , что у Arabidopsis thaliana примерно на каждые пять белков Toc75 во внешней мембране хлоропласта приходится два белка Tic20 I (основная форма Tic20 у Arabidopsis ) во внутренней мембране хлоропласта. [54]
В отличие от Tic214, Tic100 или Tic56, Tic20 имеет гомологичных родственников в цианобактериях и почти во всех линиях хлоропластов, что предполагает, что он эволюционировал до первого эндосимбиоза хлоропластов. Tic214, Tic100 и Tic56 уникальны для хлоропластов хлоропластов, что предполагает, что они эволюционировали позже. [54]
Tic214 — это еще один комплексный белок ядра TIC, названный так потому, что он весит чуть менее 214 килодальтон . Он состоит из 1786 аминокислот и, как полагают, имеет шесть трансмембранных доменов на своем N- конце. Tic214 примечателен тем, что кодируется хлоропластной ДНК, а точнее первой открытой рамкой считывания ycf1 . Tic214 и Tic20 вместе, вероятно, составляют часть комплекса TIC в один миллион дальтон , который охватывает всю мембрану . Tic20 скрыт внутри комплекса, в то время как Tic214 выставлен на обеих сторонах внутренней мембраны хлоропласта . [54]
Tic100 — это ядерный кодируемый белок, состоящий из 871 аминокислоты . 871 аминокислота в совокупности весит немного меньше 100 тысяч дальтон , и поскольку зрелый белок, вероятно, не теряет никаких аминокислот, когда импортируется в хлоропласт (у него нет расщепляемого транзитного пептида ), он был назван Tic100. Tic100 находится на краях комплекса в 1 миллион дальтон на стороне, которая обращена к межмембранному пространству хлоропласта . [54]
Tic56 также является ядерным кодируемым белком. Препротеин, который кодирует его ген, имеет длину 527 аминокислот и весит около 62 тысяч дальтон ; зрелая форма, вероятно, подвергается обработке, которая урезает его до веса 56 тысяч дальтон, когда он импортируется в хлоропласт. Tic56 в значительной степени встроен в комплекс в 1 миллион дальтон. [54]
Tic56 и Tic100 высококонсервативны среди наземных растений, но они не похожи ни на один белок, чья функция известна. Ни один из них не имеет трансмембранных доменов . [54]
количество копий цДНК на хлоропласт.