
В органической химии гидроборирование относится к присоединению связи водород - бор к некоторым двойным и тройным связям с участием углерода ( C=C , C=N , C=O и C≡C ). Эта химическая реакция полезна в органическом синтезе органических соединений .
Гидроборирование производит органоборановые соединения , которые реагируют с различными реагентами, образуя полезные соединения, такие как спирты , амины или алкилгалогениды . Наиболее широко известная реакция органоборанов — окисление для получения спиртов из алкенов.
Развитие этой технологии и лежащие в ее основе концепции были отмечены Нобелевской премией по химии Герберту С. Брауну . [1] [2]

Большая часть оригинальной работы по гидроборированию использовала диборан в качестве источника BH 3 . Однако обычно вместо него используют комплекс диметилсульфида борана BH 3 S(CH 3 ) 2 (BMS). [4] Его можно получить в высококонцентрированных формах. [5]
Аддукт BH 3 (THF) также коммерчески доступен в виде растворов THF. Его срок годности меньше, чем у BMS. [ 6]
С точки зрения результатов синтеза диборан или более удобные в обращении БМС и боран-ТГФ эквивалентны.
Стехиометрия гидроборирования алкенов обычно следующая:
В экстремальных случаях, таких как ризамещенные алкены, гидроборирование дает. Эта значительная разница в скорости получения ди- и триалкилборанов полезна в синтезе объемных боранов, которые могут повысить региоселективность.
С точки зрения региохимии гидроборирование обычно является антимарковниковским , то есть водород присоединяется к наиболее замещенному углероду двойной связи. То, что региохимия обратна типичному присоединению HX, отражает полярность связей B δ+ -H δ− . Гидроборирование протекает через четырехчленное переходное состояние: атомы водорода и бора присоединяются к одной и той же стороне двойной связи. При условии, что механизм согласован, образование связи CB протекает немного быстрее, чем образование связи CH. В результате в переходном состоянии бор приобретает частично отрицательный заряд, в то время как более замещенный углерод несет частично положительный заряд. Этот частичный положительный заряд лучше поддерживается более замещенным углеродом. Формально реакция является примером реакции переноса группы . Однако анализ задействованных орбиталей показывает, что реакция является «псевдоперициклической» и не подчиняется правилам Вудворда-Хоффмана для перициклической реакционной способности.
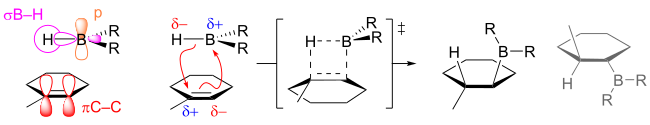

Гидроборирование тризамещенных алкенов помещает бор на менее замещенный углерод. [7]
Гидроборирование 1,2-дизамещенных алкенов, таких как цис- или транс -олефин, обычно дает смесь двух органоборанов сопоставимых количеств, даже если стерические свойства заместителей сильно различаются. Для таких 1,2-дизамещенных олефинов региоселективность может наблюдаться только тогда, когда один из двух заместителей представляет собой фенильное кольцо. В таких случаях, таких как транс -1-фенилпропен, атом бора размещается на углероде, соседнем с фенильным кольцом. Наблюдения выше показывают, что присоединение связи HB к олефинам находится под электронным, а не стерическим контролем.
Гидроборирование алкинов дает алкенилбораны. Стереохимия - цис-присоединение. С терминальными алкинами образуются как H 2 BCH=HR , так и HB(CH=CHR) 2 . Часто при гидроборировании алкинов используют объемные бораны, такие как 9-BBN, для получения моноалкенилборановых продуктов. Алкенилбораны восприимчивы ко многим реакциям, таким как протонолиз с образованием алкена и окисление с образованием альдегида или кетона. [8]
Как отмечено Нобелевской премией Брауна, гидроборирование широко практикуется, поскольку алкилбораны подвержены многим реакциям.
Обработка алкилборанов основанием и перекисью водорода дает спирты:



Итоговая реакция — гидратация.
Поскольку присоединение HB к олефинам является стереоспецифическим, эта реакция окисления будет диастереоселективной , если алкен является тризамещенным. [9] Таким образом, гидроборирование-окисление является прекрасным способом получения спиртов стереоспецифическим и антимарковниковским способом.
Гидроборирование также может привести к аминам путем обработки промежуточных органоборанов монохлорамином или О-гидроксиламинсульфоновой кислотой (HSA). [10]
Конечные олефины преобразуются в соответствующие алкилбромиды и алкилиодиды путем обработки промежуточных соединений органоборанов бромом [11] или иодом [12] . Однако такие реакции не оказались очень популярными, поскольку реагенты на основе сукцинимида, такие как NIS и NBS, более универсальны и не требуют жестких условий, как органобораны и т. д.
Триалкилбораны реагируют с оксидом углерода, давая гомологированные продукты, такие как 2-бора-1,3-диоксоланы. Когда добавление CO проводится в присутствии гидридного восстановителя, образуется первичный спирт.
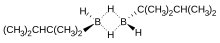
Одним из примеров моноалкилборана является тексилборан (ThxBH2 ) , полученный гидроборированием тетраметилэтилена : [13]
Хиральным примером является моноизопинокамфеилборан. Хотя его часто записывают как IpcBH 2 , он представляет собой димер [IpcBH 2 ] 2 . Его получают путем гидроборирования (−)‐α‐пинена с диметилсульфидом борана . [14]
Монобромо- и монохлороборан можно получить из BMS и соответствующих тригалогенидов бора. Стабильный комплекс монохлороборана и 1,4-диоксана вызывает гидроборирование терминальных алкенов. [15]
Среди затрудненных диалкилборанов выделяется дисиамилборан , сокращенно Sia 2 BH. Он также является димером. Благодаря своему стерическому объему он селективно гидроборирует менее затрудненные, обычно терминальные алкены в присутствии более замещенных алкенов. [16] Дисиамилборан должен быть свежеприготовленным, так как его растворы можно хранить при температуре 0 °C только в течение нескольких часов. Дициклогексилборан Chx 2 BH демонстрирует улучшенную термическую стабильность, чем Sia 2 BH.
Универсальным диалкилбораном является 9-BBN . Также называемый «банановым бораном», он существует в виде димера. Реакции с 9-BBN обычно происходят при 60–80 °C, при этом большинство алкенов реагируют в течение одного часа. Тетразамещенные алкены присоединяют 9-BBN при повышенной температуре. Гидроборирование алкенов с 9-BBN протекает с превосходной региоселективностью. Он более чувствителен к стерическим различиям, чем Sia 2 BH, возможно, из-за его жесткой основной цепи C 8. 9-BBN более реакционноспособен по отношению к алкенам, чем к алкинам. [17]
Для каталитического гидроборирования широко используются пинаколборан и катехолборан . Они также проявляют более высокую реакционную способность по отношению к алкинам. [18] Пинаколборан также широко используется в гидроборировании без катализатора.