Хемиосмос — это движение ионов через полупроницаемую мембранную связанную структуру по их электрохимическому градиенту . Важным примером является образование аденозинтрифосфата (АТФ) путем движения ионов водорода (H + ) через мембрану во время клеточного дыхания или фотосинтеза .
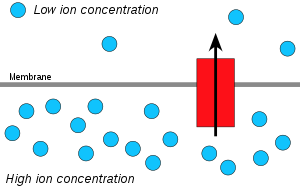
Ионы водорода, или протоны , будут диффундировать из области с высокой концентрацией протонов в область с более низкой концентрацией протонов, и электрохимический градиент концентрации протонов через мембрану может быть использован для производства АТФ. Этот процесс связан с осмосом , движением воды через селективную мембрану, поэтому он называется «хемиосмос».
АТФ-синтаза — это фермент , который производит АТФ путем хемиосмоса. Он позволяет протонам проходить через мембрану и использует разницу свободной энергии для преобразования фосфорилированного аденозиндифосфата (АДФ) в АТФ. АТФ-синтаза состоит из двух частей: CF0 (присутствует в тилакоидной мембране) и CF1 (выступает на внешней поверхности тилакоидной мембраны). Нарушение протонного градиента приводит к конформационным изменениям в CF1, обеспечивая достаточно энергии в этом процессе для преобразования АДФ в АТФ. Генерация АТФ путем хемиосмоса происходит в митохондриях и хлоропластах , а также в большинстве бактерий и архей . Например, в хлоропластах во время фотосинтеза цепь переноса электронов перекачивает ионы H + (протоны) в строму (жидкость) через тилакоидную мембрану в тилакоидные пространства. Запасенная энергия используется для фотофосфорилирования АДФ, в результате чего образуется АТФ, поскольку протоны проходят через АТФ-синтазу.
Питер Д. Митчелл предложил хемиосмотическую гипотезу в 1961 году. [1] Вкратце, гипотеза заключалась в том, что большая часть синтеза аденозинтрифосфата (АТФ) в дышащих клетках происходит за счет электрохимического градиента на внутренних мембранах митохондрий с использованием энергии НАДН и ФАДН 2, образующихся в ходе окислительного распада богатых энергией молекул , таких как глюкоза .
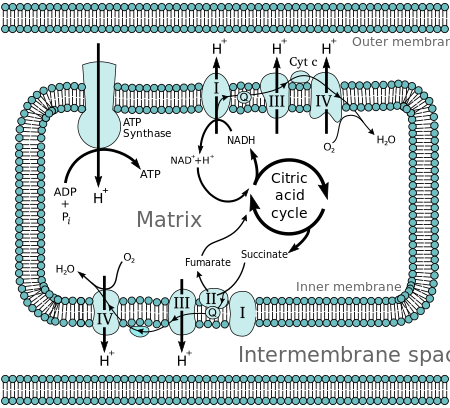
Молекулы, такие как глюкоза, метаболизируются с образованием ацетил-КоА как довольно богатого энергией промежуточного продукта. Окисление ацетил -КоА (ацетил-КоА) в митохондриальной матрице сопряжено с восстановлением молекулы-носителя, такой как никотинамидадениндинуклеотид (НАД) и флавинадениндинуклеотид (ФАД). [2] Носители передают электроны в цепь переноса электронов (ЦПЭ) во внутренней митохондриальной мембране , которая, в свою очередь, передает их другим белкам в ЦПЭ. Энергия на каждом этапе окислительно-восстановительного переноса используется для перекачивания протонов из матрицы в межмембранное пространство, сохраняя энергию в форме трансмембранного электрохимического градиента . Протоны движутся обратно через внутреннюю мембрану через фермент АТФ-синтазу . Поток протонов обратно в матрицу митохондрии через АТФ-синтазу обеспечивает достаточно энергии для АДФ, чтобы соединиться с неорганическим фосфатом и образовать АТФ.
Это было радикальное предложение в то время и не было хорошо принято. Преобладающее мнение состояло в том, что энергия переноса электронов сохраняется в виде стабильного промежуточного продукта с высоким потенциалом, химически более консервативная концепция. Проблема со старой парадигмой заключается в том, что не было обнаружено никакого промежуточного продукта с высокой энергией, а доказательства перекачки протонов комплексами цепи переноса электронов стали слишком значительными, чтобы их игнорировать. В конце концов, вес доказательств начал склоняться в пользу хемиосмотической гипотезы, и в 1978 году Питер Д. Митчелл был удостоен Нобелевской премии по химии . [3]
Хемиосмотическое сопряжение важно для производства АТФ в митохондриях , хлоропластах [4] и многих бактериях и археях [5] .
Движение ионов через мембрану зависит от сочетания двух факторов:
Эти два градиента вместе можно выразить как электрохимический градиент .
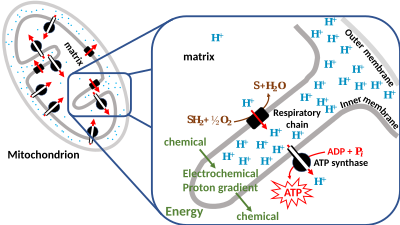
Однако липидные бислои биологических мембран являются барьерами для ионов. Вот почему энергия может храниться в виде комбинации этих двух градиентов через мембрану. Только специальные мембранные белки, такие как ионные каналы , иногда могут позволять ионам перемещаться через мембрану (см. также: Мембранный транспорт ). В хемиосмотической гипотезе трансмембранная АТФ-синтаза играет центральную роль в преобразовании энергии спонтанного потока протонов через них в химическую энергию связей АТФ.
Поэтому исследователи создали термин протон-движущая сила (ПДС), полученный из электрохимического градиента, упомянутого ранее. Его можно описать как меру потенциальной энергии, запасенной ( хемиосмотический потенциал ) как комбинацию градиентов протонов и напряжения (электрического потенциала) через мембрану. Электрический градиент является следствием разделения зарядов через мембрану (когда протоны H + движутся без противоиона , такого как хлорид Cl − ).
В большинстве случаев протон-движущая сила генерируется электрон-транспортной цепью, которая действует как протонный насос, используя свободную энергию Гиббса окислительно -восстановительных реакций для перекачивания протонов (ионов водорода) через мембрану, разделяя заряд через мембрану. В митохондриях энергия, высвобождаемая электрон-транспортной цепью, используется для перемещения протонов из митохондриального матрикса (сторона N) в межмембранное пространство (сторона P). Перемещение протонов из митохондрии создает более низкую концентрацию положительно заряженных протонов внутри нее, что приводит к избыточному отрицательному заряду на внутренней стороне мембраны. Градиент электрического потенциала составляет около -170 мВ [6] , отрицательный внутри (N). Эти градиенты - разность зарядов и разность концентраций протонов - создают объединенный электрохимический градиент через мембрану, часто выражаемый как протон-движущая сила (ПДС). В митохондриях PMF почти полностью состоит из электрического компонента, но в хлоропластах PMF в основном состоит из градиента pH, поскольку заряд протонов H + нейтрализуется движением Cl − и других анионов. В любом случае PMF должен быть больше, чем примерно 460 мВ (45 кДж/моль), чтобы АТФ-синтаза могла производить АТФ.
Протон-движущая сила выводится из свободной энергии Гиббса . Пусть N обозначает внутреннюю часть клетки, а P обозначает внешнюю. Тогда [6]
где
Изменение молярной свободной энергии Гиббса часто интерпретируется как молярный электрохимический ионный потенциал .
Для электрохимического протонного градиента и как следствие:
где
Митчелл определил протондвижущую силу (ПДС) как
Например, подразумевает . При этом уравнение принимает вид:
.
Обратите внимание, что для спонтанного импорта протонов со стороны P (относительно более положительной и кислой) на сторону N (относительно более отрицательной и щелочной) значение отрицательно (аналогично ), тогда как PMF положительно (аналогично потенциалу окислительно-восстановительной ячейки ).
Стоит отметить, что, как и в случае любого процесса трансмембранного транспорта, PMF является направленным. Знак разности трансмембранного электрического потенциала выбран для представления изменения потенциальной энергии на единицу заряда, текущего в клетку, как указано выше. Кроме того, из-за окислительно-восстановительной протонной перекачки участками сопряжения, протонный градиент всегда внутрищелочной. По обеим этим причинам протоны текут спонтанно, со стороны P на сторону N; доступная свободная энергия используется для синтеза АТФ (см. ниже). По этой причине PMF определяется для импорта протонов, который является спонтанным. PMF для экспорта протонов, т. е. протонной перекачки, катализируемой участками сопряжения, является просто отрицательным значением PMF(импорт).
Спонтанность импорта протонов (со стороны P на сторону N) универсальна во всех биоэнергетических мембранах. [8] Этот факт не был признан до 1990-х годов, поскольку просвет тилакоида хлоропласта интерпретировался как внутренняя фаза, но на самом деле он топологически эквивалентен внешней стороне хлоропласта. Аццоне и др. подчеркнули, что внутренняя фаза (сторона N мембраны) — это бактериальная цитоплазма, митохондриальный матрикс или строма хлоропласта; внешняя (P) сторона — это бактериальное периплазматическое пространство, митохондриальное межмембранное пространство или просвет хлоропласта. Кроме того, трехмерная томография внутренней мембраны митохондрий показывает, что ее обширные инвагинации уложены стопкой, подобно тилакоидным дискам; следовательно, межмембранное пространство митохондрий топологически весьма похоже на просвет хлоропласта.: [9]
Энергия, выраженная здесь как свободная энергия Гиббса, электрохимический протонный градиент или протондвижущая сила (ПДС), представляет собой комбинацию двух градиентов на мембране:
Когда система достигает равновесия, ; тем не менее, концентрации по обе стороны мембраны не обязательно должны быть равны. Спонтанное движение через потенциальную мембрану определяется как концентрацией, так и градиентами электрического потенциала.
Молярная свободная энергия Гиббса синтеза АТФ
также называется потенциалом фосфорилирования. Равновесное отношение концентраций можно рассчитать, сравнив и , например, в случае митохондрии млекопитающего: [9]
H + / АТФ = ΔG p / (Δp / 10,4 кДж·моль −1 / мВ) = 40,2 кДж·моль −1 / (173,5 мВ / 10,4 кДж·моль −1 / мВ) = 40,2 / 16,7 = 2,4. Фактическое отношение числа копий протонсвязывающей c-субъединицы к числу копий бета-субъединицы, синтезирующей АТФ, составляет 8/3 = 2,67, что показывает, что в этих условиях митохондрия функционирует с эффективностью 90% (2,4/2,67). [9]
Фактически, термодинамическая эффективность в основном ниже в эукариотических клетках, поскольку АТФ должен быть экспортирован из матрицы в цитоплазму, а АДФ и фосфат должны быть импортированы из цитоплазмы. Это «стоит» одного «дополнительного» импорта протона на АТФ, [6] [7] поэтому фактическая эффективность составляет всего 65% (= 2,4/3,67).

Полное расщепление глюкозы с высвобождением энергии называется клеточным дыханием . Последние этапы этого процесса происходят в митохондриях. Восстановленные молекулы НАДН и ФАДН 2 генерируются циклом Кребса , гликолизом и переработкой пирувата . Эти молекулы передают электроны в цепь переноса электронов , которая высвобождает энергию кислорода для создания протонного градиента через внутреннюю митохондриальную мембрану . Затем АТФ-синтаза использует энергию, запасенную в этом градиенте, для производства АТФ. Этот процесс называется окислительным фосфорилированием , поскольку он использует энергию, высвобождаемую при окислении НАДН и ФАДН 2, для фосфорилирования АДФ в АТФ .
Световые реакции фотосинтеза генерируют АТФ под действием хемиосмоса. Фотоны солнечного света принимаются антенным комплексом фотосистемы II , который возбуждает электроны на более высокий энергетический уровень . Эти электроны перемещаются по цепи переноса электронов , заставляя протоны активно перекачиваться через тилакоидную мембрану в просвет тилакоида . Затем эти протоны текут по градиенту электрохимического потенциала через фермент, называемый АТФ-синтазой, создавая АТФ путем фосфорилирования АДФ до АТФ. Электроны из первоначальной световой реакции достигают фотосистемы I , затем поднимаются на более высокий энергетический уровень световой энергией, а затем принимаются акцептором электронов и восстанавливают НАДФ + до НАДФН . Электроны, потерянные из фотосистемы II, заменяются окислением воды, которая «расщепляется» на протоны и кислород комплексом, выделяющим кислород (OEC, также известным как WOC, или комплексом, окисляющим воду). Для образования одной молекулы двухатомного кислорода фотосистемами I и II должно быть поглощено 10 фотонов, четыре электрона должны пройти через две фотосистемы и образуется 2 НАДФН (позднее используемых для фиксации углекислого газа в цикле Кальвина).
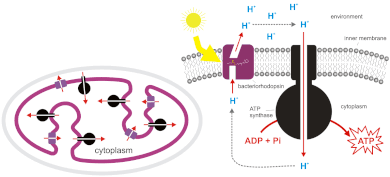
Бактерии и археи также могут использовать хемиосмос для генерации АТФ. Цианобактерии , зеленые серные бактерии и пурпурные бактерии синтезируют АТФ с помощью процесса, называемого фотофосфорилированием . [6] [7] Эти бактерии используют энергию света для создания протонного градиента с помощью фотосинтетической цепи переноса электронов . Нефотосинтетические бактерии, такие как E. coli, также содержат АТФ-синтазу . Фактически, митохондрии и хлоропласты являются продуктами эндосимбиоза и восходят к включенным прокариотам. Этот процесс описан в эндосимбиотической теории . Происхождение митохондрии послужило толчком к возникновению эукариот, а возникновение пластиды — к возникновению Archaeplastida, одной из основных эукариотических супергрупп. [ необходима цитата ]
Хемиосмотическое фосфорилирование — третий путь, который производит АТФ из неорганического фосфата и молекулы АДФ. Этот процесс является частью окислительного фосфорилирования.
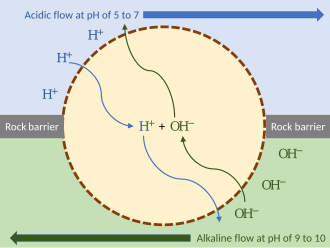
Поэтапная модель возникновения хемиосмоса, ключевого элемента в происхождении жизни на Земле, предполагает, что первобытные организмы использовали термоциклирование в качестве источника энергии (термосинтез), функционируя по сути как тепловой двигатель: [11]
Глубоководные гидротермальные источники , испускающие горячую кислую или щелочную воду, могли бы создать внешние протонные градиенты. Они обеспечивали энергию, которую могли бы использовать первобытные организмы. Чтобы разделить потоки, такой организм мог бы вклиниться в породу гидротермального источника, подвергаясь воздействию гидротермального потока с одной стороны и более щелочной воды с другой. Пока мембрана организма (или пассивные ионные каналы внутри нее) проницаема для протонов, механизм может функционировать без ионных насосов. Такой протоорганизм мог бы затем развить дальнейшие механизмы, такие как ионные насосы и АТФ-синтаза. [10]
Предложенный альтернативный источник хемиосмотической энергии, развивающейся через мембранные структуры, заключается в том, что если акцептор электронов, феррицианид, находится внутри везикулы, а донор электронов — снаружи, хиноны, транспортируемые углеродистыми метеоритами, забирают электроны и протоны от донора. Они будут высвобождать электроны через липидную мембрану путем диффузии в феррицианид внутри везикул и высвобождать протоны, что создает градиенты выше pH 2, процесс способствует развитию протонных градиентов. [12] [13]