Гликозидная связь или гликозидная связь — это тип эфирной связи , которая соединяет молекулу углевода (сахара) с другой группой, которая может быть или не быть другим углеводом.
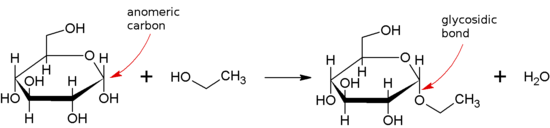
Гликозидная связь образуется между полуацетальной или полукетальной группой сахарида (или молекулы, полученной из сахарида) и гидроксильной группой некоторого соединения, такого как спирт . Вещество, содержащее гликозидную связь, называется гликозидом .
Термин «гликозид» теперь расширен и охватывает также соединения со связями, образованными между полуацетальными (или полукетальными) группами сахаров и несколькими химическими группами, отличными от гидроксилов, такими как -SR (тиогликозиды), -SeR (селеногликозиды), -NR 1 R 2 (N-гликозиды) или даже -CR 1 R 2 R 3 (C-гликозиды).
В частности, в природных гликозидах соединение ROH, из которого удален остаток углевода, часто называют агликоном, а сам остаток углевода иногда называют «гликоном».

Гликозидные связи обсуждаемой выше формы известны как O-гликозидные связи , в отношении гликозидного кислорода , который связывает гликозид с агликоном или восстанавливающим конечным сахаром. По аналогии, можно также рассмотреть S-гликозидные связи (которые образуют тиогликозиды ), где кислород гликозидной связи заменен атомом серы . Таким же образом, N-гликозидные связи имеют кислород гликозидной связи, замененный на азот . Вещества, содержащие N-гликозидные связи, также известны как гликозиламины . C-гликозильные связи имеют гликозидный кислород, замененный на углерод ; термин «C-гликозид» считается неправильным названием ИЮПАК и не рекомендуется. [1] Все эти модифицированные гликозидные связи имеют различную восприимчивость к гидролизу, и в случае C-гликозильных структур они, как правило, более устойчивы к гидролизу.

Когда аномерный центр участвует в гликозидной связи (что часто встречается в природе), то можно различить α- и β-гликозидные связи по относительной стереохимии аномерного положения и стереоцентра, наиболее удаленного от C1 в сахариде. [2]
Фармакологи часто присоединяют вещества к глюкуроновой кислоте через гликозидные связи, чтобы увеличить их растворимость в воде ; это известно как глюкуронирование . Многие другие гликозиды имеют важные физиологические функции.
Нюхтер и др. (2001) продемонстрировали новый подход к гликозидированию по Фишеру . [3] [4] [5] Используя микроволновую печь, оборудованную обратным аппаратом в роторном реакторе с бомбами давления , Нюхтер и др. (2001) смогли достичь 100% выхода α- и β-D-глюкозидов. Этот метод может быть реализован в многокилограммовом масштабе.
Джоши и др. (2006) [6] предлагают реакцию Кенигса-Кнорра в стереоселективном синтезе алкил-D-глюкопиранозидов через гликозилирование, за исключением использования карбоната лития , который менее затратен и токсичен, чем традиционный метод использования солей серебра или ртути . D-глюкоза сначала защищается путем образования перацетата путем добавления уксусного ангидрида в уксусную кислоту , а затем добавления бромистого водорода , который бромирует в 5-м положении. При добавлении спирта ROH и карбоната лития OR заменяет бром, и при снятии защиты ацетилированных гидроксилов продукт синтезируется с относительно высокой чистотой. Джоши и др. (2001) предположили, что литий действует как нуклеофил, который атакует углерод в 5-м положении, и через переходное состояние спирт заменяет группу брома. Преимущества этого метода, а также его стереоселективность и низкая стоимость литиевой соли включают в себя то, что его можно проводить при комнатной температуре, а его выход сравнительно хорошо сопоставим с традиционным методом Кенигса-Кнорра. [7]
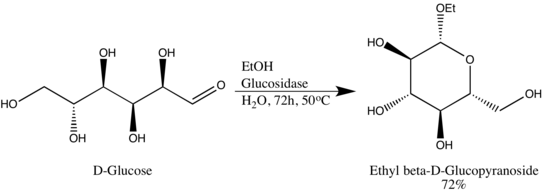
Гликозидгидролазы (или гликозидазы) — это ферменты , которые разрывают гликозидные связи. Гликозидгидролазы обычно могут действовать либо на α-, либо на β-гликозидные связи, но не на обе сразу. Эта специфичность позволяет исследователям получать гликозиды в большом эпимерном избытке, одним из примеров является преобразование Вэнь-Я Лу D-глюкозы в этил β-D-глюкопиранозид с использованием природной глюкозидазы. Вэнь-Я Лу использовал глюкозидазу обратным образом, противоположным биологической функциональности фермента: [8]
Прежде чем моносахаридные единицы включаются в гликопротеины, полисахариды или липиды в живых организмах, они обычно сначала «активируются» путем присоединения через гликозидную связь к фосфатной группе нуклеотида, такого как уридиндифосфат (УДФ), гуанозиндифосфат (ГДФ), тимидиндифосфат (ТДФ) или цитидинмонофосфат (ЦМП). Эти активированные биохимические промежуточные продукты известны как сахарные нуклеотиды или доноры сахара. Многие биосинтетические пути используют моно- или олигосахариды, активированные дифосфатной связью с липидами, такими как долихол . Эти активированные доноры затем являются субстратами для ферментов, известных как гликозилтрансферазы , которые переносят сахарную единицу от активированного донора к принимающему нуклеофилу (акцепторному субстрату).

Различные биокаталитические подходы были разработаны для синтеза гликозидов в последние десятилетия, которые с использованием "гликозилтрансфераз" и "гликозидгидролаз" являются одними из наиболее распространенных катализов. Первый часто требует дорогих материалов, а последний часто показывает низкие выходы, Де Винтер и др. [10] исследовали использование целлобиозофосфорилазы (CP) для синтеза альфа-гликозидов в ионных жидкостях. Было обнаружено, что наилучшие условия для использования CP - это присутствие IL AMMOENG 101 и этилацетата.
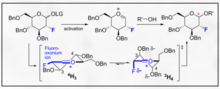
Существует множество химических подходов для поощрения селективности α- и β-гликозидных связей. Высоко субстратспецифическая природа селективности и общая активность пиранозида могут создавать серьезные трудности в синтезе. Общую специфичность гликозилирования можно улучшить, используя подходы, учитывающие относительные переходные состояния, которые аномерный углерод может претерпевать во время типичного гликозилирования. В частности, распознавание и включение моделей Фелкина-Ана-Эйзенштейна в рациональный химический дизайн может, как правило, обеспечивать надежные результаты при условии, что трансформация может претерпевать этот тип конформационного контроля в переходном состоянии.
Гликозилирование, направленное фтором, представляет собой обнадеживающий рычаг как для селективности B, так и для введения неприродной биомиметической функциональности C2 в углеводе. Один инновационный пример, представленный Бушером и др., дает способ использовать фтороксоний-ион и трихлорацетимидат для стимулирования стереоселективности B посредством эффекта гоша. [11] Эта разумная стереоселективность ясна благодаря визуализации моделей Фелкина-Ана возможных форм стульев.
Этот метод представляет собой многообещающий способ селективного включения B-этил-, изопропил- и других гликозидов с типичной химией трихлорацетимидата.
Недавно было показано, что O-связанные гликопептиды демонстрируют превосходную проницаемость ЦНС и эффективность в нескольких моделях животных с болезненными состояниями. Кроме того, одним из наиболее интригующих аспектов является способность O-гликозилирования продлевать период полураспада, уменьшать клиренс и улучшать PK/PD активного пептида помимо увеличения проникновения в ЦНС. Врожденное использование сахаров в качестве солюбилизирующих фрагментов в метаболизме фазы II и III (глюкуроновые кислоты) в значительной степени обеспечило эволюционное преимущество в том, что ферменты млекопитающих не эволюционируют напрямую для расщепления O-гликозилированных продуктов на более крупных фрагментах.
Своеобразная природа O-связанных гликопептидов заключается в том, что существует множество примеров, которые проникают в ЦНС. Считается, что фундаментальная основа этого эффекта включает «мембранный скачок» или «диффузию скачка». Считается, что процесс «диффузии скачка», вызванный неброуновским движением, происходит из-за разрыва плазматической мембраны. «Диффузия скачка» в частности объединяет свободную диффузию и межкомпонентные переходы. Недавние примеры, в частности, включают высокую проницаемость аналогов мет-энкефалина среди других пептидов. Полный агонист mOR пентапептид DAMGO также проникает в ЦНС при введении гликозилирования. [12] [13] [14]
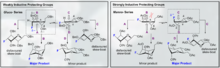
Молекулы ДНК содержат 5-членные углеродные кольца, называемые рибозами, которые напрямую присоединены к двум фосфатным группам и нуклеиновому основанию, содержащему аминогруппы. Атомы азота из аминогруппы в нуклеотидах ковалентно связаны с аномерным углеродом структуры сахара рибозы через N-гликозидную связь. Иногда нуклеиновые основания, присоединенные к рибозе, подвергаются дезаминированию, алкилированию или окислению, что приводит к цитотоксическим повреждениям вдоль остова ДНК. Эти модификации серьезно угрожают связности молекулы ДНК, что приводит к развитию таких заболеваний, как рак. ДНК-гликозилазы — это ферменты, которые катализируют гидролиз N-гликозидной связи для освобождения поврежденного или измененного нуклеинового основания из ДНК путем расщепления гликозидной связи углерод-азот на 2'-углероде, впоследствии инициируя путь репарации эксцизии оснований (BER).
Монофункциональные гликозилазы катализируют гидролиз N-гликозидной связи либо по ступенчатому механизму типа S N 1, либо по согласованному механизму типа S N 2. При ступенчатой функции нуклеиновое основание действует как уходящая группа до того, как аномерный углерод атакуется молекулой воды, образуя недолговечный нестабильный промежуточный ион оксакарбения . Этот промежуточный продукт быстро реагирует с близлежащей молекулой воды, заменяя N-гликозидную связь рибозы и нуклеинового основания на O-гликозидную связь с гидроксигруппой. При согласованном механизме вода действует как нуклеофил и атакует аномерный углерод до того, как нуклеобаза начинает действовать как уходящая группа. Образующийся промежуточный продукт представляет собой аналогичный ион оксакарбения, в котором и гидроксигруппы, и нуклеиновое основание все еще присоединены к аномерному углероду. Оба механизма теоретически дают один и тот же продукт. Большинство рибонуклеотидов гидролизуются посредством согласованного механизма типа S N 2, тогда как большинство дезоксирибонуклеотидов гидролизуются посредством ступенчатого механизма.
Эти реакции практически необратимы. В связи с тем, что расщепление N-гликозидной связи от остова ДНК может привести к пагубным мутагенным и цитотоксическим реакциям в организме, обладают способностью также катализировать синтез N-гликозидных связей посредством абазического участка ДНК и специфического нуклеинового основания. [15]