

Давление пара [а] или равновесное давление пара — это давление , оказываемое паром , находящимся в термодинамическом равновесии со своими конденсированными фазами (твердыми или жидкими) при данной температуре в закрытой системе . Равновесное давление пара является показателем термодинамической тенденции жидкости к испарению. Это относится к балансу частиц, выходящих из жидкости (или твердого тела) в равновесии с частицами, находящимися в сосуществующей паровой фазе. Вещество с высоким давлением пара при нормальной температуре часто называют летучим . Давление пара, присутствующего над поверхностью жидкости, известно как давление пара. По мере повышения температуры жидкости притягивающие взаимодействия между молекулами жидкости становятся менее значимыми по сравнению с энтропией этих молекул в газовой фазе, что увеличивает давление пара. Таким образом, жидкости с сильными межмолекулярными взаимодействиями, вероятно, будут иметь меньшее давление пара, а для более слабых взаимодействий верно обратное.
Давление пара любого вещества увеличивается нелинейно с температурой, что часто описывается соотношением Клаузиуса-Клапейрона . Точка кипения жидкости при атмосферном давлении (также известная как нормальная точка кипения ) — это температура, при которой давление пара равняется атмосферному давлению окружающей среды. При любом постепенном повышении этой температуры давление пара становится достаточным, чтобы преодолеть атмосферное давление и заставить жидкость образовывать пузырьки пара. Для формирования пузырьков на большой глубине жидкости требуется немного более высокая температура из-за более высокого давления жидкости из-за гидростатического давления массы жидкости наверху. Более важным на малых глубинах является более высокая температура, необходимая для начала образования пузырьков. Поверхностное натяжение стенок пузырька приводит к избыточному давлению в очень маленьких начальных пузырьках.
Давление пара, которое один компонент смеси вносит в общее давление в системе, называется парциальным давлением . Например, воздух на уровне моря, насыщенный водяным паром при температуре 20 °C, имеет парциальное давление около 2,3 кПа воды, 78 кПа азота , 21 кПа кислорода и 0,9 кПа аргона , что в сумме составляет 102,2 кПа, что составляет основу для стандартного атмосферного давления .
Давление пара измеряется в стандартных единицах давления . Международная система единиц (СИ) признает давление как производную единицу измерения силы на площадь и определяет паскаль (Па) в качестве стандартной единицы. Один паскаль равен одному ньютону на квадратный метр (Н·м -2 или кг·м -1 ·с -2 ).
Экспериментальное измерение давления пара — простая процедура для обычных давлений от 1 до 200 кПа. [1] Наиболее точные результаты получаются вблизи точки кипения веществ, а большие ошибки возникают при измерениях менее 1 кПа . Процедуры часто состоят из очистки испытуемого вещества, его изоляции в контейнере, удаления постороннего газа и последующего измерения равновесного давления газовой фазы вещества в контейнере при различных температурах. Лучшая точность достигается, если следить за тем, чтобы все вещество и его пары имели заданную температуру. Это часто делается, как и при использовании изотенископа , путем погружения зоны содержания в ванну с жидкостью.
Очень низкое давление паров твердых веществ можно измерить с помощью метода эффузионной ячейки Кнудсена .
В медицинском контексте давление пара иногда выражается в других единицах, например в миллиметрах ртутного столба (мм рт. ст.) . Это важно для летучих ингаляционных анестетиков , большинство из которых представляют собой жидкости при температуре тела, но с относительно высоким давлением паров.
Уравнение Антуана [2] [3] представляет собой прагматическое математическое выражение связи между давлением пара и температурой чистых жидких или твердых веществ. Он получается путем аппроксимации кривой и адаптирован к тому факту, что давление пара обычно увеличивается и вогнуто в зависимости от температуры. Основная форма уравнения:
и его можно преобразовать в такую явную для температуры форму:
где:
Иногда используется более простая форма уравнения всего с двумя коэффициентами:
который можно преобразовать в:
Сублимация и испарение одного и того же вещества имеют разные наборы коэффициентов Антуана, как и компоненты в смесях. [2] Каждый набор параметров для конкретного соединения применим только в определенном диапазоне температур. Обычно температурные диапазоны выбираются так, чтобы поддерживать точность уравнения на уровне от нескольких до 8–10 процентов. Для многих летучих веществ доступно несколько различных наборов параметров, которые используются для разных температурных диапазонов. Уравнение Антуана имеет низкую точность при использовании любого набора параметров от точки плавления соединения до его критической температуры. Точность также обычно низкая, когда давление пара ниже 10 Торр из-за ограничений аппарата [ нужна ссылка ] , используемого для установления значений параметра Антуана.
Уравнение Вагнера [4] дает «одно из лучших» [5] приближений к экспериментальным данным, но оно довольно сложное. Он выражает пониженное давление пара как функцию пониженной температуры.
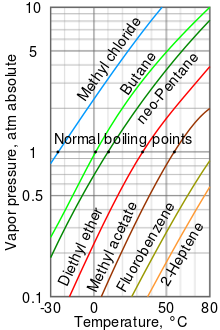
Как правило, давление паров жидкостей при температуре окружающей среды увеличивается с понижением температуры кипения. Это проиллюстрировано на диаграмме давления пара (см. справа), на которой показаны графики зависимости давления пара от температуры для различных жидкостей. [6] При нормальной температуре кипения жидкости давление паров равно стандартному атмосферному давлению, определяемому как 1 атмосфера, [7] 760 Торр, 101,325 кПа или 14,69595 фунтов на квадратный дюйм.
Например, при любой заданной температуре хлористый метил имеет самое высокое давление паров среди всех жидкостей, представленных на диаграмме. Он также имеет самую низкую нормальную температуру кипения - -24,2 ° C (-11,6 ° F), где кривая давления пара метилхлорида (синяя линия) пересекает горизонтальную линию абсолютного давления пара в одну атмосферу ( атм ). .
Хотя зависимость между давлением пара и температурой нелинейна, на диаграмме используется логарифмическая вертикальная ось для создания слегка изогнутых линий, поэтому на одной диаграмме можно отобразить множество жидкостей. Почти прямая линия получается, если отложить логарифм давления пара от 1/(T + 230) [8] , где T — температура в градусах Цельсия. Давление пара жидкости при температуре ее кипения равно давлению окружающей среды.
Закон Рауля дает приближение к давлению пара смесей жидкостей. В нем говорится, что активность (давление или фугитивность ) однофазной смеси равна взвешенной по мольным долям сумме давлений паров компонентов:
где – давление пара смеси, – мольная доля компонента в жидкой фазе и – мольная доля компонента в паровой фазе соответственно. – давление паров компонента . Закон Рауля применим только к неэлектролитам (незаряженным веществам); он наиболее подходит для неполярных молекул со слабым межмолекулярным притяжением (например, силами Лондона ).
О системах, давление паров которых выше, чем указано в приведенной выше формуле, говорят, что они имеют положительные отклонения. Такое отклонение предполагает более слабое межмолекулярное притяжение, чем в чистых компонентах, так что молекулы можно считать менее прочно «удерживаемыми» в жидкой фазе, чем в чистой жидкости. Примером может служить азеотроп из примерно 95% этанола и воды. Поскольку давление пара азеотропа выше, чем предсказывает закон Рауля, он кипит при температуре ниже температуры любого чистого компонента.
Существуют также системы с отрицательными отклонениями, у которых давление пара ниже ожидаемого. Такое отклонение свидетельствует о более сильном межмолекулярном притяжении между компонентами смеси, чем в чистых компонентах. Таким образом, молекулы «удерживаются» в жидкости сильнее, когда присутствует вторая молекула. Примером может служить смесь трихлорметана (хлороформа) и 2-пропанона (ацетона), которая кипит выше температуры кипения любого чистого компонента.
Отрицательные и положительные отклонения можно использовать для определения коэффициентов термодинамической активности компонентов смесей.
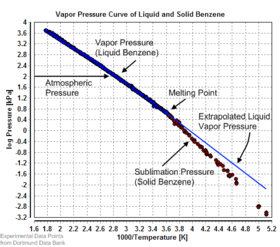
Равновесное давление пара можно определить как давление, достигаемое, когда конденсированная фаза находится в равновесии с собственным паром. В случае равновесного твердого тела, такого как кристалл , это можно определить как давление, при котором скорость сублимации твердого тела соответствует скорости осаждения его паровой фазы. Для большинства твердых веществ это давление очень низкое, но некоторыми заметными исключениями являются нафталин , сухой лед (давление пара сухого льда составляет 5,73 МПа (831 фунт на квадратный дюйм, 56,5 атм) при 20 ° C, что приводит к разрыву большинства герметичных контейнеров) и лед. Все твердые материалы имеют давление пара. Однако из-за их часто чрезвычайно низких значений измерение может быть довольно трудным. Типичные методы включают использование термогравиметрии и транспирации газа.
Существует ряд методов расчета давления сублимации (т. е. давления пара) твердого тела. Один из методов состоит в том, чтобы оценить давление сублимации на основе экстраполированного давления паров жидкости (переохлажденной жидкости), если известна теплота плавления , используя эту конкретную форму соотношения Клаузиуса – Клапейрона: [9]
где:
Этот метод предполагает, что теплота плавления не зависит от температуры, игнорирует дополнительные температуры перехода между различными твердыми фазами и дает точную оценку температур, не слишком далеких от точки плавления. Это также показывает, что давление сублимации ниже, чем экстраполированное давление паров жидкости (Δ fus H > 0), и разница растет с увеличением расстояния от точки плавления.

Как и все жидкости, вода закипает, когда давление ее пара достигает окружающего давления. В природе атмосферное давление ниже на возвышенностях и вода кипит при более низкой температуре. Температуру кипения воды при атмосферном давлении можно аппроксимировать уравнением Антуана :
или преобразовано в эту явно выраженную по температуре форму:
где температура — это точка кипения в градусах Цельсия , а давление — в торр .
Правило Дюринга гласит, что существует линейная зависимость между температурами, при которых два раствора оказывают одинаковое давление пара.
В следующей таблице представлен список различных веществ, упорядоченных по увеличению давления паров (в абсолютных единицах).
Существует несколько эмпирических методов оценки давления пара на основе молекулярной структуры органических молекул. Некоторыми примерами являются метод SIMPOL.1, [13], метод Моллера и др., [9] и ИСПАРЕНИЕ (Оценка давления паров органических соединений, учет температуры, внутримолекулярных эффектов и эффектов неаддитивности). [14] [15]
В метеорологии термин « давление пара» означает парциальное давление водяного пара в атмосфере, даже если оно не находится в равновесии. [16] Это отличается от его значения в других науках. [16] Согласно глоссарию метеорологии Американского метеорологического общества , давление насыщенного пара правильно относится к равновесному давлению пара воды над плоской поверхностью жидкой воды или твердого льда и является функцией только температуры и того, является ли конденсированная фаза жидкой. или твердый. [17] Относительная влажность определяется относительно давления насыщенного пара. [18] Равновесное давление пара не требует, чтобы конденсированная фаза имела плоскую поверхность; он может состоять из крошечных капель, возможно, содержащих растворенные вещества (примеси), например облако . [19] [18] Равновесное давление пара может значительно отличаться от давления насыщенного пара в зависимости от размера капель и присутствия других частиц, которые действуют как ядра конденсации облаков . [19] [18]
Однако эти термины используются непоследовательно, и некоторые авторы используют «давление насыщенного пара» за пределами узкого значения, данного в Глоссарии AMS . Например, в тексте об атмосферной конвекции говорится: « Эффект Кельвина приводит к тому, что давление насыщенного пара над изогнутой поверхностью капли становится больше, чем над плоской поверхностью воды» (выделено автором). [20]
Все еще актуальный термин «давление пара насыщения» происходит от устаревшей теории о том, что водяной пар растворяется в воздухе и что воздух при данной температуре может удерживать только определенное количество воды, прежде чем станет «насыщенным». [18] На самом деле, как утверждает закон Дальтона (известный с 1802 года), парциальное давление водяного пара или любого вещества вообще не зависит от воздуха, а соответствующей температурой является температура жидкости. [18] Тем не менее, среди общественности и даже метеорологов сохраняется ошибочное мнение, чему способствуют вводящие в заблуждение термины « давление насыщения » и «пересыщение» , а также связанное с ними определение относительной влажности . [18]