Деметилирование — это химический процесс, в результате которого из молекулы удаляется метильная группа (CH 3 ). [1] [2] Распространенным способом деметилирования является замена метильной группы атомом водорода, что приводит к чистой потере одного атома углерода и двух атомов водорода.
Аналогом деметилирования является метилирование .

Деметилирование имеет отношение к эпигенетике . Деметилирование ДНК катализируется деметилазами . Эти ферменты окисляют N-метильные группы, которые встречаются в гистонах , в производных лизина и в некоторых формах ДНК. [4]
Одним из семейств таких окислительных ферментов является цитохром P450 . [5] Альфа-кетоглутарат-зависимые гидроксилазы также активны для деметилирования ДНК, действуя по схожей стехиометрии. [6] Эти реакции, которые протекают через гидроксилирование , используют слегка ослабленные связи CH метиламинов и метиловых эфиров .
Деметилирование некоторых стеролов является этапом биосинтеза тестостерона и холестерина . Метильные группы теряются в виде формиата . [7]
Метоксигруппы в значительной степени украшают биополимер лигнина . Большой интерес был проявлен к преобразованию этой распространенной формы биомассы в полезные химикаты (помимо топлива). Одним из этапов такой обработки является деметилирование. [8] [9] Деметилирование ванилина , производного лигнина, требует 250 °C (482 °F) и сильного основания. [10] Целлюлозно-бумажная промышленность перерабатывает лигнин с использованием водного сульфида натрия , который частично деполимеризует лигнин. Делигнификация сопровождается обширным O-деметилированием, в результате чего образуется метантиол , который выбрасывается бумажными фабриками . [11]
Деметилирование часто относится к расщеплению эфиров , особенно арильных эфиров. [12]
Исторически арилметиловые эфиры, включая такие природные продукты, как кодеин ( O -метилморфин), деметилировались путем нагревания вещества в расплавленном гидрохлориде пиридина (температура плавления 144 °C (291 °F)) при температуре от 180 до 220 °C (от 356 до 428 °F), иногда с избытком хлористого водорода , в процессе, известном как расщепление эфира Цейзеля-Прея . [13] [14] Количественный анализ ароматических метиловых эфиров может быть выполнен путем аргентометрического определения образовавшегося хлорида N -метилпиридиния . [15] Механизм этой реакции начинается с переноса протона от иона пиридиния к арилметиловому эфиру, крайне неблагоприятная стадия ( K < 10 −11 ), которая объясняет требуемые жесткие условия, учитывая гораздо более слабую кислотность пиридиния ( p K a = 5,2) по сравнению с протонированным арилметиловым эфиром (ион арилметилоксония, p K a = –6,7 для арил = Ph [16] ). За этим следует S N 2 атака иона арилметилоксония на метильную группу либо пиридином , либо ионом хлорида (в зависимости от субстрата) с получением свободного фенола и, в конечном итоге, хлорида N -метилпиридиния, либо напрямую, либо путем последующего переноса метила от метилхлорида к пиридину. [15]

Другой классический (но, опять же, жесткий) метод удаления метильной группы арилметилового эфира заключается в нагревании эфира в растворе бромистого водорода или иодистого водорода , иногда также с уксусной кислотой . [17] Расщепление эфиров бромистоводородной или иодистоводородной кислотой происходит путем протонирования эфира с последующим замещением бромидом или иодидом . Несколько более мягкий набор условий использует циклогексилиодид (CyI, 10,0 экв.) в N , N -диметилформамиде для получения небольшого количества иодистого водорода in situ . [18]
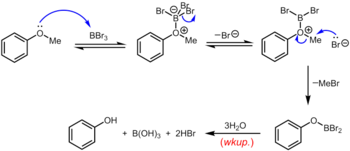
Трибромид бора , который можно использовать при комнатной температуре или ниже, является более специализированным реагентом для деметилирования арилметиловых эфиров. Механизм деалкилирования эфира протекает через первоначальное обратимое образование аддукта кислоты-основания Льюиса между сильнокислым Льюисом BBr 3 и основным эфиром Льюиса. Этот аддукт Льюиса может обратимо диссоциировать с образованием катиона дибромборила оксониума и Br – . Разрыв эфирной связи происходит посредством последующей нуклеофильной атаки на виды оксониума Br – с образованием арилоксидибромборана и бромистого метила. По завершении реакции фенол высвобождается вместе с борной кислотой (H 3 BO 3 ) и бромистоводородной кислотой (водн. HBr) при гидролизе производного дибромборана во время водной обработки . [19]
Более сильные нуклеофилы, такие как диорганофосфиды (LiPPh 2 ), также расщепляют арильные эфиры, иногда в мягких условиях. [20] Другие сильные нуклеофилы, которые были использованы, включают тиолатные соли , такие как EtSNa. [21]
Ароматические метиловые эфиры, особенно те, которые имеют смежную карбонильную группу, могут быть региоселективно деметилированы с использованием эфирата иодида магния . [22] Примером использования этого является синтез природного продукта калфостина А , [23] , как показано ниже.

Метиловые эфиры также подвержены деметилированию, которое обычно достигается путем омыления . Высокоспециализированные деметилирования широко распространены, такие как декарбоксилирование Крапчо :
Смесь анетола , КОН и спирта нагревали в автоклаве. Хотя продуктом этой реакции был ожидаемый анол , Чарльз Доддс также обнаружил высокореакционный продукт димеризации в маточных растворах, называемый дианолом .
N -деметилирование 3° аминов осуществляется по реакции фон Брауна , в которой в качестве реагента для получения соответствующих нор- производных используется BrCN . Была разработана современная вариация реакции фон Брауна, в которой BrCN заменяется этилхлорформиатом . Приготовление Паксила из ареколина является применением этой реакции, а также синтез GSK-372,475 , например.
N - деметилирование имипрамина дает дезипрамин .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )