

Горение , или сгорание , [1] представляет собой высокотемпературную экзотермическую окислительно-восстановительную химическую реакцию между топливом (восстановителем) и окислителем , обычно кислородом воздуха , которая производит окисленные, часто газообразные продукты, в смеси, называемой дымом . Горение не всегда приводит к пожару , потому что пламя видно только тогда, когда вещества, подвергающиеся горению, испаряются, но когда это происходит, пламя является характерным индикатором реакции. В то время как энергия активации должна быть подана для инициирования горения (например, использование зажженной спички для зажигания огня), тепло от пламени может обеспечить достаточно энергии, чтобы сделать реакцию самоподдерживающейся . Изучение горения известно как наука о горении .
Горение часто представляет собой сложную последовательность элементарных радикальных реакций . Твердое топливо , такое как древесина и уголь , сначала подвергается эндотермическому пиролизу для получения газообразного топлива, сгорание которого затем обеспечивает тепло, необходимое для производства большего количества топлива. Горение часто достаточно горячее, чтобы возник свет накаливания в форме либо свечения , либо пламени . Простой пример можно увидеть в сгорании водорода и кислорода в водяной пар , реакция, которая обычно используется для топлива ракетных двигателей . Эта реакция выделяет 242 кДж/моль тепла и соответственно снижает энтальпию (при постоянной температуре и давлении):
Некатализируемое сгорание в воздухе требует относительно высоких температур. Полное сгорание является стехиометрическим относительно топлива, где нет остаточного топлива, и в идеале, нет остаточного окислителя. Термодинамически химическое равновесие сгорания в воздухе в подавляющем большинстве находится на стороне продуктов. Однако полного сгорания практически невозможно достичь, так как химическое равновесие не обязательно достигается или может содержать несгоревшие продукты, такие как оксид углерода , водород и даже углерод ( сажа или зола). Таким образом, образующийся дым обычно токсичен и содержит несгоревшие или частично окисленные продукты. Любое сгорание при высоких температурах в атмосферном воздухе , который на 78 процентов состоит из азота , также будет создавать небольшие количества нескольких оксидов азота , обычно называемых NOx , поскольку сгорание азота термодинамически благоприятно при высоких, но не низких температурах. Поскольку сгорание редко бывает чистым, очистка топливного газа или каталитические нейтрализаторы могут быть обязательными по закону.
Пожары возникают естественным образом, зажигаясь от ударов молнии или вулканических продуктов. Горение ( огонь ) было первой контролируемой химической реакцией, обнаруженной людьми в форме костров и костров , и продолжает оставаться основным методом получения энергии для человечества. Обычно топливом является углерод , углеводороды или более сложные смеси, такие как древесина , содержащая частично окисленные углеводороды. Тепловая энергия, получаемая при сгорании либо ископаемого топлива, такого как уголь или нефть , либо возобновляемого топлива, такого как дрова , собирается для различных целей, таких как приготовление пищи , производство электроэнергии или промышленное или бытовое отопление. Горение также является единственной реакцией, используемой для питания ракет . Горение также используется для уничтожения ( сжигания ) отходов, как неопасных, так и опасных.
Окислители для горения имеют высокий окислительный потенциал и включают в себя атмосферный или чистый кислород , хлор , фтор , трифторид хлора , закись азота и азотную кислоту . Например, водород сгорает в хлоре с образованием хлористого водорода с выделением тепла и света, характерного для горения. Хотя обычно горение не катализируется, горение может катализироваться платиной или ванадием , как в контактном процессе .

При полном сгорании реагент сгорает в кислороде и производит ограниченное количество продуктов. Когда углеводород сгорает в кислороде, реакция в первую очередь даст углекислый газ и воду. Когда элементы сгорают, продуктами в первую очередь являются наиболее распространенные оксиды. Углерод даст углекислый газ , сера даст диоксид серы , а железо даст оксид железа (III) . Азот не считается горючим веществом, когда окислителем является кислород . Тем не менее, небольшие количества различных оксидов азота (обычно обозначаемых NOхвиды) образуются, когда воздух является окислительным.
Горение не обязательно благоприятствует максимальной степени окисления и может зависеть от температуры. Например, триоксид серы не производится количественно при сжигании серы. Виды NO x появляются в значительных количествах выше примерно 2800 °F (1540 °C), и больше их производится при более высоких температурах. Количество NO x также является функцией избытка кислорода. [2]
В большинстве промышленных применений и при пожарах источником кислорода ( O
2). В воздухе каждый моль кислорода смешивается примерно с3,71 моль азота. Азот не участвует в горении, но при высоких температурах часть азота преобразуется в NOх(в основном NO , с гораздо меньшим количеством NO2). С другой стороны, когда кислорода недостаточно для полного сгорания топлива, часть углерода топлива преобразуется в оксид углерода , а часть водорода остается непрореагировавшей. Таким образом, полный набор уравнений для сгорания углеводорода в воздухе требует дополнительного расчета распределения кислорода между углеродом и водородом в топливе.
Количество воздуха, необходимое для полного сгорания, называется «теоретическим воздухом» или «стехиометрическим воздухом». [3] Количество воздуха, превышающее это значение и фактически необходимое для оптимального сгорания, называется «избыточным воздухом» и может варьироваться от 5% для газового котла до 40% для антрацитового угля и до 300% для газовой турбины . [4]
Неполное сгорание происходит, когда недостаточно кислорода, чтобы топливо полностью прореагировало с образованием углекислого газа и воды. Это также происходит, когда сгорание гасится теплоотводом, таким как твердая поверхность или ловушка пламени. Как и в случае с полным сгоранием, вода образуется при неполном сгорании; однако вместо углекислого газа образуются углерод и оксид углерода .
Для большинства видов топлива, таких как дизельное топливо, уголь или древесина, пиролиз происходит до сгорания. При неполном сгорании продукты пиролиза остаются несгоревшими и загрязняют дым вредными твердыми частицами и газами. Частично окисленные соединения также вызывают беспокойство; частичное окисление этанола может производить вредный ацетальдегид , а углерод может производить токсичный угарный газ.
Конструкции устройств сгорания могут улучшить качество сгорания, например, горелок и двигателей внутреннего сгорания . Дальнейшие улучшения достигаются с помощью каталитических устройств дожигания (например, каталитических нейтрализаторов ) или простого частичного возврата выхлопных газов в процесс сгорания. Такие устройства требуются экологическим законодательством для автомобилей в большинстве стран. Они могут быть необходимы для того, чтобы позволить крупным устройствам сгорания, например, тепловым электростанциям , достичь установленных законом норм выбросов .
Степень сгорания можно измерить и проанализировать с помощью испытательного оборудования. Подрядчики по системам отопления, вентиляции и кондиционирования воздуха , пожарные и инженеры используют анализаторы сгорания для проверки эффективности горелки в процессе сгорания. Кроме того, таким образом можно измерить эффективность двигателя внутреннего сгорания, а некоторые штаты США и местные муниципалитеты используют анализ сгорания для определения и оценки эффективности транспортных средств на дорогах сегодня.
Угарный газ является одним из продуктов неполного сгорания . [5] Образование угарного газа производит меньше тепла, чем образование углекислого газа, поэтому полное сгорание является гораздо более предпочтительным, особенно потому, что угарный газ является ядовитым газом. При вдыхании угарный газ занимает место кислорода и соединяется с частью гемоглобина в крови, делая ее неспособной переносить кислород. [6]
Эти оксиды соединяются с водой и кислородом в атмосфере, создавая азотную кислоту и серную кислоту , которые возвращаются на поверхность Земли в виде кислотных осадков или «кислотных дождей». Кислотные осадки наносят вред водным организмам и убивают деревья. Из-за образования определенных питательных веществ, которые менее доступны для растений, таких как кальций и фосфор, они снижают производительность экосистемы и ферм. Дополнительная проблема, связанная с оксидами азота , заключается в том, что они, наряду с углеводородными загрязнителями, способствуют образованию приземного озона , основного компонента смога. [7]
Вдыхание угарного газа вызывает головную боль, головокружение, рвоту и тошноту. Если уровень угарного газа достаточно высок, люди теряют сознание или умирают. Воздействие умеренных и высоких уровней угарного газа в течение длительного времени положительно коррелирует с риском сердечных заболеваний. Люди, пережившие тяжелое отравление угарным газом, могут страдать от долгосрочных проблем со здоровьем. [8] Угарный газ из воздуха поглощается в легких, а затем связывается с гемоглобином в эритроцитах человека. Это снижает способность эритроцитов переносить кислород по всему телу.
Тление — это медленная, низкотемпературная, беспламенная форма горения, поддерживаемая теплом, выделяющимся при прямом воздействии кислорода на поверхность конденсированного топлива. Это типичная реакция неполного сгорания. Твердые материалы, которые могут поддерживать реакцию тления, включают уголь, целлюлозу , древесину , хлопок , табак , торф , древесный опад , гумус , синтетические пены, обугливающиеся полимеры (включая полиуретановую пену ) и пыль . Распространенными примерами явлений тления являются возникновение пожаров в жилых помещениях на мягкой мебели слабыми источниками тепла (например, сигаретой, короткозамкнутым проводом) и постоянное горение биомассы за пылающими фронтами лесных пожаров .
Спонтанное возгорание — это тип горения, который происходит путем самонагрева (повышение температуры из-за экзотермических внутренних реакций), за которым следует тепловой разгон (самонагрев, который быстро ускоряется до высоких температур) и, наконец, возгорание. Например, фосфор самовоспламеняется при комнатной температуре без применения тепла. Органические материалы, подвергающиеся бактериальному компостированию, могут генерировать достаточно тепла, чтобы достичь точки возгорания. [9]
Горение, приводящее к турбулентному пламени, наиболее часто используется в промышленных применениях (например, в газовых турбинах , бензиновых двигателях и т. д.), поскольку турбулентность способствует процессу смешивания топлива и окислителя .

Термин «микрогравитация» относится к гравитационному состоянию, которое является «низким» (т. е. «микро» в смысле «маленьким» и не обязательно составляет одну миллионную часть нормальной гравитации Земли), так что влияние плавучести на физические процессы можно считать малым по сравнению с другими процессами потока, которые присутствовали бы при нормальной гравитации. В такой среде динамика термического и потокового переноса может вести себя совершенно иначе, чем в условиях нормальной гравитации (например, пламя свечи принимает форму сферы. [10] ). Исследования горения в условиях микрогравитации способствуют пониманию широкого спектра аспектов, которые имеют отношение как к среде космического корабля (например, динамика пожара, имеющая отношение к безопасности экипажа на Международной космической станции ), так и к земным (наземным) условиям (например, динамика горения капель для содействия разработке новых топливных смесей для улучшенного сгорания, процессы изготовления материалов, управление тепловым режимом электронных систем , динамика кипения многофазного потока и многие другие).
Процессы горения, происходящие в очень малых объемах, считаются микросгоранием . Высокое отношение поверхности к объему увеличивает удельные потери тепла. Расстояние гашения играет важную роль в стабилизации пламени в таких камерах сгорания .
В общем случае химическое уравнение стехиометрического горения углеводорода в кислороде выглядит следующим образом :
Например, стехиометрическое горение метана в кислороде:
Если стехиометрическое горение происходит с использованием воздуха в качестве источника кислорода, азот, присутствующий в воздухе ( атмосфера Земли ), может быть добавлен к уравнению (хотя он не реагирует), чтобы показать стехиометрический состав топлива в воздухе и состав полученного дымового газа. Рассмотрение всех некислородных компонентов в воздухе как азота дает отношение «азота» к кислороду 3,77, т. е. (100% − O
2%) / О
2% где О
2% составляет 20,95% об.:
где .
Например, стехиометрическое горение метана в воздухе составляет:
Стехиометрический состав метана в воздухе составляет 1 / (1 + 2 + 7,54) = 9,49% об.
Стехиометрическая реакция горения C α H β O γ на воздухе:
Стехиометрическая реакция горения для C α H β O γ S δ :
Стехиометрическая реакция горения для C α H β O γ N δ S ε :
Стехиометрическая реакция горения для C α H β O γ F δ :
Различные другие вещества начинают появляться в значительных количествах в продуктах сгорания, когда температура пламени превышает примерно1600 К. При использовании избытка воздуха азот может окисляться до NO и, в гораздо меньшей степени, до NO2. CO образуется путем диспропорционирования CO 2 и H2и ОН образуются путем диспропорционирования H 2 O.
Например, когда1 моль пропана сжигается с28,6 моль воздуха (120% от стехиометрического количества), продукты сгорания содержат 3,3% O
2. В1400 К продукты равновесного сгорания содержат 0,03% NO и 0,002% OH . При1800 К , продукты сгорания содержат 0,17% NO , 0,05% OH , 0,01% CO и 0,004% H
2. [11]
Дизельные двигатели работают с избытком кислорода для сжигания мелких частиц , которые имеют тенденцию образовываться только стехиометрическим количеством кислорода, обязательно производя выбросы оксида азота . И Соединенные Штаты, и Европейский союз вводят ограничения на выбросы оксида азота транспортными средствами, что требует использования специальных каталитических нейтрализаторов или обработки выхлопных газов мочевиной (см. Жидкость для дизельных выхлопных газов ).
Неполное (частичное) сгорание углеводорода с кислородом приводит к образованию газовой смеси, содержащей в основном CO
2, CO , H 2 O и H
2. Такие газовые смеси обычно готовятся для использования в качестве защитных атмосфер при термической обработке металлов и для газовой цементации . [12] Общее уравнение реакции неполного сгорания одного моля углеводорода в кислороде имеет вид:
Когда z падает ниже примерно 50% от стехиометрического значения, CH4может стать важным продуктом сгорания; когда z падает ниже примерно 35% от стехиометрического значения, элементарный углерод может стать стабильным.
Продукты неполного сгорания можно рассчитать с помощью материального баланса , предположив, что продукты сгорания достигают равновесия . [13] [14] Например, при сгорании одного моля пропана ( C
3ЧАС
8) с четырьмя молями O
2, образуется семь молей горючего газа, а z составляет 80% от стехиометрического значения. Три уравнения элементарного баланса:
Эти три уравнения сами по себе недостаточны для расчета состава горючего газа. Однако в равновесном положении реакция конверсии воды в газ дает другое уравнение:
Например, в1200 К значение К экв составляет 0,728. [15] Решая, газ сгорания состоит из 42,4% H 2 O , 29,0% CO 2 , 14,7% H
2, и 13,9% CO . Углерод становится стабильной фазой при1200 К иДавление 1 атм , когда z составляет менее 30% от стехиометрического значения, при этом продукты сгорания содержат более 98% H
2и CO и около 0,5% CH
4.
Вещества или материалы, которые подвергаются горению, называются топливами . Наиболее распространенными примерами являются природный газ, пропан, керосин , дизельное топливо , бензин, древесный уголь, каменный уголь, древесина и т. д.
Сгорание жидкого топлива в окислительной атмосфере на самом деле происходит в газовой фазе. Горит пар, а не жидкость. Поэтому жидкость обычно загорается только при достижении определенной температуры: ее точки вспышки . Температура вспышки жидкого топлива — это самая низкая температура, при которой оно может образовать воспламеняющуюся смесь с воздухом. Это минимальная температура, при которой в воздухе достаточно испаренного топлива для начала горения.
Сгорание газообразного топлива может происходить посредством одного из четырех отличительных типов горения: диффузионное пламя , предварительно смешанное пламя , фронт реакции самовоспламенения или как детонация . [16] Тип горения, который фактически происходит, зависит от степени, в которой топливо и окислитель смешаны до нагрева: например, диффузионное пламя образуется, если топливо и окислитель изначально разделены, тогда как в противном случае образуется предварительно смешанное пламя. Аналогичным образом, тип горения также зависит от давления: детонация, например, представляет собой фронт реакции самовоспламенения, связанный с сильной ударной волной, что придает ей характерный пик высокого давления и высокую скорость детонации . [16]
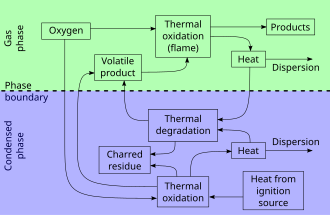
Процесс горения состоит из трех относительно отдельных, но перекрывающихся фаз:
Эффективный процесс нагрева требует рекуперации максимально возможной части тепла сгорания топлива в обрабатываемый материал. [17] [18] Существует много путей потерь в процессе нагрева. Обычно доминирующей потерей является явное тепло, уходящее с отходящим газом (т. е. дымовым газом ). Температура и количество отходящего газа указывают на его теплосодержание ( энтальпию ), поэтому поддержание его количества на низком уровне минимизирует потери тепла.
В идеальной печи поток воздуха для горения будет соответствовать потоку топлива, чтобы дать каждой молекуле топлива точное количество кислорода, необходимое для полного сгорания. Однако в реальном мире горение не происходит идеальным образом. Несгоревшее топливо (обычно CO и H
2) выбрасывается из системы, что представляет собой потерю теплотворной способности (а также угрозу безопасности). Поскольку горючие вещества нежелательны в отходящих газах, а присутствие непрореагировавшего кислорода там представляет минимальные проблемы безопасности и экологии, первым принципом управления горением является обеспечение большего количества кислорода, чем теоретически необходимо для обеспечения сгорания всего топлива. Для метана ( CH
4) для горения, например, требуется чуть больше двух молекул кислорода.
Однако второй принцип управления горением заключается в том, чтобы не использовать слишком много кислорода. Правильное количество кислорода требует трех типов измерений: во-первых, активного контроля потока воздуха и топлива; во-вторых, измерения кислорода в отходящих газах; и, в-третьих, измерения горючих веществ в отходящих газах. Для каждого процесса нагрева существует оптимальное условие минимальной потери тепла отходящих газов с приемлемыми уровнями концентрации горючих веществ. Минимизация избыточного кислорода дает дополнительное преимущество: для заданной температуры отходящих газов уровень NOx самый низкий, когда избыточный кислород поддерживается на самом низком уровне. [2]
Соблюдение этих двух принципов обеспечивается путем составления материального и теплового балансов в процессе сгорания. [19] [20] [21] [22] Материальный баланс напрямую связывает соотношение воздуха и топлива с процентным содержанием O
2в газообразном продукте сгорания. Тепловой баланс связывает тепло, доступное для загрузки, с общим чистым теплом, произведенным при сгорании топлива. [23] [24] Дополнительные материальные и тепловые балансы могут быть сделаны для количественной оценки теплового преимущества от предварительного нагрева воздуха для горения, [25] [26] или обогащения его кислородом. [27] [28]
Горение в кислороде представляет собой цепную реакцию , в которой участвуют многие различные радикальные промежуточные продукты. Высокая энергия, необходимая для инициирования, объясняется необычной структурой молекулы дикислорода . Конфигурация молекулы дикислорода с самой низкой энергией представляет собой стабильный, относительно нереакционноспособный бирадикал в триплетном спиновом состоянии . Связывание можно описать тремя парами связывающих электронов и двумя антисвязывающими электронами с выровненными спинами , так что молекула имеет ненулевой полный угловой момент. Большинство видов топлива, с другой стороны, находятся в синглетном состоянии с парными спинами и нулевым полным угловым моментом. Взаимодействие между ними является квантово-механическим « запрещенным переходом », т. е. возможным с очень малой вероятностью. Для инициирования горения требуется энергия, чтобы заставить дикислород перейти в спин-спаренное состояние или синглетный кислород . Этот промежуточный продукт чрезвычайно реактивен. Энергия поступает в виде тепла , и затем реакция производит дополнительное тепло, что позволяет ей продолжаться.
Считается, что горение углеводородов инициируется отрывом атома водорода (не отрывом протона) от топлива к кислороду, в результате чего образуется гидропероксидный радикал (HOO). Он далее реагирует, образуя гидропероксиды, которые распадаются, образуя гидроксильные радикалы . Существует большое разнообразие этих процессов, в которых образуются топливные радикалы и окислительные радикалы. Окислительные виды включают синглетный кислород, гидроксил, одноатомный кислород и гидропероксил . Такие промежуточные продукты недолговечны и не могут быть изолированы. Однако нерадикальные промежуточные продукты стабильны и образуются при неполном сгорании. Примером является ацетальдегид , образующийся при сгорании этанола . Промежуточный продукт при сгорании углерода и углеводородов, оксид углерода , имеет особое значение, поскольку он является ядовитым газом , но также экономически полезен для производства синтез-газа .
Твердое и тяжелое жидкое топливо также подвергается большому количеству реакций пиролиза , которые дают более легко окисляемое, газообразное топливо. Эти реакции являются эндотермическими и требуют постоянного притока энергии от текущих реакций горения. Недостаток кислорода или другие неправильно спроектированные условия приводят к тому, что эти вредные и канцерогенные продукты пиролиза выбрасываются в виде густого черного дыма.
Скорость горения — это количество материала, которое сгорает за определенный период времени. Может быть выражено в граммах в секунду (г/с) или килограммах в секунду (кг/с).
Подробные описания процессов горения с точки зрения химической кинетики требуют формулирования больших и сложных сетей элементарных реакций. [29] Например, горение углеводородного топлива обычно включает сотни химических видов, реагирующих в соответствии с тысячами реакций.
Включение таких механизмов в вычислительные потоковые решатели все еще представляет собой довольно сложную задачу, в основном в двух аспектах. Во-первых, число степеней свободы (пропорционально числу химических видов) может быть драматически большим; во-вторых, исходный член из-за реакций вводит несоизмеримое число временных масштабов, что делает всю динамическую систему жесткой. В результате прямое численное моделирование турбулентных реактивных потоков с тяжелым топливом вскоре становится невыполнимым даже для современных суперкомпьютеров. [30]
Поэтому было разработано множество методик для снижения сложности механизмов сгорания без прибегания к высоким уровням детализации. Примеры приведены:
Кинетическое моделирование может быть изучено для понимания механизмов реакции термического разложения при горении различных материалов, используя, например, термогравиметрический анализ . [49]

Предполагая идеальные условия сгорания, такие как полное сгорание в адиабатических условиях (т. е. без потери или получения тепла), можно определить адиабатическую температуру сгорания. Формула, которая дает эту температуру, основана на первом законе термодинамики и учитывает тот факт, что тепло сгорания используется исключительно для нагрева топлива, воздуха для сгорания или кислорода и газовых продуктов сгорания (обычно называемых дымовыми газами ).
В случае сжигания ископаемого топлива на воздухе температура горения зависит от всех следующих факторов:
Адиабатическая температура горения (также известная как адиабатическая температура пламени ) увеличивается при более высоких значениях теплоты сгорания, температурах входящего воздуха и топлива, а также при стехиометрических соотношениях воздуха, приближающихся к единице.
Чаще всего адиабатические температуры горения для угля составляют около 2200 °C (3992 °F) (для входящего воздуха и топлива при температуре окружающей среды и для ), около 2150 °C (3902 °F) для нефти и 2000 °C (3632 °F) для природного газа . [50] [51]
В промышленных нагревателях , парогенераторах электростанций и больших газовых турбинах более распространенным способом выражения использования воздуха горения сверх стехиометрического является процент избыточного воздуха горения . Например, избыточный воздух горения в 15 процентов означает, что используется на 15 процентов больше требуемого стехиометрического воздуха.
Нестабильность горения обычно представляет собой сильные колебания давления в камере сгорания. Эти колебания давления могут достигать 180 дБ, и длительное воздействие этих циклических давлений и тепловых нагрузок сокращает срок службы компонентов двигателя. В ракетах, таких как F1, используемых в программе Saturn V, нестабильность приводила к серьезным повреждениям камеры сгорания и окружающих компонентов. Эта проблема была решена путем перепроектирования топливного инжектора. В жидкостных реактивных двигателях размер и распределение капель могут использоваться для смягчения нестабильности. Нестабильность горения является серьезной проблемой в наземных газотурбинных двигателях из-за выбросов NO x . Существует тенденция работать на бедной смеси, с коэффициентом эквивалентности менее 1, для снижения температуры сгорания и, таким образом, снижения выбросов NO x ; однако работа на бедной смеси делает ее очень восприимчивой к нестабильности горения.
Критерий Рэлея является основой для анализа термоакустической нестабильности горения и оценивается с использованием индекса Рэлея за один цикл нестабильности [52]
где q' - возмущение скорости тепловыделения, а p' - флуктуация давления. [53] [54] Когда колебания тепловыделения совпадают по фазе с колебаниями давления, индекс Рэлея положительный, а величина термоакустической неустойчивости максимальна. С другой стороны, если индекс Рэлея отрицательный, то происходит термоакустическое затухание. Критерий Рэлея подразумевает, что термоакустическую неустойчивость можно оптимально контролировать, имея колебания тепловыделения на 180 градусов в противофазе с колебаниями давления на той же частоте. [55] [56] Это минимизирует индекс Рэлея.