Доброкачественная опухоль — это масса клеток ( опухоль ), которая не прорастает соседние ткани и не метастазирует (распространяется по всему организму). По сравнению со злокачественными (раковыми) опухолями , доброкачественные опухоли обычно имеют более медленный темп роста . Доброкачественные опухоли имеют относительно хорошо дифференцированные клетки. Они часто окружены внешней поверхностью (фиброзной оболочкой соединительной ткани ) или остаются внутри эпителия . Распространенными примерами доброкачественных опухолей являются родинки и миома матки .
Некоторые формы доброкачественных опухолей могут быть вредными для здоровья. Доброкачественный рост опухоли вызывает массовый эффект , который может сдавливать соседние ткани. Это может привести к повреждению нервов, уменьшению кровотока ( ишемия ), гибели тканей ( некроз ) или повреждению органов. Последствия роста доброкачественной опухоли для здоровья могут быть более заметными, если опухоль находится в замкнутом пространстве, таком как череп , дыхательные пути , пазухи или кости. Например, в отличие от большинства доброкачественных опухолей в других частях тела, доброкачественные опухоли головного мозга могут быть опасными для жизни. Опухоли могут проявлять поведение, характерное для их клеточного типа; Например, эндокринные опухоли, такие как аденомы щитовидной железы и аденомы коры надпочечников , могут перепроизводить определенные гормоны .
Слово «милостивый» означает «благоприятный, добрый, удачливый, спасительный, благоприятный». [1] Однако доброкачественная опухоль не является доброкачественной в обычном смысле слова; название просто указывает, что оно не является «злокачественным», то есть раковым. Хотя доброкачественные опухоли обычно не представляют серьезного риска для здоровья, они могут быть опасными или смертельными. [2] Многие типы доброкачественных опухолей могут стать раковыми ( злокачественными ) в результате процесса, известного как прогрессирование опухоли . По этой причине и по другим возможным причинам некоторые доброкачественные опухоли удаляют хирургическим путем. Доброкачественные опухоли после удаления обычно не возвращаются. Исключения из этого правила могут указывать на злокачественную трансформацию.
Доброкачественные опухоли очень разнообразны; они могут протекать бессимптомно или вызывать специфические симптомы в зависимости от их анатомического расположения и типа ткани. Они растут наружу, образуя большие округлые массы, которые могут вызвать так называемый «эффект массы». Этот рост может вызвать сжатие местных тканей или органов, что приводит ко многим последствиям, таким как закупорка протоков, снижение кровотока ( ишемия ), отмирание тканей ( некроз ) и боль или повреждение нервов. [3] Некоторые опухоли также производят гормоны, которые могут привести к опасным для жизни ситуациям. Инсулиномы могут производить большое количество инсулина, вызывая гипогликемию . [4] [5] Аденомы гипофиза могут вызывать повышенный уровень гормонов, таких как гормон роста и инсулиноподобный фактор роста-1 , которые вызывают акромегалию ; пролактин ; АКТГ и кортизол , вызывающие болезнь Кушинга ; ТТГ , вызывающий гипертиреоз ; и ФСГ и ЛГ . [6] Инвагинация кишечника может возникать при различных доброкачественных опухолях толстой кишки. [7] Косметические эффекты могут быть вызваны опухолями, особенно кожными, что может вызывать психологический или социальный дискомфорт у человека с опухолью. [8] Опухоли сосудистой ткани могут кровоточить, что в некоторых случаях приводит к анемии . [9]
Синдром гамартомы PTEN включает гамартоматозные заболевания, характеризующиеся генетическими мутациями в гене-супрессоре опухоли PTEN , [10] включая синдром Каудена , синдром Баннаяна-Райли-Рувалькабы , синдром Протея и протеус-подобный синдром . Отсутствие или дисфункция белка PTEN позволяет клеткам чрезмерно размножаться, вызывая гамартомы. [11] Синдром Каудена — аутосомно-доминантное генетическое заболевание , характеризующееся множественными доброкачественными гамартомами ( трихилеммами и слизисто-кожными папилломатозными папулами), а также предрасположенностью к раку многих органов, включая молочную железу и щитовидную железу. [12] [13] Синдром Баннаяна-Райли-Рувалькабы представляет собой врожденное заболевание , характеризующееся гамартоматозным полипозом кишечника, макроцефалией , липоматозом , гемангиоматозом и пятнами на головке полового члена . [11] [14] Синдром Протея характеризуется невусами , асимметричным разрастанием различных частей тела, нарушением регуляции жировой ткани, цистаденомами , аденомами , сосудистыми мальформациями. [15] [16]

Семейный аденоматозный полипоз (САП) — это семейный раковый синдром , вызванный мутациями гена APC . При САП в толстой кишке обнаруживаются аденоматозные полипы . Полипы перерастают в рак толстой кишки , если их не удалить. [17] Ген APC является супрессором опухоли . Его белковый продукт участвует во многих клеточных процессах. Инактивация гена APC приводит к накоплению белка под названием β-катенин . Этот белок активирует два фактора транскрипции : фактор Т-клеток (TCF) и фактор лимфоидного энхансера (LEF). Эти факторы вызывают активацию многих генов, участвующих в пролиферации , дифференцировке , миграции и апоптозе клеток (запрограммированной гибели клеток), вызывая рост доброкачественных опухолей. [18]
Туберозный склерозный комплекс (TSC) — аутосомно-доминантное генетическое заболевание, вызванное мутациями в генах TSC1 и TSC2 . TSC1 производит белок гамартин . TSC2 производит белок туберин . Это заболевание проявляется многими доброкачественными гамартоматозными опухолями, включая ангиофибромы , почечные ангиомиолипомы и легочный лимфангиомиоматоз . Туберин и гамартин ингибируют белок mTOR в нормальной клеточной физиологии. Инактивация опухолевых супрессоров TSC вызывает повышение активности mTOR. Это приводит к активации генов и выработке белков, которые увеличивают рост клеток. [19] [20] [21]
Болезнь фон Хиппеля-Линдау представляет собой доминантно наследуемый раковый синдром, который значительно увеличивает риск возникновения различных опухолей. Сюда входят доброкачественные гемангиобластомы и злокачественные феохромоцитомы , почечно-клеточный рак , эндокринные опухоли поджелудочной железы и опухоли эндолимфатического мешка . Это вызвано генетическими мутациями в гене- супрессоре опухоли фон Хиппеля-Линдау . Белок VHL (pVHL) участвует в клеточной передаче сигналов в клетках с кислородным голоданием ( гипоксией ). Одна из ролей pVHL — вызывать клеточную деградацию другого белка, HIF1α . Дисфункциональная pVHL приводит к накоплению HIF1α. Это активирует несколько генов, ответственных за выработку веществ, участвующих в росте клеток и производстве кровеносных сосудов: VEGF , PDGFβ , TGFα и эритропоэтина . [22]
Доброкачественные опухоли костей могут быть схожими макроскопически и для диагностики требуют сочетания клинического анамнеза с цитогенетическими , молекулярными и радиологическими тестами. [23] Тремя распространенными формами доброкачественных опухолей костей являются гигантоклеточная опухоль кости, остеохондрома и энхондрома ; существуют и другие формы доброкачественных опухолей костей, но они могут быть менее распространены.
Гигантоклеточные опухоли костей часто возникают в эпифизах длинных костей аппендикулярного скелета или крестце осевого скелета . Локальный рост может вызвать разрушение соседней кортикальной кости и мягких тканей, что приводит к боли и ограничению диапазона движений. Характерной рентгенологической находкой гигантоклеточных опухолей кости является литическое поражение без краевого склероза кости. При гистологии гигантские клетки слитых остеокластов рассматриваются как ответ на неопластические мононуклеарные клетки. Примечательно, что гигантские клетки не являются уникальными среди доброкачественных опухолей костей и гигантоклеточных опухолей костей. Молекулярные характеристики неопластических клеток, вызывающих гигантоклеточные опухоли костей, указывают на происхождение плюрипотентных мезенхимальных стволовых клеток, принимающих преостеобластические маркеры. Цитогенетические причины гигантоклеточных опухолей костей связаны с теломерами . Лечение включает хирургическое выскабливание с применением адъювантных бисфосфонатов .
Остеохондромы образуют покрытые хрящом выступы костей. Такие структуры, как костномозговая полость и кортикальная кость остеохондромы, прилегают к исходной кости. Местами происхождения часто являются метафизы длинных костей. Хотя многие остеохондромы возникают спонтанно, бывают случаи, когда у одного и того же человека может возникнуть несколько остеохондром; они могут быть связаны с генетическим заболеванием, известным как наследственные множественные остеохондромы. Остеохондрома проявляется на рентгеновском снимке как выступающая масса, которая часто направлена в сторону от суставов. [23] Эти опухоли перестают расти после закрытия пластинок роста родительской кости. Неспособность остановить рост может указывать на трансформацию в злокачественную хондросаркому. Лечение не показано, если оно не симптоматическое. В этом случае хирургическое иссечение часто дает излечивающий эффект.
Энхондромы — доброкачественные опухоли гиалинового хряща. Внутри кости энхондромы часто обнаруживаются в метафизах. Их можно найти во многих типах костей, включая мелкие кости, длинные кости и осевой скелет. На рентгенограмме энхондромы видны четко очерченные границы и пунктирный вид. [23] Наличие множественных энхондром соответствует множественному энхондроматозу ( болезнь Оллиера ). Лечение энхондромы включает хирургическое выскабливание и трансплантацию.
Липомы — это доброкачественные подкожные опухоли из жировых клеток ( адипоцитов ). Обычно это безболезненные, медленно растущие и подвижные образования, которые могут возникнуть в любом месте тела, где есть жировые клетки, но обычно обнаруживаются на туловище и верхних конечностях. [24]
[25] Хотя липомы могут развиваться в любом возрасте, чаще всего они появляются в возрасте от 40 до 60 лет. [24] Липомы поражают около 1% населения, без документально подтвержденной половой предвзятости, и примерно у 1 из каждых 1000 человек страдают липома в течение жизни. [25] [26] Причина возникновения липом точно не определена. Генетические или наследственные причины липом играют роль примерно у 2-3% пациентов. [25] У людей с наследственными семейными синдромами, такими как синдром Протея или семейный множественный липоматоз , часто наблюдаются множественные липомы по всему телу. [25] Эти синдромы также связаны с конкретными симптомами и субпопуляциями. Мутации в хромосоме 12 выявляются примерно в 65% случаев липомы. [25] Также было показано, что липомы увеличиваются у людей с ожирением , гиперлипидемией и сахарным диабетом . [25]
Липомы обычно диагностируются клинически, хотя для диагностики липом в атипичных местах могут использоваться методы визуализации ( УЗИ , компьютерная томография или магнитно-резонансная томография ). [24] Основным методом лечения липом является хирургическое иссечение, после чего опухоль исследуют гистопатологией для подтверждения диагноза. [24] Прогноз доброкачественных липом превосходный, рецидивы после иссечения редки, но могут возникнуть, если удаление было неполным. [25]

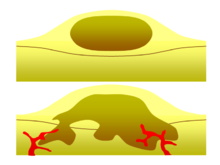
Одним из наиболее важных факторов при классификации опухоли на доброкачественную или злокачественную является ее инвазивный потенциал. Если опухоль не способна проникать в соседние ткани или распространяться на отдаленные участки путем метастазирования, то она доброкачественная, тогда как инвазивные или метастатические опухоли являются злокачественными. [3] По этой причине доброкачественные опухоли не классифицируются как рак. [27] Доброкачественные опухоли растут в изолированной области, обычно инкапсулированной в фиброзную соединительнотканную капсулу. Скорость роста доброкачественных и злокачественных опухолей также различается; доброкачественные опухоли обычно растут медленнее, чем злокачественные. Хотя доброкачественные опухоли представляют меньший риск для здоровья, чем злокачественные, в определенных ситуациях они оба могут быть опасными для жизни. Существует множество общих характеристик, которые применимы как к доброкачественным, так и к злокачественным опухолям, но иногда один тип может проявлять характеристики другого. Например, доброкачественные опухоли в большинстве случаев хорошо дифференцированы, а злокачественные опухоли часто недифференцированы. Однако могут встречаться недифференцированные доброкачественные опухоли и дифференцированные злокачественные опухоли. [28] [29] Хотя доброкачественные опухоли обычно растут медленно, также были зарегистрированы случаи быстрорастущих доброкачественных опухолей. [30] Некоторые злокачественные опухоли в основном не метастатические, например, в случае базальноклеточной карциномы . [31] КТ и рентгенография грудной клетки могут быть полезными диагностическими исследованиями для визуализации доброкачественной опухоли и дифференциации ее от злокачественной опухоли. Чем меньше опухоль на рентгенограмме, тем больше вероятность того, что она будет доброкачественной, поскольку 80% узлов в легких диаметром менее 2 см являются доброкачественными. Большинство доброкачественных узлов представляют собой сглаженные рентгеноконтрастные образования с четкими краями, но это не исключительные признаки доброкачественных опухолей. [32]
Опухоли образуются в результате канцерогенеза — процесса, при котором клеточные изменения приводят к образованию рака. Многоэтапный канцерогенез включает последовательные генетические или эпигенетические изменения в ДНК клетки , где каждый этап приводит к образованию более развитой опухоли. Его часто разбивают на три этапа; инициация, продвижение и прогрессирование, и на каждой стадии может произойти несколько мутаций. Инициация – это момент, когда в клетке происходит первая генетическая мутация. Продвижение — это клональная экспансия (повторное деление) трансформированной клетки в видимую опухоль, которая обычно является доброкачественной. После продвижения может иметь место прогрессирование, при котором в субпопуляции опухолевых клеток приобретается больше генетических мутаций. Прогрессирование превращает доброкачественную опухоль в злокачественную. [33] [34] Ярким и хорошо изученным примером этого явления является тубулярная аденома, распространенный тип полипа толстой кишки , который является важным предшественником рака толстой кишки. Клетки тубулярной аденомы, как и большинство опухолей, которые часто перерастают в рак, демонстрируют определенные нарушения созревания и внешнего вида клеток, известные под общим названием дисплазия . Эти клеточные аномалии не наблюдаются в доброкачественных опухолях, которые редко или никогда не перерастают в раковые, но наблюдаются при других предраковых аномалиях тканей, которые не образуют дискретных образований, таких как предраковые поражения шейки матки .
Доброкачественные новообразования обычно, но не всегда, состоят из клеток, которые очень похожи на нормальный тип клеток в органе, в котором они возникли. Эти опухоли названы в честь типа клеток или тканей, из которых они происходят. Суффикс «-ома» (но не -карцинома, -саркома или -бластома, которые обычно относятся к раку) применяется для обозначения доброкачественной опухоли. Например, липома — это распространенная доброкачественная опухоль из жировых клеток ( липоцитов ), а хондрома — доброкачественная опухоль из хрящеобразующих клеток ( хондроцитов ). Аденомы представляют собой доброкачественные опухоли из железообразующих клеток и обычно дополнительно уточняются по их клетке или органу происхождения, как, например, аденома печени (доброкачественная опухоль гепатоцитов или клеток печени ). Тератомы содержат множество типов клеток, таких как клетки кожи, нервов, головного мозга и щитовидной железы, поскольку они происходят из половых клеток. [36] Гамартомы представляют собой группу доброкачественных опухолей, которые имеют относительно нормальную клеточную дифференцировку , но демонстрируют дезорганизованную тканевую организацию. [19]
Исключения из правил номенклатуры существуют по историческим причинам; злокачественные примеры включают меланому (рак пигментированных клеток кожи или меланоцитов ) и семиному (рак мужских репродуктивных клеток). [37]
Доброкачественные опухоли не охватывают все доброкачественные новообразования. Кожные пятна, полипы голосовых связок и гиперпластические полипы толстой кишки часто называют доброкачественными, но они представляют собой разрастания нормальной ткани , а не новообразования. [36]
Доброкачественные опухоли обычно не нуждаются в лечении, за исключением случаев, когда они вызывают такие проблемы, как судороги, дискомфорт или косметические проблемы. Хирургическое вмешательство обычно является наиболее эффективным подходом и используется для лечения большинства доброкачественных опухолей. В некоторых случаях могут быть использованы другие методы лечения. Аденомы прямой кишки можно лечить с помощью склеротерапии , при которой химические вещества используются для сужения кровеносных сосудов и прекращения кровоснабжения. [38] Большинство доброкачественных опухолей не реагируют на химиотерапию или лучевую терапию , хотя есть исключения; доброкачественные межчерепные опухоли иногда лечат с помощью лучевой терапии и химиотерапии при определенных обстоятельствах. [39] [40] Радиацию также можно использовать для лечения гемангиом прямой кишки. [38] Доброкачественные опухоли кожи обычно удаляются хирургическим путем, но используются и другие методы лечения, такие как криотерапия , выскабливание , электродесикация , лазерная терапия , дермабразия , химический пилинг и местные лекарства . [41] [42]
Дети с этим типом [неоперабельной, доброкачественной] опухоли обычно умирают от нарушения сердечного ритма в раннем возрасте.