Химическое соединение
Оксалат железа ( II) — неорганическое соединение с формулой FeC2O4 ( H2O ) x , где x равно 0 или 2. Это оранжевые соединения, плохо растворимые в воде.
Структура и реакции
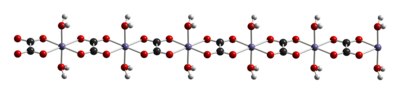
Как и другие оксалаты железа, оксалаты железа имеют октаэдрические центры Fe. Дигидрат FeC 2 O 4 (H 2 O) x представляет собой координационный полимер , состоящий из цепей оксалатно-мостиковых железных центров, каждый из которых имеет два акволиганда. [3]

При нагревании до 120 °C дигидрат дегидратируется, а безводный оксалат железа разлагается около 190 °C. [4] Продуктами термического разложения являются смесь оксидов железа и пирофорного металлического железа, а также выделяющиеся диоксид углерода , оксид углерода и вода. [5]
Оксалаты железа являются предшественниками фосфатов железа , которые представляют ценность для аккумуляторов. [6]
Естественное явление
Безводный оксалат железа(II) неизвестен среди минералов по состоянию на 2020 год. Однако дигидрат известен как гумбольдтин . [7] [8] Родственный, хотя и гораздо более сложный минерал — степановит, Na
[Mg(H2O ) 6 ] [Fe3 + ( C2O4 ) 3 ]· 3H2O — пример триоксалатоферрата(III). [ 9] [8]
Смотрите также
Ссылки
- ^ "Железа (II) оксалат дигидрат".
- ^ abc Sigma-Aldrich Co. , Дигидрат оксалата железа(II). Получено 03.05.2014.
- ^ Этиго, Такуя; Кимата, Мицуёси (2008). «Исследования рентгеновской дифракции и спектроскопии на монокристаллах гумбольдтина и линдбергита: слабый эффект Яна–Теллера иона Fe 2+ ». Физика и химия минералов . 35 (8): 467–475. Bibcode : 2008PCM....35..467E. doi : 10.1007/s00269-008-0241-7. S2CID 98739882.
- ^ Mu, Jacob; Perlmutter, DD (1981). «Термическое разложение карбонатов, карбоксилатов, оксалатов, ацетатов, формиатов и гидроксидов». Thermochimica Acta . 49 (2–3): 207–218. doi :10.1016/0040-6031(81)80175-x.
- ^ Hermanek, Martin; Zboril, Radek; Mashlan, Miroslav; Machala, Libor; Schneeweiss, Oldrich (2006). «Термическое поведение дигидрата оксалата железа (II) в атмосфере газов его конверсии». J. Mater. Chem . 16 (13): 1273–1280. doi :10.1039/b514565a.
- ^ Эллис, BL; Макахнук, WRM; Макимура, Y.; Тогхилл, K.; Назар, LF (2007). «Многофункциональный фосфатный катод на основе железа напряжением 3,5 В для перезаряжаемых батарей». Nature Materials . 6 (10): 749–753. Bibcode :2007NatMa...6..749E. doi :10.1038/nmat2007. PMID 17828278.
- ^ "Гумбольдтин".
- ^ ab "Список минералов". 21 марта 2011 г.
- ^ "Степановец".