Проталкивание стрелок или проталкивание электронов — это метод, используемый для описания развития механизмов реакций органической химии . [1] Впервые он был разработан сэром Робертом Робинсоном . При использовании проталкивания стрелок «изогнутые стрелки» или «фигурные стрелки» рисуются на структурных формулах реагентов в химическом уравнении, чтобы показать механизм реакции . Стрелки иллюстрируют движение электронов по мере разрыва и образования связей между атомами . Проталкивание стрелок никогда напрямую не показывает движение атомов; оно используется для показа движения электронной плотности, которая косвенно показывает движение самих атомов. Проталкивание стрелок также используется для описания того, как положительные и отрицательные заряды распределяются вокруг органических молекул посредством резонанса . Однако важно помнить, что проталкивание стрелок — это формализм, и электроны (или, скорее, электронная плотность) в реальности не движутся так аккуратно и дискретно.
Стрелка толкает была распространена на неорганическую химию , особенно на химию s- и p- элементов . Было показано, что она хорошо работает для гипервалентных соединений. [2]

Представление механизмов реакции с использованием изогнутых стрелок для указания потока электронов было разработано сэром Робертом Робинсоном в 1922 году. [3] [4] [5] Органические химики используют два типа стрелок в молекулярных структурах для описания движения электронов. Траектории отдельных электронов обозначаются стрелками с одним зазубрином, тогда как стрелки с двумя зазубринами показывают движение электронных пар. Хвост стрелки рисуется либо у одиночной пары электронов на атоме, либо у связи между атомами, источника электронов или области, где имеется относительно высокая электронная плотность. Ее голова указывает на стоки электронов или области с относительно низкой электронной плотностью. [6]


Когда связь разрывается, электроны покидают место, где была связь; это представлено изогнутой стрелкой, направленной от связи и заканчивающейся стрелкой, направленной к следующей незанятой молекулярной орбитали. Электроны могут быть переданы определенному атому или могут быть переданы одинарной (сигма) связи, таким образом делая ее двойной (пи) связью, но стрелка всегда указывает на определенный атом, потому что электроны всегда перемещаются к новому атому, когда их «подталкивают». Органические химики представляют образование связи изогнутой стрелкой, направленной между двумя видами. [7]
Для ясности, при проставлении стрелок лучше всего рисовать стрелки, начинающиеся с неподеленной пары электронов или связи σ или π и заканчивающиеся в позиции, которая может принять пару электронов, позволяя читателю точно знать, какие электроны движутся и где они заканчиваются. Связи разрываются в местах, где заполнена соответствующая антисвязывающая орбиталь. Некоторые авторитетные источники [1] допускают упрощение, что стрелка может начинаться с формального отрицательного заряда, который соответствует неподеленной паре. Однако не все формальные отрицательные заряды соответствуют наличию неподеленной пары (например, B в F 4 B − ), и с этим следует соблюдать осторожность.
Ковалентная связь, соединяющая атомы в органической молекуле, состоит из группы из двух электронов. Такая группа называется электронной парой. Реакции в органической химии протекают через последовательный разрыв и образование таких связей. Органические химики различают два процесса разрыва химической связи. Эти процессы известны как гомолитическое расщепление и гетеролитическое расщепление. [8]
Гомолитический разрыв связи — это процесс, при котором электронная пара, составляющая связь, расщепляется, что приводит к разрыву связи. Это обозначено двумя одинарными изогнутыми стрелками с зазубринами, направленными от связи. Следствием этого процесса является сохранение одного неспаренного электрона, обозначенного точкой, на каждом из атомов, которые ранее были соединены связью. Движение одного электрона можно обозначить изогнутой стрелкой, обычно называемой рыболовным крючком. [9] Эти виды с одним электроном известны как свободные радикалы . Для обеспечения достаточного количества энергии для этого процесса требуются тепло или свет. [10]

Например, ультрафиолетовый свет вызывает гомолитический разрыв связи хлор -хлор. Пара электронов расщепляется, что обозначено двумя стрелками-крючками между обоими атомами, указывающими на оба атома хлора. После того, как реакция происходит, обе молекулы хлора остаются с одним неспаренным электроном. Это стадия инициирования свободнорадикальной галогенизации .

Гетеролитический разрыв связи — это процесс, при котором электронная пара, составляющая связь, перемещается к одному из атомов, которые ранее были соединены связью. Связь разрывается, образуя отрицательно заряженный вид ( анион ) и положительно заряженный вид ( катион ). Анион — это вид, который удерживает электроны из связи, в то время как катион лишается электронов из связи. Анион обычно образуется на самом электроотрицательном атоме, в данном примере на атоме A. Это происходит потому, что самый электроотрицательный атом естественным образом сильнее притягивает к себе электроны, что приводит к его отрицательному заряду.
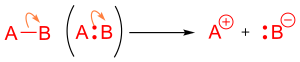
Кислотно-основная реакция Льюиса происходит, когда молекула с неподеленной электронной парой, или основание, отдает свои электроны акцептору электронной пары, также известному как кислота. [11] Это можно показать в реакции с изогнутой стрелкой, указывающей от несвязанной электронной пары к акцептору электронов. В реакции с участием кислот и оснований Бренстеда-Лоури стрелки используются таким же образом, и они помогают указать атакующий протон. [12] В кислотно-основной реакции Бренстеда-Лоури стрелка будет начинаться от кислоты, акцептора протона, к основанию, донору протона. [13]
Реакция S N 1 происходит, когда молекула разделяется на положительно заряженный компонент и отрицательно заряженный компонент. Обычно это происходит в сильно полярных растворителях посредством процесса, называемого сольволизом . Положительно заряженный компонент затем реагирует с нуклеофилом, образуя новое соединение. Реакции S N 1 — это реакции, скорость которых зависит только от концентрации галогеналкана.

На первом этапе этой реакции (сольволиз) связь CL разрывается, и оба электрона этой связи присоединяются к LG ( уходящей группе ), образуя ионы LG − и R 3 C + . Это представлено изогнутой стрелкой, направленной от связи C-LG к LG. Нуклеофил Nu − , притягиваясь к R 3 C + , затем отдает пару электронов, образуя новую связь C-Nu.
Поскольку реакция S N 1 протекает с замещением S уходящей группы на N нуклеофил, используется обозначение S N. Поскольку начальный этап сольволиза в этой реакции включает в себя диссоциацию одной молекулы от ее уходящей группы, начальная стадия этого процесса считается мономолекулярной реакцией. Участие только 1 вида в начальной фазе реакции усиливает механистическое обозначение до S N 1 . [14] Реакция S N 1 имеет два этапа.
Реакция S N 2 происходит, когда нуклеофил вытесняет уходящую группу, находящуюся на молекуле с задней стороны уходящей группы. Это вытеснение или замещение приводит к образованию продукта замещения с инверсией стереохимической конфигурации. Нуклеофил образует связь со своей неподеленной парой в качестве источника электронов. Электронный сток, который в конечном итоге принимает электронную плотность, является нуклеофугом (уходящей группой), при этом образование и разрыв связи происходят одновременно в переходном состоянии (отмечено двойным крестиком). Скорости реакций S N 2 зависят от концентрации галогеналкана и нуклеофила.

Поскольку реакция S N 2 протекает с замещением уходящей группы нуклеофилом , используется обозначение S N. Поскольку этот механизм протекает с взаимодействием двух видов в переходном состоянии, он называется бимолекулярным процессом, что приводит к обозначению S N 2. [15] Реакция S N 2 является согласованным процессом, что означает, что связи разрываются и образуются одновременно. Таким образом, движение электронов, показанное выталкиванием стрелки , происходит одновременно. [ 16] Реакция S N 2 имеет одну стадию.
Элиминирование E1 происходит, когда протон, соседствующий с положительным зарядом, уходит и образует двойную связь .

Поскольку для протекания реакций E1 необходимо первоначальное образование катиона , реакции E1 часто наблюдаются как побочные реакции механизмов S N 1.
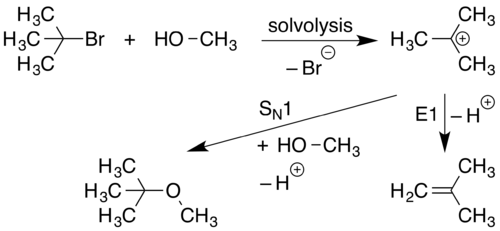
Элиминации E1 протекают с элиминированием уходящей группы, что приводит к обозначению E. Поскольку этот механизм протекает с начальной диссоциацией одного исходного материала, образующего карбокатион, этот процесс считается мономолекулярной реакцией. Участие только 1 вида в начальной фазе реакции усиливает механистическое обозначение до E1 .
Элиминирование E2 происходит, когда протон, соседний с уходящей группой, извлекается основанием с одновременным удалением уходящей группы и образованием двойной связи.

Подобно взаимосвязи между элиминированием E1 и механизмами S N 1, элиминирование E2 часто происходит в конкуренции с реакциями S N 2. Это наблюдение чаще всего отмечается, когда основание также является нуклеофилом. Чтобы минимизировать эту конкуренцию, для осуществления элиминирования E2 обычно используют ненуклеофильные основания.

Элиминирование E2 происходит посредством первоначального извлечения протона основанием или нуклеофилом, что приводит к элиминированию уходящей группы, оправдывающей обозначение E. Поскольку этот механизм осуществляется посредством взаимодействия двух видов (субстрата и основания/нуклеофила), реакции E2 признаются бимолекулярными. Таким образом, участие 2 видов в начальной фазе реакции усиливает механистическое обозначение до E2 .
Реакции присоединения происходят, когда нуклеофилы реагируют с карбонилами . Когда нуклеофил присоединяется к простому альдегиду или кетону , результатом является 1,2-присоединение. Когда нуклеофил присоединяется к сопряженной карбонильной системе, результатом является 1,4-присоединение. Обозначения 1,2 и 1,4 получены из нумерации атомов исходного соединения, где кислород помечен как «1», а каждый атом, смежный с кислородом, последовательно пронумерован до места нуклеофильного присоединения. 1,2-присоединение происходит при нуклеофильном присоединении к положению 2, тогда как 1,4-присоединение происходит при нуклеофильном присоединении к положению 4.
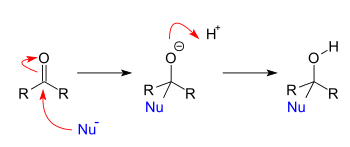

Реакции присоединения-отщепления — это реакции присоединения, за которыми сразу следуют реакции отщепления. В общем, эти реакции происходят, когда сложные эфиры (или родственные функциональные группы) реагируют с нуклеофилами. Фактически, единственным требованием для протекания реакции присоединения-отщепления является то, чтобы отщепляемая группа была лучшей уходящей группой, чем входящий нуклеофил.

{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )