В химии изомеры — это молекулы или многоатомные ионы с одинаковой молекулярной формулой , то есть одинаковым числом атомов каждого элемента , но различным расположением атомов в пространстве. [1] Изомерия относится к существованию или возможности изомеров.
Изомеры не обязательно имеют схожие химические или физические свойства . Две основные формы изомерии — это структурная (или конституционная) изомерия, при которой связи между атомами различаются; и стереоизомерия или (пространственная изомерия), при которой связи одинаковы, но относительное положение атомов различается.
Изомерные отношения формируют иерархию . Два химических вещества могут быть одним и тем же конституционным изомером, но при более глубоком анализе быть стереоизомерами друг друга. Две молекулы, которые являются одним и тем же стереоизомером друг друга, могут находиться в разных конформационных формах или быть разными изотопологами . Глубина анализа зависит от области исследования или интересующих химических и физических свойств.
Английское слово «изомер» ( / ˈ aɪ s əm ər / ) является обратной структурой от слова «изомерный» [2] , которое было заимствовано через немецкое isomerisch [3] из шведского isomerisk ; которое в свою очередь было образовано от греческого ἰσόμερoς isómeros , с корнями isos = «равный», méros = «часть». [4]

Структурные изомеры имеют одинаковое количество атомов каждого элемента (отсюда и одинаковую молекулярную формулу ), но атомы соединены различными способами. [5]
Например, существует три различных соединения с молекулярной формулой :
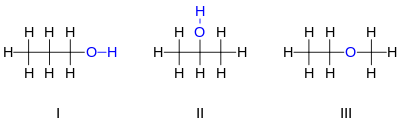
Первые два изомера, показанные на рисунке, являются пропанолами , то есть спиртами, полученными из пропана . Оба имеют цепь из трех атомов углерода, соединенных одинарными связями, причем оставшиеся валентности углерода заполнены семью атомами водорода и гидроксильной группой , содержащей атом кислорода, связанный с атомом водорода. Эти два изомера различаются тем, с каким углеродом связан гидроксил: либо с концом углеродной цепи пропан-1-ол (1-пропанол, н- пропиловый спирт, н -пропанол; I ), либо со средним углеродом пропан-2-ол (2-пропанол, изопропиловый спирт, изопропанол; II ). Их можно описать с помощью сокращенных структурных формул и .
Третий изомер — это эфир метоксиэтан (этилметиловый эфир; III ). В отличие от двух других, у него атом кислорода связан с двумя атомами углерода, а все восемь атомов водорода связаны непосредственно с атомами углерода. Его можно описать сжатой формулой .
Спирт "3-пропанол" не является другим изомером, поскольку разница между ним и 1-пропанолом не является реальной; это лишь результат произвольного выбора направления нумерации атомов углерода вдоль цепи. По той же причине "этоксиметан" является той же молекулой, что и метоксиэтан, а не другим изомером.
1-пропанол и 2-пропанол являются примерами позиционных изомеров , которые различаются положением, в котором определенные особенности, такие как двойные связи или функциональные группы , находятся в «родительской» молекуле (в данном случае пропане).
Существуют также три структурных изомера углеводорода :
В двух изомерах три атома углерода соединены в открытую цепь, но в одном из них ( пропадиене или аллене; I ) атомы углерода соединены двумя двойными связями , а в другом ( пропине или метилацетилене; II ) они соединены одинарной и тройной связью . В третьем изомере ( циклопропене ; III ) три атома углерода соединены в кольцо двумя одинарными связями и двойной связью. Во всех трех оставшиеся валентности атомов углерода удовлетворяются четырьмя атомами водорода.
Опять же, обратите внимание, что существует только один структурный изомер с тройной связью, поскольку другое возможное размещение этой связи — это просто рисование трех атомов углерода в другом порядке. По той же причине существует только один циклопропен, а не три.
Таутомеры — это структурные изомеры, которые легко взаимопревращаются, так что два или более вида сосуществуют в равновесии, например:
. [6]
Важными примерами являются кето-енольная таутомерия и равновесие между нейтральными и цвиттер-ионными формами аминокислоты .
Структура некоторых молекул иногда описывается как резонанс между несколькими, по-видимому, различными структурными изомерами. Классический пример — 1,2-диметилбензол ( о -ксилол), который часто описывается как смесь двух, по-видимому, различных структурных изомеров:
Однако ни одна из этих двух структур не описывает реальное соединение; это фикции, придуманные как способ описания (путем их «усреднения» или «резонанса») реальной делокализованной связи о - ксилола, который является единственным изомером с бензольным ядром и двумя метильными группами в соседних положениях.
Стереоизомеры имеют одинаковые атомы или изотопы, соединенные связями одного типа, но различаются по своей форме — относительному положению этих атомов в пространстве — за исключением вращений и трансляций .
Теоретически можно представить, что любое расположение атомов молекулы или иона в пространстве постепенно меняется на любое другое расположение бесконечным множеством способов, перемещая каждый атом по соответствующему пути. Однако изменения в положении атомов, как правило, изменяют внутреннюю энергию молекулы, которая определяется углами между связями в каждом атоме и расстояниями между атомами (связаны они или нет).
Конформационный изомер — это расположение атомов молекулы или иона, для которого внутренняя энергия является локальным минимумом ; то есть такое расположение, что любые небольшие изменения в положениях атомов увеличат внутреннюю энергию и, следовательно, приведут к силам, которые стремятся вернуть атомы в исходные положения. Изменение формы молекулы от такого энергетического минимума до другого энергетического минимума , следовательно, потребует прохождения конфигураций, которые имеют более высокую энергию, чем и . То есть, конформационный изомер отделен от любого другого изомера энергетическим барьером : величиной, которая должна быть временно добавлена к внутренней энергии молекулы, чтобы пройти все промежуточные конформации по «самому легкому» пути (тому, который минимизирует эту величину).

Классический пример конформационной изомерии — циклогексан . Алканы обычно имеют минимальную энергию, когда углы близки к 110 градусам. Конформации молекулы циклогексана со всеми шестью атомами углерода в одной плоскости имеют более высокую энергию, поскольку некоторые или все углы должны быть далеки от этого значения (120 градусов для правильного шестиугольника). Таким образом, конформации, которые являются локальными минимумами энергии, имеют кольцо, скрученное в пространстве, в соответствии с одним из двух шаблонов, известных как кресло (с углеродами попеременно выше и ниже их средней плоскости) и лодка (с двумя противоположными углеродами над плоскостью и четырьмя другими под ней).
Если энергетический барьер между двумя конформационными изомерами достаточно низок, его можно преодолеть случайными поступлениями тепловой энергии , которую молекула получает от взаимодействия с окружающей средой или от собственных колебаний . В этом случае два изомера можно также считать одним изомером, в зависимости от температуры и контекста. Например, две конформации циклогексана довольно быстро преобразуются друг в друга при комнатной температуре (в жидком состоянии), поэтому в химии их обычно рассматривают как один изомер. [7]
В некоторых случаях барьер может быть преодолен квантовым туннелированием самих атомов. Это последнее явление предотвращает разделение стереоизомеров фторхлорамина или перекиси водорода , поскольку две конформации с минимальной энергией взаимопревращаются за несколько пикосекунд даже при очень низких температурах. [8]
И наоборот, энергетический барьер может быть настолько высок, что самый простой способ его преодоления потребует временного разрыва и последующего восстановления одной или нескольких связей молекулы. В этом случае два изомера обычно достаточно стабильны, чтобы их можно было изолировать и рассматривать как отдельные вещества. Затем эти изомеры называют различными конфигурационными изомерами или «конфигурациями» молекулы, а не просто двумя различными конформациями. [9] (Однако следует помнить, что термины «конформация» и «конфигурация» во многом являются синонимами за пределами химии, и их различие может быть спорным даже среди химиков. [7] )
Взаимодействия с другими молекулами того же или другого соединения (например, через водородные связи ) могут существенно изменить энергию конформаций молекулы. Поэтому возможные изомеры соединения в растворе или в его жидкой и твердой фазах могут сильно отличаться от изомеров изолированной молекулы в вакууме. Даже в газовой фазе некоторые соединения, такие как уксусная кислота, будут существовать в основном в форме димеров или более крупных групп молекул, конфигурации которых могут отличаться от конфигураций изолированной молекулы.
Два соединения называются энантиомерами, если их молекулы являются зеркальными отражениями друг друга, которые не могут быть совмещены только путем вращений или трансляций – как левая рука и правая рука. Две формы называются хиральными .
Классический пример — бромхлорфторметан ( ). Два энантиомера можно различить, например, по тому, поворачивает ли путь по часовой стрелке или против часовой стрелки, если смотреть со стороны атома водорода. Чтобы изменить одну конформацию на другую, в какой-то момент эти четыре атома должны были бы лежать в одной плоскости — что потребовало бы сильного напряжения или разрыва их связей с атомом углерода. Соответствующий энергетический барьер между двумя конформациями настолько высок, что при комнатной температуре между ними практически нет конверсии, и их можно рассматривать как разные конфигурации.
Соединение хлорфторметан , напротив, не является хиральным: зеркальное отображение его молекулы также получается путем полуоборота вокруг подходящей оси.
Другим примером хирального соединения является 2,3-пентадиен — углеводород, содержащий две перекрывающиеся двойные связи. Двойные связи таковы, что три средних атома углерода находятся на прямой линии, а первые три и последние три лежат в перпендикулярных плоскостях. Молекула и ее зеркальное изображение не накладываются друг на друга, хотя молекула имеет ось симметрии. Два энантиомера можно различить, например, с помощью правила правой руки . Этот тип изомерии называется аксиальной изомерией.
Энантиомеры ведут себя идентично в химических реакциях, за исключением случаев, когда они реагируют с хиральными соединениями или в присутствии хиральных катализаторов , таких как большинство ферментов . По этой последней причине два энантиомера большинства хиральных соединений обычно оказывают заметно разные эффекты и играют разные роли в живых организмах. В биохимии и пищевой науке два энантиомера хиральной молекулы, такой как глюкоза , обычно идентифицируются и рассматриваются как совершенно разные вещества.
Каждый энантиомер хирального соединения обычно вращает плоскость поляризованного света , проходящего через него. Вращение имеет одинаковую величину, но противоположные направления для двух изомеров и может быть полезным способом различения и измерения их концентрации в растворе. По этой причине энантиомеры ранее назывались «оптическими изомерами». [10] [11] Однако этот термин неоднозначен и не одобряется ИЮПАК . [ 12] [13]
Стереоизомеры, которые не являются энантиомерами, называются диастереомерами . Некоторые диастереомеры могут содержать хиральный центр , некоторые нет. [14]
Некоторые пары энантиомеров (например, пары транс -циклооктена ) могут быть взаимопревращены внутренними движениями, которые лишь немного изменяют длины связей и углы. Другие пары (например, CHFClBr) не могут быть взаимопревращены без разрыва связей и, следовательно, являются различными конфигурациями.
Двойная связь между двумя атомами углерода заставляет оставшиеся четыре связи (если они одинарные) лежать в одной плоскости, перпендикулярной плоскости связи, как определено ее π-орбиталью . Если две связи на каждом углероде соединяются с разными атомами, возможны две различные конформации, которые отличаются друг от друга поворотом на 180 градусов одного из атомов углерода вокруг двойной связи.
Классическим примером является дихлорэтен , в частности структурный изомер , в котором один хлор связан с каждым углеродом. Он имеет два конформационных изомера, с двумя хлорами на одной стороне или на противоположных сторонах плоскости двойной связи. Их традиционно называют цис (от латинского слова, означающего «по эту сторону») и транс («по другую сторону»), соответственно; или Z и E в рекомендуемой ИЮПАК номенклатуре. Преобразование между этими двумя формами обычно требует временного разрыва связей (или превращения двойной связи в одинарную), поэтому эти две конфигурации считаются различными конфигурациями молекулы.
В более общем смысле цис - транс- изомерия (ранее называвшаяся «геометрической изомерией») встречается в молекулах, где относительная ориентация двух различимых функциональных групп ограничена довольно жесткой структурой других атомов. [15]
Например, в циклическом спирте инозитоле (шестикратный спирт циклогексана) шестиуглеродный циклический остов в значительной степени препятствует тому, чтобы гидроксил и водород на каждом углероде менялись местами. Поэтому существуют различные конфигурационные изомеры в зависимости от того, находится ли каждый гидроксил на «этой стороне» или «на другой стороне» средней плоскости кольца. Исключая изомеры, которые эквивалентны при вращениях, существует девять изомеров, которые различаются по этому критерию и ведут себя как различные стабильные вещества (два из них являются энантиомерами друг друга). Самый распространенный в природе ( мио -инозитол) имеет гидроксилы на углеродах 1, 2, 3 и 5 на одной стороне этой плоскости, и поэтому может быть назван цис -1,2,3,5- транс -4,6-циклогексангексол. И каждый из этих цис - транс -изомеров, возможно, может иметь стабильные конформации «кресла» или «лодки» (хотя барьеры между ними значительно ниже, чем между различными цис - транс -изомерами).
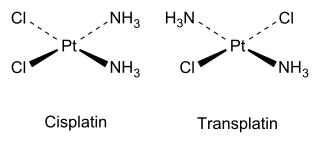
Цис- и транс- изомеры также встречаются в неорганических координационных соединениях , таких как квадратно-плоские комплексы и октаэдрические комплексы.
Для более сложных органических молекул цис- и транс -метки неоднозначны. ИЮПАК рекомендует более точную схему маркировки, основанную на приоритетах CIP для связей у каждого атома углерода. [16] [14]
В более общем смысле, атомы или группы атомов, которые могут образовывать три или более неэквивалентных одинарных связей (например, переходные металлы в координационных соединениях), могут давать начало нескольким стереоизомерам, когда в этих позициях присоединены разные атомы или группы. То же самое верно, если центр с шестью или более эквивалентными связями имеет два или более заместителей.
Например, в соединении связи от атома фосфора до пяти галогенов имеют приблизительно тригональную бипирамидальную геометрию . Таким образом, возможны два стереоизомера с этой формулой, в зависимости от того, занимает ли атом хлора одно из двух «аксиальных» положений или одно из трех «экваториальных» положений.
Для соединения возможны три изомера с нулевым, одним или двумя атомами хлора в аксиальных положениях.
В качестве другого примера, комплекс с формулой типа , где центральный атом M образует шесть связей с октаэдрической геометрией , имеет по крайней мере два фациально-меридиональных изомера , в зависимости от того, направлены ли три связи (и, следовательно, также три связи) на три угла одной грани октаэдра ( фац -изомер), или лежат в одной и той же экваториальной или «меридиональной» плоскости ( мер -изомер).
Две части молекулы, соединенные всего одной одинарной связью, могут вращаться вокруг этой связи. Хотя сама связь безразлична к этому вращению, притяжения и отталкивания между атомами в двух частях обычно приводят к изменению энергии всей молекулы (и, возможно, также к деформации двух частей) в зависимости от относительного угла вращения φ между двумя частями. Тогда будет одно или несколько особых значений φ, для которых энергия находится в локальном минимуме. Соответствующие конформации молекулы называются вращательными изомерами или ротамерами .
Так, например, в молекуле этана все углы связи и длина узко ограничены, за исключением того, что две метильные группы могут независимо вращаться вокруг оси. Таким образом, даже если эти углы и расстояния предполагаются фиксированными, существует бесконечно много конформаций для молекулы этана, которые отличаются относительным углом φ вращения между двумя группами. Слабое отталкивание между атомами водорода в двух метильных группах приводит к минимизации энергии для трех определенных значений φ, расположенных на расстоянии 120° друг от друга. В этих конфигурациях шесть плоскостей или находятся на расстоянии 60° друг от друга. Если не учитывать вращения всей молекулы, эта конфигурация представляет собой один изомер — так называемую шахматную конформацию.
Вращение между двумя половинами молекулы 1,2-дихлорэтана ( также имеет три локальных энергетических минимума, но они имеют разные энергии из-за различий между взаимодействиями , , и . Таким образом, существует три ротамера: транс -изомер, в котором два хлора находятся в той же плоскости, что и два углерода, но с противоположно направленными связями; и два гош- изомера, зеркальные отображения друг друга, в которых две группы повернуты примерно на 109° от этого положения. Вычисленная разница энергий между транс и гош составляет ~1,5 ккал/моль, барьер для вращения на ~109° от транс до гош составляет ~5 ккал/моль, а для вращения на ~142° от одного гош до его энантиомера составляет ~8 ккал/моль. [17] Ситуация для бутана похожа, но с заметно более низкими гош -энергиями и барьерами. [17]
Если две части молекулы, соединенные одинарной связью, громоздки или заряжены, энергетические барьеры могут быть намного выше. Например, в соединении бифенил – две фенильные группы, соединенные одинарной связью – отталкивание между атомами водорода, ближайшими к центральной одинарной связи, дает полностью плоскую конформацию с двумя кольцами в одной плоскости, более высокую энергию, чем конформации, в которых два кольца перекошены. В газовой фазе молекула, таким образом, имеет по крайней мере два ротамера с плоскостями колец, скрученными на ±47°, которые являются зеркальными отражениями друг друга. Барьер между ними довольно низок (~8 кДж /моль). [18] Этот эффект стерического препятствия более выражен, когда эти четыре водорода заменяются более крупными атомами или группами, такими как хлоры или карбоксилы . Если барьер достаточно высок для того, чтобы два ротамера можно было разделить как стабильные соединения при комнатной температуре, их называют атропоизомерами .
Большие молекулы могут иметь изомеры, которые различаются топологией их общего расположения в пространстве, даже если нет никаких конкретных геометрических ограничений, которые их разделяют. Например, длинные цепи могут быть скручены, образуя топологически различные узлы , при этом взаимопревращение предотвращается объемными заместителями или замыканием цикла (как в кольцевых ДНК и РНК- плазмидах ). Некоторые узлы могут находиться в зеркальных парах энантиомеров. Такие формы называются топологическими изомерами или топоизомерами .
Кроме того, две или более таких молекул могут быть связаны вместе в катенане такими топологическими связями, даже если между ними нет химической связи. Если молекулы достаточно большие, связывание может происходить несколькими топологически различными способами, образуя различные изомеры. Клеточные соединения , такие как гелий , заключенный в додекаэдран (He@ C
20ЧАС
20) и углеродные горошины , представляют собой схожий тип топологической изомерии, включающий молекулы с большими внутренними пустотами с ограниченными или отсутствующими отверстиями. [19]
Различные изотопы одного и того же элемента можно рассматривать как различные виды атомов при перечислении изомеров молекулы или иона. Замена одного или нескольких атомов их изотопами может создать несколько структурных изомеров и/или стереоизомеров из одного изомера.
Например, замена двух атомов обычного водорода ( ) дейтерием ( , или ) в молекуле этана дает два различных структурных изомера, в зависимости от того, находятся ли замены на одном и том же углероде (1,1-дидейтероэтан, ) или по одной на каждом углероде (1,2-дидейтероэтан, ); как если бы заместителем был хлор вместо дейтерия. Две молекулы нелегко взаимопревращаются и имеют разные свойства, такие как их микроволновый спектр . [20]
Другим примером может служить замена одного атома дейтерия на один из атомов водорода в хлорфторметане ( ). Хотя исходная молекула не является хиральной и имеет один изомер, замена создает пару хиральных энантиомеров , которые можно различить (по крайней мере, теоретически) по их оптической активности. [21]
Когда два изомера были бы идентичны, если бы все изотопы каждого элемента были заменены одним изотопом, они описываются как изотопомеры или изотопные изомеры. [22] В двух приведенных выше примерах, если бы все были заменены на , два дидейтероэтана оба стали бы этаном, а два дейтерохлорфторметана оба стали бы .
Концепция изотопомеров отличается от изотопологов или изотопных гомологов, которые различаются по своему изотопному составу. [22] Например, и являются изотопологами, а не изотопомерами, и, следовательно, не являются изомерами друг друга.
Другой тип изомерии, основанный на ядерных свойствах, — это спиновая изомерия , при которой молекулы различаются только относительными спиновыми магнитными квантовыми числами m s составляющих атомных ядер. Это явление имеет значение для молекулярного водорода, который можно частично разделить на два долгоживущих состояния, описываемых как спиновые изомеры [23] или ядерные спиновые изомеры: [24] параводород, в котором спины двух ядер направлены в противоположных направлениях, и ортоводород, в котором спины направлены в одном направлении.
Изомеризация — это процесс, при котором одна молекула преобразуется в другую молекулу, имеющую точно такие же атомы, но атомы перегруппированы. [25] В некоторых молекулах и при некоторых условиях изомеризация происходит спонтанно. Многие изомеры равны или примерно равны по энергии связи и поэтому существуют в примерно равных количествах, при условии, что они могут относительно свободно преобразовываться друг в друга, то есть энергетический барьер между двумя изомерами не слишком высок. Когда изомеризация происходит внутримолекулярно , она считается реакцией перегруппировки .
Примером металлоорганической изомеризации является получение декафенилферроцена, [(η 5 -C 5 Ph 5 ) 2 Fe] из его изомера связи . [26] [27]
Промышленный синтез фумаровой кислоты осуществляется путем цис-транс-изомеризации малеиновой кислоты :
Топоизомеразы — это ферменты, которые могут разрезать и реформировать кольцевую ДНК и таким образом изменять ее топологию.
Изомеры, имеющие различные биологические свойства, являются обычным явлением; например, размещение метильных групп . В замещенных ксантинах теобромин , содержащийся в шоколаде, является вазодилататором с некоторыми общими с кофеином эффектами ; но если одна из двух метильных групп перемещается в другое положение на двухкольцевом ядре, изомер становится теофиллином , который оказывает множество эффектов, включая бронходилатацию и противовоспалительное действие. Другой пример этого встречается в стимулирующих препаратах на основе фенэтиламина . Фентермин является нехиральным соединением с более слабым эффектом, чем у амфетамина . Он используется в качестве лекарства, снижающего аппетит, и обладает мягкими или нулевыми стимулирующими свойствами. Однако альтернативное расположение атомов дает декстрометамфетамин , который является более сильным стимулятором, чем амфетамин.
В медицинской химии и биохимии энантиомеры представляют особый интерес, поскольку они могут обладать различной биологической активностью . Многие препаративные процедуры позволяют получить смесь равных количеств обеих энантиомерных форм. В некоторых случаях энантиомеры разделяют с помощью хроматографии с использованием хиральных неподвижных фаз. Их также можно разделить путем образования диастереомерных солей . В других случаях был разработан энантиоселективный синтез .
В качестве неорганического примера можно привести цисплатин (структуру см. выше), который является важным препаратом, используемым в химиотерапии рака, тогда как транс-изомер (трансплатин) не обладает полезной фармакологической активностью.
Изомерия была впервые обнаружена в 1827 году, когда Фридрих Вёлер приготовил цианат серебра и обнаружил, что, хотя его элементный состав был идентичен гремучему серебру (приготовленному Юстусом фон Либихом годом ранее), [28] его свойства были другими. Это открытие бросило вызов преобладающему химическому пониманию того времени, которое считало, что химические соединения могут быть разными только тогда, когда их элементный состав отличается. (Теперь мы знаем, что связывающие структуры гремучего и цианата можно приблизительно описать как ≡ и , соответственно.)
Дополнительные примеры были найдены в последующие годы, такие как открытие Вёлером в 1828 году того, что мочевина имеет тот же атомный состав ( ), что и химически отличный цианат аммония . (Их структуры, как теперь известно, являются и , соответственно.) В 1830 году Йенс Якоб Берцелиус ввел термин изомерия для описания этого явления. [4] [29] [30] [31]
В 1848 году Луи Пастер заметил, что кристаллы винной кислоты имеют две формы, которые являются зеркальными отражениями друг друга. Разделяя кристаллы вручную, он получил две версии винной кислоты, каждая из которых кристаллизовалась только в одной из двух форм, и вращала плоскость поляризованного света в одинаковой степени, но в противоположных направлениях. [32] [33] В 1860 году Пастер явно выдвинул гипотезу, что молекулы изомеров могут иметь одинаковый состав, но разное расположение атомов. [34]