
Электрохимический градиент — это градиент электрохимического потенциала , обычно для иона , который может перемещаться через мембрану . Градиент состоит из двух частей:
Когда концентрации иона на проницаемой мембране неравномерны, ион будет перемещаться через мембрану из области с более высокой концентрацией в область с более низкой концентрацией посредством простой диффузии . Ионы также несут электрический заряд, который формирует электрический потенциал на мембране. Если заряды распределены неравномерно на мембране, то разница в электрическом потенциале создает силу, которая заставляет ионную диффузию двигаться до тех пор, пока заряды не будут сбалансированы по обе стороны мембраны.
Электрохимические градиенты необходимы для работы батарей и других электрохимических элементов , фотосинтеза и клеточного дыхания , а также некоторых других биологических процессов.
Электрохимическая энергия является одной из многих взаимозаменяемых форм потенциальной энергии , посредством которой энергия может сохраняться . Она появляется в электроаналитической химии и имеет промышленные применения, такие как батареи и топливные элементы. В биологии электрохимические градиенты позволяют клеткам контролировать направление движения ионов через мембраны. В митохондриях и хлоропластах протонные градиенты генерируют хемиосмотический потенциал , используемый для синтеза АТФ , [1] а градиент натрия-калия помогает нейронным синапсам быстро передавать информацию. [ необходима цитата ]
Электрохимический градиент имеет два компонента: дифференциальную концентрацию электрического заряда на мембране и дифференциальную концентрацию химических видов на той же мембране. В первом эффекте концентрированный заряд притягивает заряды противоположного знака; во втором концентрированные виды имеют тенденцию диффундировать через мембрану, чтобы уравнять концентрации. Сочетание этих двух явлений определяет термодинамически предпочтительное направление для движения иона через мембрану. [2] : 403 [3]
Комбинированный эффект можно количественно оценить как градиент термодинамического электрохимического потенциала : [ необходима ссылка ] с
Иногда термин «электрохимический потенциал» используется неправильно, чтобы описать электрический потенциал, создаваемый градиентом концентрации ионов, то есть φ .
Электрохимический градиент аналогичен давлению воды через плотину гидроэлектростанции . Пути, не заблокированные мембраной (например, мембранный транспортный белок или электроды ), соответствуют турбинам, которые преобразуют потенциальную энергию воды в другие формы физической или химической энергии, а ионы, проходящие через мембрану, соответствуют воде, перемещающейся в нижнюю реку. [ tone ] И наоборот, энергия может быть использована для перекачивания воды в озеро выше плотины , а химическая энергия может быть использована для создания электрохимических градиентов. [4] [5]
Термин обычно применяется в электрохимии , когда электрическая энергия в форме приложенного напряжения используется для модуляции термодинамической благоприятности химической реакции . В батарее электрохимический потенциал, возникающий из-за движения ионов, уравновешивает энергию реакции электродов. Максимальное напряжение, которое может произвести реакция батареи, иногда называют стандартным электрохимическим потенциалом этой реакции.
Генерация трансмембранного электрического потенциала посредством движения ионов через клеточную мембрану запускает биологические процессы , такие как нервная проводимость, сокращение мышц , секреция гормонов и ощущение . По соглашению, физиологические напряжения измеряются относительно внеклеточной области; типичная животная клетка имеет внутренний электрический потенциал (−70)–(−50) мВ. [2] : 464
Электрохимический градиент необходим для окислительного фосфорилирования митохондрий . Конечным этапом клеточного дыхания является цепь переноса электронов , состоящая из четырех комплексов, встроенных во внутреннюю митохондриальную мембрану. Комплексы I, III и IV перекачивают протоны из матрицы в межмембранное пространство (ММП); для каждой пары электронов, входящей в цепь, десять протонов перемещаются в ММП. Результатом является электрический потенциал более200 мВ . Энергия, возникающая в результате потока протонов обратно в матрицу, используется АТФ-синтазой для объединения неорганического фосфата и АДФ . [6] [2] : 743–745
Подобно цепи переноса электронов, светозависимые реакции фотосинтеза закачивают протоны в тилокоидный просвет хлоропластов для запуска синтеза АТФ. Протонный градиент может быть создан либо посредством нециклического, либо посредством циклического фотофосфорилирования. Из белков, которые участвуют в нециклическом фотофосфорилировании, фотосистема II (ФСII), пластихинон и комплекс цитохрома b 6 f напрямую способствуют созданию протонного градиента. На каждые четыре фотона, поглощенные ФСII, восемь протонов закачиваются в просвет. [2] : 769–770
Несколько других транспортеров и ионных каналов играют роль в создании протонного электрохимического градиента. Один из них — TPK 3 , калиевый канал , который активируется Ca 2+ и проводит K + из просвета тилакоида в строму , что помогает установить электрическое поле . С другой стороны, электронейтральный антипортер оттока K + (KEA 3 ) переносит K + в просвет тилакоида и H + в строму, что помогает установить градиент pH . [7]

Поскольку ионы заряжены, они не могут проходить через клеточные мембраны посредством простой диффузии. Два различных механизма могут транспортировать ионы через мембрану: активный или пассивный транспорт. [ необходима цитата ]
Примером активного транспорта ионов является Na + -K + -АТФаза (NKA). NKA питается гидролизом АТФ в АДФ и неорганический фосфат; на каждую гидролизованную молекулу АТФ три Na + транспортируются наружу и два K + транспортируются внутрь клетки. Это делает внутреннюю часть клетки более отрицательной, чем внешнюю, и, в частности, создает мембранный потенциал V мембраны около−60 мВ . [5]
Примером пассивного транспорта являются потоки ионов через каналы Na + , K + , Ca 2+ и Cl − . В отличие от активного транспорта, пассивный транспорт приводится в действие арифметической суммой осмоса (градиент концентрации) и электрического поля (трансмембранный потенциал). Формально, молярное изменение свободной энергии Гиббса , связанное с успешным транспортом, равно [ требуется ссылка ] , где R представляет собой газовую постоянную , T представляет собой абсолютную температуру , z представляет собой заряд на ион, а F представляет собой постоянную Фарадея . [2] : 464–465
В примере с Na + оба термина, как правило, поддерживают транспорт: отрицательный электрический потенциал внутри клетки притягивает положительный ион, и поскольку Na + концентрируется снаружи клетки, осмос поддерживает диффузию через канал Na + в клетку. В случае с K + эффект осмоса обратный: хотя внешние ионы притягиваются отрицательным внутриклеточным потенциалом, энтропия стремится диффундировать ионы, уже сконцентрированные внутри клетки. Обратное явление (осмос поддерживает транспорт, электрический потенциал противодействует ему) может быть достигнуто для Na + в клетках с аномальными трансмембранными потенциалами: при+70 мВ , приток Na + прекращается; при более высоких потенциалах он становится оттоком. [ необходима цитата ]
Протонные градиенты, в частности, важны во многих типах клеток как форма хранения энергии. Градиент обычно используется для управления АТФ-синтазой, вращением жгутиков или транспортом метаболитов . [15] В этом разделе основное внимание будет уделено трем процессам, которые помогают устанавливать протонные градиенты в соответствующих клетках: бактериородопсин и нециклическое фотофосфорилирование и окислительное фосфорилирование. [ необходима цитата ]
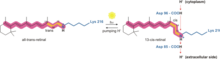
Бактериородопсин генерирует протонный градиент в археях с помощью протонного насоса . Протонный насос использует переносчики протонов для перемещения протонов со стороны мембраны с низкой концентрацией H + на сторону мембраны с высокой концентрацией H + . В бактериородопсине протонный насос активируется поглощением фотонов с длиной волны 568 нм , что приводит к изомеризации основания Шиффа (SB) в ретинале, образуя состояние K. Это перемещает SB от Asp85 и Asp212, вызывая перенос H + из SB в Asp85, образуя состояние M1. Затем белок переходит в состояние M2, отделяя Glu204 от Glu194, что высвобождает протон из Glu204 во внешнюю среду. SB репротонируется Asp96 , что образует состояние N. Важно, что второй протон исходит от Asp96, поскольку его депротонированное состояние нестабильно и быстро репротонируется протоном из цитозоля . Протонирование Asp85 и Asp96 вызывает повторную изомеризацию SB, образуя состояние O. Наконец, бактериородопсин возвращается в свое состояние покоя, когда Asp85 высвобождает свой протон в Glu204. [15] [16]
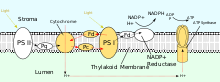
PSII также полагается на свет для управления образованием протонных градиентов в хлоропластах, однако PSII использует векторную окислительно-восстановительную химию для достижения этой цели. Вместо того, чтобы физически переносить протоны через белок, реакции, требующие связывания протонов, будут происходить на внеклеточной стороне, в то время как реакции, требующие высвобождения протонов, будут происходить на внутриклеточной стороне. Поглощение фотонов с длиной волны 680 нм используется для возбуждения двух электронов в P 680 на более высокий энергетический уровень . Эти электроны с более высокой энергией переносятся на связанный с белком пластохинон (PQ A ), а затем на несвязанный пластохинон (PQ B ). Это восстанавливает пластохинон (PQ) до пластохинола (PQH 2 ), который высвобождается из PSII после получения двух протонов из стромы. Электроны в P 680 пополняются путем окисления воды через комплекс, выделяющий кислород (OEC). Это приводит к высвобождению O 2 и H + в просвет, общая реакция [15]
После освобождения из PSII PQH 2 перемещается в комплекс цитохрома b 6 f , который затем переносит два электрона от PQH 2 к пластоцианину в двух отдельных реакциях. Происходящий процесс похож на Q-цикл в комплексе III цепи переноса электронов. В первой реакции PQH 2 связывается с комплексом на стороне просвета, и один электрон переносится в железо-серный центр , который затем переносит его на цитохром f, который затем переносит его на пластоцианин. Второй электрон переносится на гем b L , который затем переносит его на гем b H , который затем переносит его на PQ. Во второй реакции второй PQH 2 окисляется, добавляя электрон к другому пластоцианину и PQ. Обе реакции вместе переносят четыре протона в просвет. [2] : 782–783 [17]

В цепи переноса электронов комплекс I (CI) катализирует восстановление убихинона ( UQ ) до убихинола (UQH 2 ) путем переноса двух электронов от восстановленного никотинамидадениндинуклеотида (NADH), который перемещает четыре протона из митохондриального матрикса в IMS: [18]
Комплекс III (CIII) катализирует Q-цикл . Первый шаг включает перенос двух электронов от UQH 2, восстановленного CI, к двум молекулам окисленного цитохрома c на сайте Q o . На втором шаге еще два электрона восстанавливают UQ до UQH 2 на сайте Q i . Общая реакция: [18]
Комплекс IV (CIV) катализирует перенос двух электронов от цитохрома c, восстановленного CIII, к половине полного кислорода. Использование одного полного кислорода в окислительном фосфорилировании требует переноса четырех электронов. Затем кислород потребляет четыре протона из матрицы для образования воды, в то время как еще четыре протона закачиваются в IMS, чтобы дать общую реакцию [18]
{{cite journal}}: Цитировать журнал требует |journal=( помощь )