
Ионная связь — это тип химической связи , которая включает электростатическое притяжение между противоположно заряженными ионами или между двумя атомами с резко различающимися электроотрицательностями [1] и является основным взаимодействием, происходящим в ионных соединениях . Это один из основных типов связи, наряду с ковалентной связью и металлической связью . Ионы — это атомы (или группы атомов) с электростатическим зарядом. Атомы, которые получают электроны, образуют отрицательно заряженные ионы (называемые анионами ). Атомы, которые теряют электроны, образуют положительно заряженные ионы (называемые катионами ). Этот перенос электронов известен как электровалентность в отличие от ковалентности . В простейшем случае катион — это атом металла , а анион — атом неметалла , но эти ионы могут быть более сложными, например, молекулярные ионы, такие как NH+
4или ТАК2−
4. Проще говоря, ионная связь возникает в результате переноса электронов от металла к неметаллу с получением полной валентной оболочки для обоих атомов.
Чистая ионная связь — в которой один атом или молекула полностью передает электрон другому — не может существовать: все ионные соединения имеют некоторую степень ковалентной связи или совместного использования электронов. Таким образом, термин «ионная связь» дается, когда ионный характер больше, чем ковалентный характер — то есть связь, в которой существует большая разница в электроотрицательности между двумя атомами, в результате чего связь становится более полярной (ионной), чем в ковалентной связи, где электроны распределяются более равномерно. Связи с частично ионным и частично ковалентным характером называются полярными ковалентными связями . [2]
Ионные соединения проводят электричество в расплавленном или растворенном состоянии, обычно не в твердом состоянии. Ионные соединения обычно имеют высокую температуру плавления , в зависимости от заряда ионов, из которых они состоят. Чем выше заряды, тем сильнее силы сцепления и выше температура плавления. Они также имеют тенденцию растворяться в воде; чем сильнее силы сцепления, тем ниже растворимость. [3]
Атомы, имеющие почти полную или почти пустую валентную оболочку , как правило, очень реактивны . Сильно электроотрицательные атомы (например, галогены ) часто имеют только одно или два пустых электронных состояния в своей валентной оболочке и часто связываются с другими атомами или получают электроны, образуя анионы . Слабо электроотрицательные атомы (например, щелочные металлы ) имеют относительно мало валентных электронов , которые могут быть легко потеряны для сильно электроотрицательных атомов. В результате слабо электроотрицательные атомы имеют тенденцию искажать свое электронное облако и образовывать катионы .
Ионная связь может возникнуть в результате окислительно-восстановительной реакции, когда атомы элемента (обычно металла ), энергия ионизации которого низкая, отдают часть своих электронов для достижения стабильной электронной конфигурации. При этом образуются катионы. Атом другого элемента (обычно неметалла) с большим сродством к электрону принимает один или несколько электронов для достижения стабильной электронной конфигурации , и после принятия электронов атом становится анионом. Обычно стабильной электронной конфигурацией является один из благородных газов для элементов в s- и p-блоке , и особые стабильные электронные конфигурации для элементов d- и f-блока . Электростатическое притяжение между анионами и катионами приводит к образованию твердого тела с кристаллографической решеткой , в которой ионы уложены чередующимся образом. В такой решетке обычно невозможно различить дискретные молекулярные единицы, поэтому образующиеся соединения не являются молекулярными. Однако сами ионы могут быть сложными и образовывать молекулярные ионы, такие как ацетат-анион или катион аммония.

Например, обычная поваренная соль — это хлорид натрия . Когда натрий (Na) и хлор (Cl) объединяются, каждый атом натрия теряет по электрону , образуя катионы (Na + ), а каждый атом хлора получает по электрону, образуя анионы (Cl − ). Затем эти ионы притягиваются друг к другу в соотношении 1:1, образуя хлорид натрия (NaCl).
Однако для поддержания нейтральности заряда соблюдаются строгие соотношения между анионами и катионами, так что ионные соединения, в общем, подчиняются правилам стехиометрии, несмотря на то, что не являются молекулярными соединениями. Для соединений, которые являются переходными к сплавам и обладают смешанной ионной и металлической связью, это может быть уже не так. Многие сульфиды, например, образуют нестехиометрические соединения.
Многие ионные соединения называются солями , поскольку они также могут быть образованы реакцией нейтрализации основания Аррениуса, например NaOH, с кислотой Аррениуса, например HCl.
В таком случае говорят, что соль NaCl состоит из кислотного остатка Cl− и основного остатка Na + .
Удаление электронов для образования катиона является эндотермическим процессом, повышающим общую энергию системы. Также могут быть изменения энергии, связанные с разрывом существующих связей или добавлением более одного электрона для образования анионов. Однако действие аниона, принимающего валентные электроны катиона, и последующее притяжение ионов друг к другу высвобождает (решеточную) энергию и, таким образом, снижает общую энергию системы.
Ионная связь будет происходить только в том случае, если общее изменение энергии для реакции благоприятно. В общем случае реакция экзотермическая, но, например, образование оксида ртути (HgO) является эндотермическим. Заряд образующихся ионов является основным фактором прочности ионной связи, например, соль C + A − удерживается вместе электростатическими силами примерно в четыре раза слабее, чем C 2+ A 2− согласно закону Кулона , где C и A представляют собой общие катион и анион соответственно. Размеры ионов и конкретная упаковка решетки игнорируются в этом довольно упрощенном аргументе.
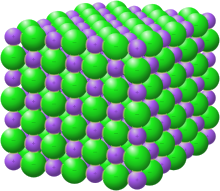
Ионные соединения в твердом состоянии образуют решетчатые структуры. Двумя основными факторами, определяющими форму решетки, являются относительные заряды ионов и их относительные размеры. Некоторые структуры приняты рядом соединений; например, структура каменной соли хлорида натрия также принята многими щелочными галогенидами и бинарными оксидами, такими как оксид магния . Правила Полинга дают указания для прогнозирования и рационализации кристаллических структур ионных кристаллов
Для твердого кристаллического ионного соединения изменение энтальпии при образовании твердого тела из газообразных ионов называется энергией решетки . Экспериментальное значение энергии решетки можно определить с помощью цикла Борна-Габера . Его также можно рассчитать (предсказать) с помощью уравнения Борна-Ланде как сумму электростатической потенциальной энергии , рассчитанной путем суммирования взаимодействий между катионами и анионами, и короткодействующего отталкивательного потенциального члена. Электростатический потенциал можно выразить через межионное разделение и константу ( постоянную Маделунга ), которая учитывает геометрию кристалла. Чем дальше от ядра, тем слабее экран. Уравнение Борна-Ланде дает разумное соответствие энергии решетки, например, хлорида натрия, где расчетное (предсказанное) значение составляет −756 кДж/моль, что сравнимо с −787 кДж/моль при использовании цикла Борна-Габера . [4] [5] В водном растворе прочность связи может быть описана уравнением Бьеррума или Фуосса как функция зарядов ионов, довольно независимо от природы ионов, такой как поляризуемость или размер. [6] Прочность солевых мостиков чаще всего оценивается путем измерения равновесий между молекулами, содержащими катионные и анионные участки, чаще всего в растворе. [7] Константы равновесия в воде указывают на аддитивные вклады свободной энергии для каждого солевого мостика. Другим методом идентификации водородных связей также в сложных молекулах является кристаллография , иногда также ЯМР-спектроскопия.
Силы притяжения, определяющие прочность ионной связи, можно смоделировать с помощью закона Кулона . Прочность ионной связи обычно составляет (приведенные диапазоны варьируются) от 170 до 1500 кДж/моль. [8] [9]
Ионы в кристаллических решетках чисто ионных соединений имеют сферическую форму ; однако, если положительный ион мал и/или сильно заряжен, он исказит электронное облако отрицательного иона, эффект, обобщенный в правилах Фаянса . Эта поляризация отрицательного иона приводит к накоплению дополнительной плотности заряда между двумя ядрами , то есть к частичной ковалентности. Более крупные отрицательные ионы легче поляризуются, но эффект обычно важен только тогда, когда участвуют положительные ионы с зарядами 3+ (например, Al 3+ ). Однако ионы 2+ (Be 2+ ) или даже 1+ (Li + ) показывают некоторую поляризующую способность, поскольку их размеры очень малы (например, LiI является ионным, но имеет некоторую ковалентную связь). Обратите внимание, что это не эффект ионной поляризации , который относится к смещению ионов в решетке из-за приложения электрического поля.
В ионной связи атомы связаны притяжением противоположно заряженных ионов, тогда как в ковалентной связи атомы связаны общими электронами для достижения стабильных электронных конфигураций. В ковалентной связи молекулярная геометрия вокруг каждого атома определяется правилами отталкивания электронных пар валентной оболочки VSEPR , тогда как в ионных материалах геометрия следует правилам максимальной упаковки . Можно сказать, что ковалентная связь более направлена в том смысле, что энергетический штраф за несоблюдение оптимальных углов связи велик, тогда как ионная связь не имеет такого штрафа. Нет общих электронных пар, которые отталкивали бы друг друга, ионы просто должны быть упакованы как можно эффективнее. Это часто приводит к гораздо более высоким координационным числам . В NaCl каждый ион имеет 6 связей, и все углы связи составляют 90°. В CsCl координационное число равно 8. Для сравнения, углерод обычно имеет максимум четыре связи.
Чисто ионная связь существовать не может, так как близость объектов, участвующих в связи, допускает некоторую степень совместного использования электронной плотности между ними. Поэтому все ионные связи имеют некоторый ковалентный характер. Таким образом, связь считается ионной, где ионный характер больше, чем ковалентный характер. Чем больше разница в электроотрицательности между двумя типами атомов, участвующих в связи, тем она более ионна (полярна). Связи с частично ионным и частично ковалентным характером называются полярными ковалентными связями . Например, взаимодействия Na–Cl и Mg–O имеют несколько процентов ковалентности, в то время как связи Si–O обычно на ~50% ионные и на ~50% ковалентные. Полинг подсчитал, что разница электроотрицательности 1,7 (по шкале Полинга ) соответствует 50% ионному характеру, так что разница больше 1,7 соответствует связи, которая является преимущественно ионной. [10]
Ионный характер в ковалентных связях может быть непосредственно измерен для атомов, имеющих квадрупольные ядра ( 2H , 14N , 81,79Br , 35,37Cl или 127I ). Эти ядра обычно являются объектами исследований ядерного квадрупольного резонанса ЯКР и ядерного магнитного резонанса ЯМР . Взаимодействия между ядерными квадрупольными моментами Q и градиентами электрического поля (EFG) характеризуются через константы ядерного квадрупольного взаимодействия
где член eq zz соответствует главному компоненту тензора EFG, а e — элементарный заряд. В свою очередь, градиент электрического поля открывает путь к описанию мод связи в молекулах, когда значения QCC точно определяются методами ЯМР или ЯКР.
В общем, когда ионная связь происходит в твердом (или жидком) состоянии, невозможно говорить об одной «ионной связи» между двумя отдельными атомами, потому что силы сцепления, которые удерживают решетку вместе, имеют более коллективную природу. Это совершенно иначе в случае ковалентной связи, где мы часто можем говорить об отдельной связи, локализованной между двумя конкретными атомами. Однако, даже если ионная связь сочетается с некоторой ковалентностью, результатом не обязательно являются дискретные связи локализованного характера. [2] В таких случаях результирующая связь часто требует описания в терминах зонной структуры, состоящей из гигантских молекулярных орбиталей, охватывающих весь кристалл. Таким образом, связь в твердом теле часто сохраняет свою коллективную, а не локализованную природу. Когда разница в электроотрицательности уменьшается, связь может затем привести к полупроводнику , полуметаллу или , в конечном итоге, металлическому проводнику с металлической связью.