Йод-131 ( 131 I , I-131 ) — важный радиоизотоп йода , открытый Гленном Сиборгом и Джоном Ливингудом в 1938 году в Калифорнийском университете в Беркли. [1] Период полураспада радиоактивного распада составляет около восьми дней. Это связано с ядерной энергетикой, медицинскими диагностическими и лечебными процедурами, а также добычей природного газа. Он также играет важную роль в качестве радиоактивного изотопа, присутствующего в продуктах ядерного деления , и внес значительный вклад в опасность для здоровья от испытаний атомной бомбы на открытом воздухе в 1950-х годах и от чернобыльской катастрофы , а также составлял значительную часть опасность загрязнения в первые недели ядерного кризиса на Фукусиме . Это связано с тем, что 131 I является основным продуктом деления урана и плутония , составляя почти 3 % от общего количества продуктов деления (по весу). См. Выход продуктов деления для сравнения с другими радиоактивными продуктами деления. 131 I также является основным продуктом деления урана-233 , получаемого из тория .
Из-за своего режима бета-распада йод-131 вызывает мутации и гибель клеток, в которые он проникает, а также других клеток на расстоянии до нескольких миллиметров. По этой причине высокие дозы изотопа иногда менее опасны, чем низкие дозы, поскольку они имеют тенденцию убивать ткани щитовидной железы , которые в противном случае стали бы раковыми в результате радиации. Например, у детей, получавших умеренную дозу 131 I по поводу аденомы щитовидной железы, наблюдалось заметное увеличение заболеваемости раком щитовидной железы, а у детей, получавших гораздо более высокую дозу, этого не наблюдалось. [2] Аналогичным образом, большинство исследований использования очень высоких доз 131 I для лечения болезни Грейвса не выявили какого-либо увеличения заболеваемости раком щитовидной железы, хотя существует линейное увеличение риска рака щитовидной железы при абсорбции 131 I в умеренных дозах. [3] Таким образом, йод-131 все реже используется в малых дозах в медицинских целях (особенно у детей), но все чаще используется только в больших и максимальных лечебных дозах, как способ уничтожения целевых тканей. Это известно как «терапевтическое использование».
Йод-131 можно «увидеть» с помощью методов визуализации ядерной медицины (например, гамма-камер ) всякий раз, когда он применяется в терапевтических целях, поскольку около 10% его энергии и дозы радиации приходится на гамма-излучение. Однако, поскольку остальные 90% радиации (бета-излучение) вызывают повреждение тканей, не способствуя какой-либо способности видеть или «изображать» изотоп, предпочтительны другие менее повреждающие радиоизотопы йода, такие как йод-123 (см. Изотопы йода ). в ситуациях, когда требуется только ядерная визуализация. Изотоп 131 I до сих пор иногда используется для чисто диагностических (т. е. визуализационных) работ из-за его низкой стоимости по сравнению с другими радиоизотопами йода. Очень маленькие дозы медицинской визуализации ( 131 I) не показали увеличения заболеваемости раком щитовидной железы. Низкая стоимость 131 I, в свою очередь, обусловлена относительной легкостью создания 131 I путем нейтронной бомбардировки природного теллура в ядерном реакторе с последующим выделением 131 I различными простыми методами (т. е. нагреванием для удаления летучий йод). Напротив, другие радиоизотопы йода обычно создаются гораздо более дорогими методами, начиная с циклотронного излучения капсул со сжатым ксеноновым газом. [4]
Йод-131 также является одним из наиболее часто используемых гамма-излучающих радиоактивных промышленных индикаторов . Радиоактивные изотопы-индикаторы вводятся вместе с жидкостью гидроразрыва для определения профиля закачки и местоположения трещин, образовавшихся в результате гидроразрыва. [5]
Некоторые исследования предполагают, что гораздо меньшие случайные дозы йода-131, чем те, которые используются в медицинских терапевтических процедурах, являются основной причиной увеличения количества случаев рака щитовидной железы после случайного ядерного загрязнения. Эти исследования предполагают, что рак возникает в результате остаточного радиационного повреждения тканей, вызванного 131 I, и должен появляться в основном спустя годы после воздействия, спустя много времени после распада 131 I. [6] [7] Другие исследования не обнаружили корреляции. [8] [9]
Большая часть производства 131 I происходит в результате нейтронного облучения мишени из естественного теллура в ядерном реакторе. При облучении природного теллура почти полностью образуется 131 I как единственный радионуклид с периодом полураспада, превышающим часы, поскольку большинство более легких изотопов теллура становятся более тяжелыми стабильными изотопами, а также стабильными йодом или ксеноном. Однако самый тяжелый природный нуклид теллура, 130 Te (34% природного теллура), поглощает нейтрон, образуя теллур-131, который бета-распадает с периодом полураспада 25 минут до 131 I.
Соединение теллура можно облучать, пока оно связано в виде оксида на ионообменной колонке, при этом выделившийся 131 I затем элюируется в щелочной раствор. [10] Чаще всего порошкообразный элементарный теллур облучают, а затем отделяют от него 131 I путем сухой перегонки йода, который имеет гораздо более высокое давление паров . Затем элемент растворяют в слабощелочном растворе стандартным способом с получением 131 I в виде йодида и гипойодата (который вскоре восстанавливается до йодида). [11]
131 I представляет собой продукт деления с выходом 2,878% от урана - 235 [12] и может выделяться при испытаниях ядерного оружия и ядерных авариях . Однако короткий период полураспада означает, что он не присутствует в значительных количествах в охлажденном отработавшем ядерном топливе , в отличие от йода-129 , период полураспада которого почти в миллиард раз больше, чем у 131 I.
Некоторые атомные электростанции выбрасывают его в атмосферу в небольших количествах. [13]
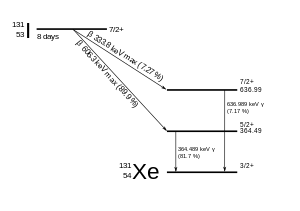
131 I распадается с периодом полураспада 8,02 дня с бета-минус- и гамма- выбросами. Этот изотоп йода имеет в своем ядре 78 нейтронов , тогда как единственный стабильный нуклид 127 I имеет 74. При распаде 131 I чаще всего (89% времени) расходует свою энергию распада в 971 кэВ, превращаясь в стабильный ксенон- 131 в два этапа, причем гамма-распад быстро следует за бета-распадом:
Таким образом, первичными выбросами распада 131 I являются электроны с максимальной энергией 606 кэВ (распространение 89%, остальные 248–807 кэВ) и гамма-лучи 364 кэВ (обилие 81%, остальные 723 кэВ). [14] Бета-распад также производит антинейтрино , которое уносит различное количество энергии бета-распада. Электроны из-за своей высокой средней энергии (190 кэВ, с типичными спектрами бета-распада) проникают в ткани на глубину от 0,6 до 2 мм . [15]
Йод, содержащийся в пище, усваивается организмом и преимущественно концентрируется в щитовидной железе , где он необходим для функционирования этой железы. Когда 131 I присутствует в окружающей среде в больших количествах в результате радиоактивных осадков , он может абсорбироваться через загрязненную пищу, а также накапливаться в щитовидной железе. По мере своего распада он может привести к повреждению щитовидной железы. Основным риском воздействия 131 I является повышенный риск радиационно-индуцированного рака в более позднем возрасте. Другие риски включают возможность нераковых новообразований и тиреоидита . [3]
Риск рака щитовидной железы в более позднем возрасте, по-видимому, снижается с увеличением возраста на момент воздействия. Большинство оценок риска основано на исследованиях, в которых радиационное облучение наблюдалось у детей и подростков. Когда взрослые подвергаются воздействию, эпидемиологам было трудно обнаружить статистически значимую разницу в частоте заболеваний щитовидной железы по сравнению с аналогичной, но в остальном не подвергавшейся воздействию группой. [3] [17]
Риск можно снизить, принимая добавки йода, повышая общее количество йода в организме и, следовательно, уменьшая его поглощение и удержание на лице и груди, а также снижая относительную долю радиоактивного йода. Однако после катастрофы такие добавки не были последовательно распространены среди населения, проживающего вблизи Чернобыльской АЭС [18] , хотя они были широко распространены среди детей в Польше.
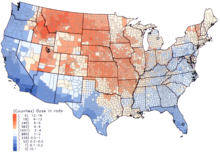
В США самые высокие дозы выпадения 131 I произошли в 1950-х и начале 1960-х годов у детей, потреблявших свежее молоко из источников, загрязненных в результате наземных испытаний ядерного оружия. [6] Национальный институт рака предоставляет дополнительную информацию о последствиях для здоровья от воздействия радиоактивных осадков 131 I, [19] а также индивидуальные оценки для тех, кто родился до 1971 года, для каждого из 3070 округов США. Расчеты взяты из данных, собранных относительно осадков в результате испытаний ядерного оружия, проведенных на полигоне в Неваде . [20]
27 марта 2011 года Департамент общественного здравоохранения Массачусетса сообщил, что 131 I был обнаружен в очень низких концентрациях в дождевой воде из проб, собранных в Массачусетсе, США, и что он, вероятно, произошел с электростанции Фукусима. [21] Фермеры рядом с заводом выбрасывали сырое молоко, а тестирование в Соединенных Штатах выявило 0,8 пикокюри на литр йода-131 в образце молока, но уровни радиации были в 5000 раз ниже «определенного уровня вмешательства» FDA. Ожидалось, что уровни снизятся относительно быстро [22].
Распространенным методом лечения для предотвращения воздействия йода-131 является насыщение щитовидной железы обычным стабильным йодом-127 в виде йодида или йодатной соли.

Йод-131 используется для лучевой терапии с открытыми источниками в ядерной медицине для лечения ряда заболеваний. Его также можно обнаружить с помощью гамма-камер для диагностической визуализации , однако его редко применяют только в диагностических целях: визуализация обычно проводится после приема терапевтической дозы. [24] Использование 131 I в виде йодистой соли использует механизм поглощения йода нормальными клетками щитовидной железы .
Основные области применения 131 I включают лечение тиреотоксикоза (гипертиреоза), вызванного болезнью Грейвса , а иногда и гиперактивных узлов щитовидной железы (аномально активной ткани щитовидной железы, не являющейся злокачественной). О терапевтическом использовании радиоактивного йода для лечения гипертиреоза, вызванного болезнью Грейвса, впервые сообщил Сол Герц в 1941 году. Доза обычно вводится перорально (в виде жидкости или капсулы) в амбулаторных условиях и обычно составляет 400–600 мегабеккерелей (МБк). ). [25] Радиоактивный йод (йод-131) сам по себе потенциально может усугубить тиреотоксикоз в первые несколько дней после лечения. Одним из побочных эффектов лечения является начальный период в несколько дней усиления симптомов гипертиреоза. Это происходит потому, что когда радиоактивный йод разрушает клетки щитовидной железы, они могут выделять гормон щитовидной железы в кровоток. По этой причине иногда пациентов предварительно лечат тиреостатическими препаратами, такими как метимазол, и/или им назначают симптоматическое лечение, такое как пропранолол. Лечение радиоактивным йодом противопоказано при грудном вскармливании и беременности [26].
Йод-131 в более высоких дозах, чем при тиреотоксикозе, используется для удаления остатков ткани щитовидной железы после полной тиреоидэктомии для лечения рака щитовидной железы . [27] [25]
Типичные терапевтические дозы I-131 составляют от 2220 до 7400 мегабеккерелей (МБк). [28] Из-за такой высокой радиоактивности и из-за того, что воздействие бета-излучения на ткани желудка вблизи нерастворенной капсулы будет высоким, I-131 иногда вводят пациентам-людям в небольшом количестве жидкости. Введение этой жидкой формы обычно осуществляется через соломинку, которая используется для медленного и осторожного всасывания жидкости из защищенного контейнера. [29] Для введения животным (например, кошкам с гипертиреозом) по практическим соображениям изотоп необходимо вводить путем инъекции. Европейские рекомендации рекомендуют вводить капсулы из-за «большего удобства для пациента и превосходной радиационной защиты для лиц, осуществляющих уход». [30]
Дозы абляции обычно вводятся в стационаре , и международные основные стандарты безопасности МАГАТЭ рекомендуют не выписывать пациентов до тех пор, пока активность не упадет ниже 1100 МБк. [31] В рекомендациях МКРЗ говорится, что в целях ограничения дозы к «утешителям и опекунам» пациентов, проходящих радионуклидную терапию, следует относиться как к представителям общественности, и любые ограничения для пациента должны разрабатываться на основе этого принципа. [32]
Пациентов, получающих лечение радиоактивным йодом I-131, можно предупредить о том, чтобы они не вступали в половые контакты в течение одного месяца (или короче, в зависимости от введенной дозы), а женщинам – не беременеть в течение шести месяцев после этого. «Это связано с тем, что теоретический риск для развивающегося плода существует, даже несмотря на то, что количество сохраняемой радиоактивности может быть небольшим, и нет никаких медицинских доказательств фактического риска от лечения радиоактивным йодом. Такая мера предосторожности по существу устранит прямое воздействие радиоактивности на плод и заметно снизить вероятность зачатия со спермой, которая теоретически могла быть повреждена воздействием радиоактивного йода». [33] Эти рекомендации варьируются от больницы к больнице и будут зависеть от национального законодательства и рекомендаций, а также от получаемой дозы радиации. Некоторые также советуют не обнимать и не держать детей, пока радиация все еще высока, и может быть рекомендовано соблюдать дистанцию в один или два метра от других. [34]
I-131 будет выводиться из организма в течение следующих нескольких недель после его приема. Большая часть I-131 будет выведена из организма человека в течение 3–5 дней путем естественного распада и выделения с потом и мочой. Меньшие количества будут продолжать выделяться в течение следующих нескольких недель, поскольку организм перерабатывает гормоны щитовидной железы, вырабатываемые с помощью I-131. По этой причине рекомендуется регулярно чистить туалеты, раковины, простыни и одежду, которой пользовался человек, получивший лечение. Пациентам также можно посоветовать всегда носить тапочки или носки и избегать длительного тесного контакта с другими людьми. Это сводит к минимуму случайное воздействие на членов семьи, особенно детей. [35] Можно рекомендовать использование дезинфицирующего средства, специально предназначенного для удаления радиоактивного йода. Не рекомендуется использовать для очистки растворы хлорного отбеливателя или чистящие средства, содержащие хлорный отбеливатель, поскольку может выделяться радиоактивный элементарный газ йода. [36] Переносимый по воздуху I-131 может вызвать больший риск вторичного воздействия, распространяя загрязнение на большую территорию. Пациенту рекомендуется по возможности оставаться в палате, к которой примыкает ванная комната, чтобы ограничить непреднамеренное воздействие на членов семьи.
Во многих аэропортах теперь есть детекторы радиации для обнаружения контрабанды радиоактивных материалов. Пациентов следует предупредить, что если они путешествуют самолетом, они могут вызвать срабатывание детекторов радиации в аэропортах в течение 95 дней после лечения 131 I. [37]
Изотоп 131 I также используется в качестве радиоактивной метки для некоторых радиофармацевтических препаратов , которые можно использовать в терапии, например, 131 I- метайодобензилгуанидин ( 131 I-MIBG) для визуализации и лечения феохромоцитомы и нейробластомы . Во всех этих терапевтических целях 131 I разрушает ткани бета-излучением ближнего действия . Около 90% радиационного повреждения тканей происходит за счет бета-излучения, а остальная часть происходит за счет гамма-излучения (на большем расстоянии от радиоизотопа). Его можно увидеть при диагностическом сканировании после использования в качестве терапии, поскольку 131 I также является гамма-излучателем.
Из-за канцерогенности бета-излучения щитовидной железы в малых дозах I-131 редко используется в первую очередь или исключительно для диагностики (хотя в прошлом это было более распространено из-за относительной простоты производства и низкой стоимости этого изотопа). Вместо этого в диагностических тестах ( ядерное медицинское сканирование щитовидной железы) используется более чисто гамма-излучающий радиоактивный йод йод-123 . Йод-125 с более длительным периодом полураспада также иногда используется, когда для диагностики необходим радиоактивный йод с более длительным периодом полураспада, а также при лечении брахитерапией (изотоп заключен в небольшие металлические капсулы, похожие на семена), где низкоэнергетическое гамма-излучение без бета-излучения компонент делает йод-125 полезным. Остальные радиоизотопы йода в брахитерапии никогда не используются.
Использование 131 I в качестве медицинского изотопа обвиняют в том, что регулярные поставки твердых биологических веществ не допускаются к пересечению канадско-американской границы. [38] Такие материалы могут попасть в канализацию непосредственно из медицинских учреждений или выделяться пациентами после лечения.
Йод-131 , впервые использованный в 1951 году для локализации утечек в системе питьевого водоснабжения в Мюнхене , Германия, стал одним из наиболее часто используемых гамма-излучающих промышленных радиоактивных индикаторов , нашедших применение в изотопной гидрологии и обнаружении утечек. [39] [40] [41] [42]
С конца 1940-х годов радиоактивные индикаторы используются в нефтяной промышленности. Помеченная на поверхности вода затем отслеживается в скважине с помощью соответствующего гамма-детектора для определения потоков и обнаружения подземных утечек. I-131 был наиболее широко используемым изотопом для мечения в водном растворе йодида натрия . [43] [44] [45] Он используется для характеристики жидкости гидроразрыва , чтобы помочь определить профиль закачки и расположение трещин, созданных при гидроразрыве пласта . [46] [47] [48]
В 1997 году NCI провел детальную оценку дозы облучения щитовидной железы жителей США от I-131 в результате испытаний в Неваде.
(...) мы оценили риск рака щитовидной железы в результате этого воздействия и подсчитали, что около 49 000 случаев, связанных с радиоактивными осадками, могут произойти в Соединенных Штатах, почти все из них среди людей, которые в какой-то момент в период с 1951 по 20 лет были моложе 20 лет. 57, с 95-процентным пределом неопределенности 11 300 и 212 000.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка )никакой связи между выбросами йода-131 в Хэнфорде и заболеваниями щитовидной железы не наблюдалось.
[Результаты] показывают, что если и существует повышенный риск заболеваний щитовидной железы в результате воздействия йода-131 Хэнфорда, то он, вероятно, слишком мал, чтобы его можно было наблюдать с помощью лучших доступных эпидемиологических методов.Управляющее резюме
{{cite book}}: |website=игнорируется ( помощь ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )