Карборановые кислоты H(CXB
11И
5З
6) (X, Y, Z = H, Alk, F, Cl, Br, CF 3 ) представляют собой класс суперкислот , [1] некоторые из которых, по оценкам, по крайней мере в миллион раз сильнее 100% чистой серной кислоты с точки зрения их значений функции кислотности Гаммета ( H 0 ≤ –18) и обладают вычисленными значениями p K a значительно ниже –20, что делает их одними из самых сильных известных кислот Бренстеда. [2] [3] [4] Наиболее изученным примером является сильно хлорированное производное H(CHB
11Кл
11) . Кислотность H(CHB
11Кл
11) было обнаружено, что значительно превосходит трифликовую кислоту , CF
3ТАК
3H , и бистрифлимид , (CF
3ТАК
2)
2NH , соединения, которые ранее считались сильнейшими выделяемыми кислотами.
Их высокая кислотность обусловлена обширной делокализацией их сопряженных оснований, анионов карбораната (CXB 11 Y 5 Z 6 − ), которые обычно дополнительно стабилизируются электроотрицательными группами, такими как Cl, F и CF 3 . Из-за отсутствия окислительных свойств и исключительно низкой нуклеофильности и высокой стабильности их сопряженных оснований они являются единственными суперкислотами, известными протонированием фуллерена C 60 без его разложения. [5] [6] Кроме того, они образуют стабильные, выделяемые соли с протонированным бензолом , C 6 H 7 + , исходным соединением промежуточных соединений Уиланда, встречающихся в реакциях электрофильного ароматического замещения .
Фторированная карборановая кислота, H(CHB
11Ф
11) , даже сильнее хлорированной карборановой кислоты. Она способна протонировать бутан с образованием трет -бутилового катиона при комнатной температуре и является единственной известной кислотой, протонирующей диоксид углерода с образованием мостикового катиона, [H(CO
2)
2]+
, что делает его, возможно, самой сильной известной кислотой. В частности, CO 2 не подвергается наблюдаемому протонированию при обработке смешанными суперкислотами HF-SbF 5 или HSO 3 F-SbF 5 . [7] [8] [9]
Как класс, карборановые кислоты образуют самую кислую группу хорошо определенных, изолируемых известных веществ, гораздо более кислых, чем ранее известные однокомпонентные сильные кислоты, такие как трифторметансульфоновая кислота или хлорная кислота . В некоторых случаях, как и в случае почти пергалогенированных производных, упомянутых выше, их кислотность соперничает (и, возможно, превосходит) кислотность традиционных смешанных суперкислот Льюиса-Бренстеда, таких как магическая кислота и фторантимоновая кислота . (Однако, прямое сравнение до сих пор не было возможным из-за отсутствия меры кислотности, которая подходила бы для обоих классов кислот: значения p K a плохо определены для химически сложных смешанных кислот, в то время как значения H 0 не могут быть измерены для очень высокоплавких карборановых кислот).

Сила кислоты Бренстеда-Лоури соответствует ее способности выделять ион водорода. Одной из распространенных мер силы кислоты для концентрированных, сверхкислотных жидких сред является функция кислотности Гаммета, H 0 . Основываясь на своей способности количественно протонировать бензол, хлорированная карборановая кислота H(CHB
11Кл
11) по консервативным оценкам имеет значение H 0 на уровне или ниже −18, что приводит к общему утверждению, что карборановые кислоты по крайней мере в миллион раз сильнее 100% серной кислоты ( H 0 = −12). [11] [12] Однако, поскольку значение H 0 измеряет протонирующую способность жидкой среды, кристаллическая и высокоплавкая природа этих кислот исключает прямое измерение этого параметра. С точки зрения p K a , несколько иной меры кислотности, определяемой как способность данного растворенного вещества подвергаться ионизации в растворителе, карборановые кислоты, как оценивается, имеют значения p K a ниже −20, даже без электроноакцепторных заместителей на атомах бора (например, H(CHB
11ЧАС
11) оценивается как имеющий ap K a −24), [13] с (пока неизвестным) полностью фторированным аналогом H(CB
11Ф
12) с расчетным p K a −46. [4] Известная кислота H(CHB
11Ф
11) с одним атомом фтора меньше, как ожидается, будет лишь немного слабее (p K a < −40).
В газовой фазе H(CHB
11Ф
11) имеет вычисленную кислотность 216 ккал/моль по сравнению с экспериментально определенной кислотностью 241 ккал/моль (в разумном согласии с вычисленным значением 230 ккал/моль) для H(CHB
11Кл
11) . Напротив, HSbF 6 (упрощенная модель для протон-донорных видов в фторсурьмяной кислоте ) имеет вычисленную кислотность газовой фазы 255 ккал/моль, тогда как предыдущий экспериментально определенный рекордсмен был (C 4 F 9 SO 2 ) 2 NH, конгенер бистрифлимида , при 291 ккал/моль. Таким образом, H(CHB
11Ф
11) является, вероятно, наиболее кислым веществом, синтезированным в больших количествах, с точки зрения кислотности газовой фазы. Ввиду своей уникальной реакционной способности, он также является сильным претендентом на звание самого кислого вещества в конденсированной фазе (см. выше). Были предсказаны некоторые даже более сильные кислые производные с кислотностью газовой фазы < 200 ккал/моль. [14] [15]
Карборановые кислоты отличаются от классических суперкислот тем, что являются четко определенными однокомпонентными веществами. Напротив, классические суперкислоты часто представляют собой смеси кислоты Бренстеда и кислоты Льюиса (например, HF/SbF 5 ). [6] Несмотря на то, что они являются самой сильной кислотой, карборановые кислоты на основе бора описываются как «мягкие», чисто протонирующие слабоосновные вещества без дополнительных побочных реакций. [16] В то время как обычные суперкислоты разлагают фуллерены из-за своего сильно окисляющего компонента кислоты Льюиса, карборановая кислота обладает способностью протонировать фуллерены при комнатной температуре, давая изолируемую соль. [17] [6] Кроме того, анион, который образуется в результате переноса протона, почти полностью инертен. Это свойство делает карборановые кислоты единственными веществами, которые по кислотности сопоставимы со смешанными суперкислотами, которые также можно хранить в стеклянной бутылке, поскольку различные виды, выделяющие фтор (которые атакуют стекло), не присутствуют или не образуются. [18] [17]
Карборановая кислота была впервые обнаружена и синтезирована профессором Кристофером Ридом и его коллегами в 2004 году в Калифорнийском университете в Риверсайде. [6] Исходная молекула, из которой получена карборановая кислота, икосаэдрический карборанат-анион, HCB
11ЧАС−
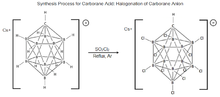
11, был впервые синтезирован в DuPont в 1967 году Вальтером Кнотом. Исследования свойств этой молекулы были приостановлены до середины 1980-х годов, когда чешская группа ученых-борологов Плешек, Штибр и Гержманек усовершенствовали процесс галогенирования молекул карборана. Эти открытия сыграли важную роль в разработке современной процедуры синтеза карборановой кислоты. [17] [19] Процесс состоит из обработки Cs + [HCB 11 H 11 ] − с помощью SO
2Кл
2, кипячение с обратным холодильником в сухом аргоне для полного хлорирования молекулы, давая карборановую кислоту, но было показано, что это приводит к полному хлорированию только при определенных условиях. [20] [17] [21]
В 2010 году Рид опубликовал руководство, в котором подробно описаны процедуры синтеза карборановых кислот и их производных. [22] Тем не менее, синтез карборановых кислот остается длительным и сложным и требует хорошо обслуживаемого перчаточного бокса и некоторого специализированного оборудования. Исходным материалом является коммерчески доступный декаборан(14) , высокотоксичное вещество. Наиболее хорошо изученная карборановая кислота H(CHB
11Кл
11) готовится в 13 этапов. Последние несколько этапов особенно чувствительны и требуют перчаточного бокса при < 1 ppm H 2 O без паров слабощелочных растворителей, поскольку такие слабые основания, как бензол или дихлорметан, будут реагировать с электрофилами на основе карборана и кислотами Бренстеда. Последним этапом синтеза является метатезис соли μ-гидридодисилилия карбораната с избытком жидкости, безводного хлористого водорода, предположительно обусловленный образованием сильных связей Si–Cl и H–H в летучих побочных продуктах:
Продукт был выделен путем выпаривания побочных продуктов и охарактеризован с помощью инфракрасного (ν CH = 3023 см −1 ) и ядерного магнитного резонанса (δ 4,55 (с, 1H, CH), 20,4 (с, 1H, H + ) в жидком SO 2 ) спектров (обратите внимание на крайне слабопольный химический сдвиг кислого протона). [22] Хотя реакции, используемые в синтезе, аналогичны, получение чистого образца более кислого H(CHB
11Ф
11) оказался еще более сложным, требующим чрезвычайно строгих процедур для исключения следов слабоосновных примесей. [7]
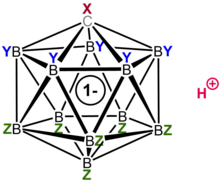
Карборановая кислота состоит из 11 атомов бора; каждый атом бора связан с атомом хлора. Атомы хлора служат для повышения кислотности и действуют как щиты от атак извне из-за стерических препятствий, которые они образуют вокруг кластера. Кластер, состоящий из 11 боров, 11 хлоров и одного атома углерода, соединен с атомом водорода, связанным с атомом углерода. Атомы бора и углерода могут образовывать шесть связей из-за способности бора образовывать трехцентровые двухэлектронные связи. [19]

Хотя структура карборановой кислоты сильно отличается от обычных кислот, обе распределяют заряд и стабильность схожим образом. Карборанат-анион распределяет свой заряд путем делокализации электронов по всем 12 атомам клетки. [23] Это было показано в исследовании рентгеновской дифракции монокристалла, выявившим укороченные длины связей в гетероциклической части кольца, что предполагает электронную делокализацию. [24]
Хлорированный карба- клозо -додекаборатный анион ГХБ
11Кл−
11представляет собой исключительно стабильный анион с вершинами B–Cl, которые ранее были описаны как «замещающе инертные».

Дескриптор closo указывает на то, что молекула формально получена (путем замены B на C + ) из борана стехиометрии и заряда [B n H n ] 2− ( n = 12 для известных карборановых кислот). [25] Структура, подобная клетке, образованная 11 атомами бора и 1 атомом углерода, позволяет электронам быть высокоделокализованными через 3D клетку (особая стабилизация карборановой системы была названа «σ-ароматичностью»), а высокая энергия, необходимая для разрушения части кластера бора молекулы, — это то, что придает аниону его замечательную стабильность. [25] Поскольку анион чрезвычайно стабилен, он не будет вести себя как нуклеофил по отношению к протонированному субстрату, в то время как сама кислота совершенно не является окислителем, в отличие от кислотных компонентов Льюиса многих суперкислот, таких как пентафторид сурьмы. Следовательно, чувствительные молекулы, такие как C 60, могут быть протонированы без разложения. [26] [27]
Существует множество предложенных применений для борсодержащих карборановых кислот. Например, их предлагали в качестве катализаторов для крекинга углеводородов и изомеризации н- алканов с образованием разветвленных изоалканов («изооктан», например). Карборановые кислоты также могут использоваться в качестве сильных селективных кислот Бренстеда для тонкого химического синтеза, где низкая нуклеофильность противоаниона может быть выгодной. В механистической органической химии их можно использовать при изучении реакционноспособных катионных промежуточных соединений. [28] В неорганическом синтезе их непревзойденная кислотность может позволить изолировать экзотические виды, такие как соли протонированного ксенона. [18] [19] [29]