
Устойчивость растений к болезням защищает растения от патогенов двумя способами: с помощью предварительно сформированных структур и химикатов, а также с помощью реакций иммунной системы, вызванных инфекцией. По отношению к восприимчивому растению устойчивость к болезням представляет собой снижение роста патогенов на растении или в нем (и, следовательно, снижение заболеваемости), в то время как термин толерантность к болезням описывает растения, которые демонстрируют незначительный ущерб от болезней, несмотря на значительные уровни патогенов. Исход болезни определяется трехсторонним взаимодействием патогена, растения и условий окружающей среды (взаимодействие, известное как треугольник болезней ).
Активирующие защиту соединения могут перемещаться от клетки к клетке и систематически через сосудистую систему растения. Однако растения не имеют циркулирующих иммунных клеток , поэтому большинство типов клеток демонстрируют широкий набор антимикробной защиты. Хотя очевидные качественные различия в устойчивости к болезням можно наблюдать при сравнении нескольких образцов (что позволяет классифицировать их как «устойчивые» или «восприимчивые» после заражения одним и тем же штаммом патогена при схожих уровнях инокуляции в схожих условиях), градация количественных различий в устойчивости к болезням чаще наблюдается между штаммами растений или генотипами . Растения последовательно сопротивляются определенным патогенам, но поддаются другим; устойчивость обычно специфична для определенных видов патогенов или штаммов патогенов.
Устойчивость растений к болезням имеет решающее значение для надежного производства продовольствия и обеспечивает значительное сокращение сельскохозяйственного использования земли, воды, топлива и других ресурсов. Растения как в естественных, так и в культивируемых популяциях обладают врожденной устойчивостью к болезням, но это не всегда их защищает.
Фитофтороз Великий голод Ирландии 1840-х годов был вызван оомицетом Phytophthora infestans . Первый в мире массово выращиваемый сорт бананов Gros Michel был утрачен в 1920-х годах из-за панамской болезни, вызванной грибком Fusarium oxysporum . Текущие эпидемии стеблевой ржавчины пшеницы , листовой ржавчины и желтой полосатой ржавчины, распространяющиеся из Восточной Африки на Индийский субконтинент, вызываются ржавчинными грибами Puccinia graminis и P. striiformis . Другие эпидемии включают каштановую ржавчину , а также повторяющиеся тяжелые заболевания растений, такие как пирикуляриоз риса , соевая цистообразующая нематода и рак цитрусовых . [1] [2]
Фитопатогены могут быстро распространяться на большие расстояния, переносимые водой, ветром, насекомыми и людьми. По оценкам, в крупных регионах и среди многих видов сельскохозяйственных культур болезни обычно снижают урожайность растений на 10% каждый год в более развитых странах или сельскохозяйственных системах, но потери урожая из-за болезней часто превышают 20% в менее развитых условиях. [1]
Однако борьба с болезнями достаточно успешна для большинства культур. Борьба с болезнями достигается путем использования растений, выведенных с хорошей устойчивостью ко многим болезням, а также подходов к выращиванию растений, таких как севооборот , семена без патогенов, подходящая дата посадки и плотность растений, контроль влажности поля и использование пестицидов .

Иммунная система растений несет два взаимосвязанных яруса рецепторов, один из которых чаще всего обнаруживает молекулы вне клетки, а другой чаще всего обнаруживает молекулы внутри клетки. Обе системы обнаруживают нарушителя и реагируют, активируя антимикробную защиту в инфицированной клетке и соседних клетках. В некоторых случаях сигналы, активирующие защиту, распространяются на остальную часть растения или даже на соседние растения. Эти две системы обнаруживают различные типы молекул патогенов и классы растительных рецепторных белков. [5] [6]
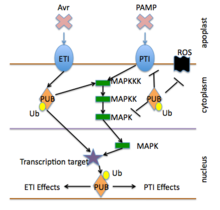
Первый уровень в первую очередь управляется рецепторами распознавания образов , которые активируются путем распознавания эволюционно консервативных патогенных или микробно-ассоциированных молекулярных образов (PAMP или MAMP). Активация PRR приводит к внутриклеточной сигнализации, транскрипционному перепрограммированию и биосинтезу сложного выходного ответа, который ограничивает колонизацию. Система известна как иммунитет, запускаемый PAMP, или иммунитет, запускаемый образами (PTI). [7] [6] [8]
Второй уровень, в первую очередь регулируемый продуктами гена R , часто называют иммунитетом, запускаемым эффекторами (ETI). ETI обычно активируется присутствием специфических «эффекторов» патогенов, а затем запускает сильные антимикробные реакции (см. раздел гена R ниже).
Помимо PTI и ETI, защитные механизмы растений могут активироваться путем обнаружения соединений, связанных с повреждением (DAMP), таких как части клеточной стенки растения, высвобождаемые во время патогенной инфекции. [9]
Реакции, активируемые рецепторами PTI и ETI, включают в себя управление ионными каналами , окислительный взрыв , клеточные окислительно-восстановительные изменения или каскады протеинкиназ , которые напрямую активируют клеточные изменения (например, укрепление клеточной стенки или выработку антимикробных препаратов) или активируют изменения в экспрессии генов , которые затем усиливают другие защитные реакции.
Иммунные системы растений демонстрируют некоторое механистическое сходство с иммунными системами насекомых и млекопитающих, но также демонстрируют множество специфичных для растений характеристик. [10] Два вышеописанных уровня являются центральными для иммунитета растений, но не полностью описывают иммунные системы растений. Кроме того, многие конкретные примеры явных PTI или ETI нарушают общие определения PTI/ETI, что указывает на необходимость расширенных определений и/или парадигм. [11]
Термин количественная устойчивость (обсуждается ниже) относится к устойчивости растений к болезням, которая контролируется несколькими генами и несколькими молекулярными механизмами, каждый из которых оказывает небольшое влияние на общую характеристику устойчивости. Количественную устойчивость часто противопоставляют устойчивости к ETI, опосредованной отдельными генами R с основным эффектом.
PAMP , консервативные молекулы, которые населяют несколько родов патогенов , многими исследователями называются MAMP. Защиты, вызванные восприятием MAMP, достаточны для отражения большинства патогенов. Однако белки-эффекторы патогенов (см. ниже) адаптированы для подавления базальных защит, таких как PTI. Было обнаружено много рецепторов для MAMP (и DAMP). MAMP и DAMP часто обнаруживаются трансмембранными рецепторными киназами, которые несут внеклеточные домены LRR или LysM . [5]
Иммунитет, запускаемый эффекторами (ETI), активируется присутствием эффекторов патогенов. Ответ ETI зависит от генов R и активируется определенными штаммами патогенов. Растительный ETI часто вызывает апоптотическую гиперчувствительную реакцию .
Растения развили гены R (гены устойчивости), продукты которых опосредуют устойчивость к определенным штаммам вирусов, бактерий, оомицетов, грибков, нематод или насекомых. Продукты генов R представляют собой белки, которые позволяют распознавать определенные эффекторы патогенов либо посредством прямого связывания, либо посредством распознавания изменения эффектором белка хозяина. [6] Многие гены R кодируют белки NB-LRR (белки с нуклеотидсвязывающими и богатыми лейцином повторяющимися доменами, также известные как белки NLR или белки STAND, среди прочих названий). Большинство иммунных систем растений несут репертуар из 100–600 различных гомологов генов R. Было показано, что отдельные гены R опосредуют устойчивость к определенным штаммам вирусов, бактерий, оомицетов, грибков, нематод или насекомых. Продукты генов R контролируют широкий набор реакций устойчивости к болезням, индукция которых часто достаточна для остановки дальнейшего роста/распространения патогенов.
Изученные гены R обычно придают специфичность определенным штаммам видов патогенов (те, которые экспрессируют распознаваемый эффектор). Как впервые отметил Гарольд Флор в своей формулировке взаимосвязи ген-ген в середине 20-го века , ген R растения имеет специфичность к гену авирулентности патогена (ген Avr). Теперь известно, что гены авирулентности кодируют эффекторы. Ген Avr патогена должен иметь совпадающую специфичность с геном R, чтобы этот ген R придавал устойчивость, что предполагает взаимодействие рецептора/ лиганда для генов Avr и R. [10] В качестве альтернативы эффектор может модифицировать свою клеточную цель хозяина (или молекулярную приманку этой цели), и продукт гена R (белок NLR) активирует защиту, когда он обнаруживает измененную форму цели хозяина или приманки. [6] [12]
Эффекторы играют центральную роль в патогенном или симбиотическом потенциале микробов и микроскопических животных, колонизирующих растения, таких как нематоды. [13] [14] [15] Эффекторы, как правило, представляют собой белки, которые доставляются извне микроба в клетку-хозяина. Эти эффекторы, полученные из колонистов, манипулируют физиологией и развитием клеток хозяина. Таким образом, эффекторы предлагают примеры совместной эволюции (пример: грибковый белок, который функционирует вне гриба, но внутри растительных клеток, эволюционировал, чтобы взять на себя специфические для растений функции). Диапазон хозяев патогена определяется, среди прочего, наличием соответствующих эффекторов, которые позволяют колонизировать конкретного хозяина. [5] Эффекторы, полученные из патогенов, являются мощным инструментом для определения функций растений, которые играют ключевую роль в заболевании и в устойчивости к болезням. По-видимому, большинство эффекторов функционируют для манипулирования физиологией хозяина, чтобы позволить заболеванию возникнуть. Хорошо изученные бактериальные патогены растений обычно экспрессируют несколько десятков эффекторов, часто доставляемых в хозяина с помощью аппарата секреции типа III . [13] Грибковые, оомицетовые и нематодные патогены растений, по-видимому, экспрессируют несколько сотен эффекторов. [14] [15]
Так называемые «основные» эффекторы определяются операционально по их широкому распространению в популяции конкретного патогена и их существенному вкладу в вирулентность патогена. Геномика может быть использована для идентификации основных эффекторов, которые затем могут быть использованы для обнаружения новых аллелей гена R , которые могут быть использованы в селекции растений для устойчивости к болезням.
Пути sRNA растений считаются важными компонентами иммунитета (PTI), запускаемого патоген-ассоциированным молекулярным паттерном (PAMP), и иммунитета, запускаемого эффекторами (ETI). [16] [17] Было показано, что индуцированные бактериями микроРНК (miRNA) в Arabidopsis влияют на гормональную сигнализацию, включая ауксин, абсцизовую кислоту (ABA), жасмоновую кислоту (JA) и салициловую кислоту (SA). [18] [19] Достижения в исследованиях на уровне всего генома выявили массовую адаптацию паттернов экспрессии miRNA хозяина после заражения грибковыми патогенами Fusarium virguliforme , [20] Erysiphe graminis , [21] Verticillium dahliae , [22] и Cronartium quercuum , [23] а также оомицетом Phytophthora sojae . [24] Изменения экспрессии sRNA в ответ на грибковые патогены указывают на то, что подавление генов может быть вовлечено в этот защитный путь. Однако есть также доказательства того, что противогрибковая защитная реакция на инфекцию Colletotrichum spp. в кукурузе не полностью регулируется специфической индукцией miRNA, но вместо этого может действовать для тонкой настройки баланса между генетическими и метаболическими компонентами при инфицировании. [ необходима цитата ]
Транспорт sRNAs во время инфекции, вероятно, облегчается внеклеточными везикулами (EVs) и мультивезикулярными тельцами (MVBs). [25] Состав РНК в растительных EVs не был полностью изучен, но вполне вероятно, что они частично отвечают за транспортировку РНК. Растения могут транспортировать вирусные РНК, мРНК , miRNA и малые интерферирующие РНК (siRNA) системно через флоэму. [26] Считается, что этот процесс происходит через плазмодесмы и включает РНК-связывающие белки, которые помогают локализации РНК в клетках мезофилла. Хотя они были идентифицированы во флоэме с мРНК, нет определенных доказательств того, что они опосредуют дальний транспорт РНК. [27] Таким образом, EVs могут способствовать альтернативному пути загрузки РНК во флоэму или, возможно, могут транспортировать РНК через апопласт. [28] Также имеются данные о том, что растительные ЭВ могут обеспечивать межвидовой перенос малых РНК посредством РНК-интерференции, такой как подавление генов, вызванное хозяином (HIGS). [29] [30] Транспорт РНК между растениями и грибами, по-видимому, является двунаправленным, поскольку было показано, что малые РНК из патогенного грибка Botrytis cinerea нацелены на гены защиты хозяина в Arabidopsis и томатах. [31]
В небольшом числе случаев гены растений эффективны против целого вида патогена, даже если этот вид патогенен для других генотипов этого вида хозяина. Примерами служат MLO ячменя против мучнистой росы , Lr34 пшеницы против листовой ржавчины и Yr36 пшеницы против желтой ржавчины пшеницы . В зависимости от конкретного гена и комбинации растение-патоген может существовать ряд механизмов для этого типа устойчивости. Другие причины эффективного иммунитета растений могут включать отсутствие коадаптации (патоген и/или растение не имеют нескольких механизмов, необходимых для колонизации и роста в пределах этого вида хозяина) или особенно эффективный набор предварительно сформированных защит. [ необходима цитата ]
Сигнализация защиты растений активируется рецепторами обнаружения патогенов, которые описаны в предыдущем разделе. [5] Активированные рецепторы часто вызывают выработку реактивного кислорода и оксида азота , потоки ионов кальция , калия и протонов , измененные уровни салициловой кислоты и других гормонов, а также активацию МАР-киназ и других специфических протеинкиназ . [10] Эти события, в свою очередь, обычно приводят к модификации белков, которые контролируют транскрипцию генов , и активации экспрессии генов , связанных с защитой . [8]
Было идентифицировано множество генов и/или белков, а также других молекул, которые опосредуют передачу защитных сигналов растений. [32] [33] Динамика перемещения цитоскелета и везикул помогает ориентировать защитные реакции растений на точку атаки патогена.
Активность иммунной системы растений частично регулируется сигнальными гормонами, такими как: [34] [35]
Между этими путями могут быть существенные перекрестные помехи. [34]
Как и многие пути передачи сигнала, экспрессия генов растений во время иммунных реакций может регулироваться деградацией. Это часто происходит, когда связывание гормонов с рецепторами гормонов стимулирует деградацию репрессорных белков, связанную с убиквитином , которые блокируют экспрессию определенных генов. Конечным результатом является экспрессия генов, активируемая гормонами. Примеры: [36]
Убиквитинирование играет центральную роль в клеточной сигнализации, которая регулирует процессы, включая деградацию белков и иммунологический ответ. [37] Хотя одной из основных функций убиквитина является нацеливание белков на разрушение, он также полезен в сигнальных путях, высвобождении гормонов, апоптозе и транслокации материалов по всей клетке. Убиквитинирование является компонентом нескольких иммунных реакций. Без надлежащего функционирования убиквитина вторжение патогенов и других вредных молекул резко возросло бы из-за ослабления иммунной защиты. [37]
Фермент убиквитинлигаза E3 является основным компонентом, который обеспечивает специфичность в путях деградации белков, включая иммунные сигнальные пути. [36] Компоненты фермента E3 можно сгруппировать по доменам, которые они содержат, и включают несколько типов. [38]
К ним относятся одиночные субъединицы Ring и U-box, HECT и CRL . [39] [40] Сигнальные пути растений, включая иммунные реакции, контролируются несколькими путями обратной связи, которые часто включают отрицательную обратную связь; и они могут регулироваться ферментами деубиквитинирования, деградацией факторов транскрипции и деградацией отрицательных регуляторов транскрипции. [36] [41]
Различия в устойчивости растений к болезням часто являются постепенными или количественными, а не качественными. Термин количественная устойчивость (QR) относится к устойчивости растений к болезням, которая контролируется несколькими генами и несколькими молекулярными механизмами, каждый из которых оказывает небольшое или незначительное влияние на общий признак устойчивости. [42] QR важен в селекции растений, поскольку полученная устойчивость часто более долговечна (эффективна в течение большего количества лет) и с большей вероятностью будет эффективна против большинства или всех штаммов определенного патогена. QR, как правило, эффективен против одного вида патогена или группы близкородственных видов, а не эффективен в целом против нескольких патогенов. [42] QR часто получают путем селекции растений без знания причинных генетических локусов или молекулярных механизмов. QR, вероятно, зависит от многих компонентов иммунной системы растений, обсуждаемых в этой статье, а также от признаков, которые являются уникальными для определенных пар растение-патоген (например, чувствительность к определенным эффекторам патогена), а также от общих признаков растений, таких как характеристики поверхности листьев или корневой системы или архитектура растительного полога. Термин QR является синонимом термина « незначительная генная устойчивость» . [43]
Устойчивость взрослых растений (APR) — это специальный термин, обозначающий количественную устойчивость, которая не эффективна на стадии проростков, но эффективна на протяжении многих оставшихся стадий роста растений. [43] [44] [42] Разница между устойчивостью взрослых растений и устойчивостью проростков особенно важна для однолетних культур . [45] Устойчивость проростков — это устойчивость, которая начинается на стадии проростков и продолжается на протяжении всей его жизни. При использовании специалистами этот термин не относится к устойчивости, которая активна только на стадии проростков. «Устойчивость проростков» подразумевается как синоним устойчивости основных генов или устойчивости на всех стадиях (ASR) и используется в качестве противопоставления «устойчивости взрослых растений». [43] Устойчивость проростков часто опосредуется отдельными генами R, но не все гены R кодируют устойчивость проростков.
Селекционеры растений подчеркивают отбор и разработку линий растений, устойчивых к болезням. Болезни растений также можно частично контролировать с помощью пестицидов и методов возделывания, таких как севооборот , обработка почвы, плотность посадки, семена без болезней и очистка оборудования, но сорта растений с врожденной (генетически обусловленной) устойчивостью к болезням, как правило, предпочтительны. [2] Селекция на устойчивость к болезням началась, когда растения были впервые одомашнены. Усилия по селекции продолжаются, потому что популяции патогенов находятся под давлением отбора и развивают повышенную вирулентность, патогены перемещаются (или перемещаются) в новые области, изменение методов возделывания или климата благоприятствует некоторым патогенам и может снизить эффективность устойчивости, а селекция растений на другие признаки может нарушить предыдущую устойчивость. [46] Линия растений с приемлемой устойчивостью к одному патогену может не иметь устойчивости к другим.
Селекция на устойчивость обычно включает:
Устойчивость называется прочной, если она продолжает быть эффективной в течение многих лет широкомасштабного использования по мере развития популяций патогенов. « Вертикальная устойчивость » специфична для определенных рас или штаммов видов патогенов, часто контролируется одними генами R и может быть менее прочной. Горизонтальная или широкоспектральная устойчивость против целого вида патогенов часто бывает не полностью эффективной, но более прочной и часто контролируется многими генами, которые разделяются в размножающихся популяциях. [2] Устойчивость важна даже тогда, когда ожидается появление будущих улучшенных сортов: среднее время от распознавания человеком новой угрозы грибкового заболевания до выпуска устойчивой к этому патогену культуры составляет не менее двенадцати лет. [47] [48]
Такие культуры, как картофель, яблоки, бананы и сахарный тростник, часто размножаются вегетативным размножением для сохранения весьма желательных сортов растений, поскольку для этих видов ауткроссинг серьезно нарушает предпочтительные признаки. См. также бесполое размножение . Вегетативно размножаемые культуры могут быть одними из лучших целей для улучшения устойчивости с помощью биотехнологического метода трансформации растений для управления генами, которые влияют на устойчивость к болезням. [1]
Научная селекция на устойчивость к болезням началась с сэра Роуленда Биффена , который идентифицировал один рецессивный ген устойчивости к желтой ржавчине пшеницы. Почти каждая культура затем была выведена с включением генов устойчивости к болезням (R), многие из которых были получены путем интрогрессии от совместимых диких родственников. [1]
Термин ГМ ( «генетически модифицированный» ) часто используется как синоним трансгенного для обозначения растений, модифицированных с использованием технологий рекомбинантной ДНК. Растения с трансгенной/ГМ устойчивостью к болезням против насекомых-вредителей оказались чрезвычайно успешными в качестве коммерческих продуктов, особенно кукурузы и хлопка, и ежегодно высаживаются на более чем 20 миллионах гектаров в более чем 20 странах мира [49] (см. также генетически модифицированные культуры ). Устойчивость трансгенных растений к болезням против микробных патогенов была впервые продемонстрирована в 1986 году. Экспрессия последовательностей генов вирусного белка оболочки придавала вирусную устойчивость через малые РНК . Это оказалось широко применимым механизмом для ингибирования вирусной репликации. [50] Объединив гены белка оболочки из трех разных вирусов, ученые вывели гибриды тыквы с подтвержденной в полевых условиях мультивирусной устойчивостью. Подобные уровни устойчивости к этому разнообразию вирусов не были достигнуты путем традиционной селекции.
Аналогичная стратегия была применена для борьбы с вирусом кольцевой пятнистости папайи , который к 1994 году угрожал уничтожить индустрию папайи на Гавайях . Полевые испытания продемонстрировали превосходную эффективность и высокое качество плодов. К 1998 году первая трансгенная папайя, устойчивая к вирусу, была одобрена для продажи. Устойчивость к болезням сохраняется уже более 15 лет. Трансгенная папайя составляет ~85% гавайского производства. Фрукт одобрен для продажи в США, Канаде и Японии.
Линии картофеля, экспрессирующие вирусные репликазные последовательности, которые обеспечивают устойчивость к вирусу скручивания листьев картофеля, продавались под торговыми наименованиями NewLeaf Y и NewLeaf Plus и были широко приняты в коммерческом производстве в 1999–2001 годах, пока корпорация McDonald's не решила не закупать ГМ-картофель, а Monsanto не решила закрыть свой картофельный бизнес NatureMark. [51] Картофель NewLeaf Y и NewLeaf Plus несли два ГМ-признака, поскольку они также проявляли Bt-опосредованную устойчивость к колорадскому жуку.
К 2013 году на рынке не появилось ни одной другой культуры с искусственно созданной устойчивостью к патогенным микроорганизмам, хотя более десятка из них находились на той или иной стадии разработки и испытаний.
Исследования, направленные на создание устойчивости, следуют нескольким стратегиям. Одна из них заключается в переносе полезных PRR в виды, у которых их нет. Идентификация функциональных PRR и их перенос в виды-реципиенты, у которых нет ортологичного рецептора, может обеспечить общий путь к дополнительному расширению репертуара PRR. Например, рецептор Arabidopsis PRR EF-Tu (EFR) распознает бактериальный фактор удлинения трансляции EF-Tu . Исследования, проведенные в лаборатории Сэйнсбери, показали, что развертывание EFR либо в Nicotiana benthamiana , либо в Solanum lycopersicum (томат), которые не могут распознавать EF-Tu , придает устойчивость к широкому спектру бактериальных патогенов. Экспрессия EFR в томате была особенно эффективна против широко распространенной и разрушительной почвенной бактерии Ralstonia solanacearum . [52] И наоборот, ген томата PRR Verticillium 1 ( Ve1 ) может быть перенесен из томата в Arabidopsis , где он придает устойчивость к изолятам Verticillium расы 1. [1]
Вторая стратегия пытается одновременно развернуть несколько генов NLR, стратегия селекции, известная как стекирование. Сорта, созданные либо путем молекулярной селекции с использованием ДНК , либо путем переноса генов , скорее всего, продемонстрируют более стойкую устойчивость, поскольку патогенам придется мутировать несколько эффекторных генов. Секвенирование ДНК позволяет исследователям функционально «добывать» гены NLR из нескольких видов/штаммов. [1]
Ген -эффектор avrBs2 из Xanthomona perforans является возбудителем бактериальной пятнистости перца и томата. Первый «рационализированный эффектором» поиск потенциально прочного гена R последовал за открытием того, что avrBs2 обнаружен у большинства видов Xanthomonas , вызывающих заболевания , и необходим для приспособленности патогена. Ген Bs2 NLR из дикого перца Capsicum chacoense был перенесен в томат, где он подавлял рост патогена. Полевые испытания продемонстрировали надежную устойчивость без бактерицидных химикатов. Однако редкие штаммы Xanthomonas преодолели опосредованную Bs2 устойчивость у перца путем приобретения мутаций avrBs2 , которые избегают распознавания, но сохраняют вирулентность. Стекинг генов R, каждый из которых распознает другой основной эффектор, может задержать или предотвратить адаптацию. [1]
Более 50 локусов в штаммах пшеницы обеспечивают устойчивость к болезням против патогенов стеблевой, листовой и желтой ржавчины пшеницы. Ген NLR Stem rust 35 ( Sr35 ), клонированный из диплоидного родственника культурной пшеницы Triticum monococcum , обеспечивает устойчивость к изоляту ржавчины пшеницы Ug99 . Аналогично, Sr33 из родственника пшеницы Aegilops tauschii кодирует ортолог пшеницы генам устойчивости к мучнистой росе Mla ячменя . Оба гена необычны для пшеницы и ее родственников. В сочетании с геном Sr2 , который действует аддитивно по крайней мере с Sr33, они могут обеспечить длительную устойчивость к болезням Ug99 и его производным. [1]
Другой класс генов устойчивости растений к болезням открывает «лазейку», которая быстро убивает захваченные клетки, останавливая распространение патогена. Эффекторы Xanthomonas и Ralstonia , подобные активатору транскрипции (TAL), являются ДНК-связывающими белками, которые активируют экспрессию генов хозяина для усиления вирулентности патогена. Как рисовая, так и перцовая линии независимо друг от друга развили сайты связывания TAL-эффекторов, которые вместо этого действуют как палач, вызывающий гиперчувствительную гибель клеток хозяина при активации. Xa27 из риса и Bs3 и Bs4c из перца являются такими генами-«исполнителями» (или «палачами»), которые кодируют негомологичные растительные белки неизвестной функции. Гены-исполнители экспрессируются только в присутствии определенного эффектора TAL. [1]
Сконструированные гены-исполнители были продемонстрированы путем успешного перепроектирования промотора Bs3 перца , чтобы он содержал два дополнительных участка связывания для эффекторов TAL из разрозненных штаммов патогенов. Впоследствии сконструированный ген-исполнитель был развернут в рисе путем добавления пяти участков связывания эффекторов TAL к промотору Xa27 . Синтетическая конструкция Xa27 придала устойчивость к бактериальной пятнистости Xanthomonas и бактериальной полосатости листьев. [1]
Большинство патогенов растений перепрограммируют паттерны экспрессии генов хозяина, чтобы напрямую принести пользу патогену. Перепрограммированные гены, необходимые для выживания и распространения патогена, можно рассматривать как «гены восприимчивости к болезням». Рецессивные гены устойчивости являются кандидатами на восприимчивость к болезням. Например, мутация отключила ген Arabidopsis , кодирующий пектатлиазу (участвующую в деградации клеточной стенки), что придает устойчивость к патогену мучнистой росы Golovinomyces cichoracearum . Аналогичным образом, ген MLO ячменя и спонтанно мутировавшие ортологи MLO гороха и томата также придают устойчивость к мучнистой росе. [1]
Lr34 — это ген, который обеспечивает частичную устойчивость к листовой и желтой ржавчине, а также мучнистой росе у пшеницы. Lr34 кодирует транспортер аденозинтрифосфата (АТФ)–связывающей кассеты (ABC). Доминантный аллель, который обеспечивает устойчивость к болезням, был недавно обнаружен у культивируемой пшеницы (не у диких штаммов) и, как и MLO , обеспечивает широкий спектр устойчивости у ячменя. [1]
Естественные аллели факторов инициации удлинения трансляции хозяина eif4e и eif4g также являются рецессивными генами вирусной устойчивости. Некоторые из них были использованы для контроля потивирусов в ячмене, рисе, томатах, перце, горохе, салате и дыне. Это открытие побудило провести успешный мутантный скрининг химически индуцированных аллелей eif4e в томатах. [1]
Естественная вариация промотора может привести к эволюции рецессивных аллелей устойчивости к болезням. Например, рецессивный ген устойчивости xa13 в рисе является аллелем Os-8N3 . Os-8N3 транскрипционно активируется штаммами Xanthomonas oryzae pv. oryzae , которые экспрессируют эффектор TAL PthXo1 . Ген xa13 имеет мутировавший элемент связывания эффектора в своем промоторе, который устраняет связывание PthXo1 и делает эти линии устойчивыми к штаммам, которые полагаются на PthXo1 . Это открытие также продемонстрировало, что Os-8N3 необходим для восприимчивости. [1]
Xa13/Os-8N3 требуется для развития пыльцы, показывая, что такие мутантные аллели могут быть проблематичными, если фенотип восприимчивости к болезни изменит функцию в других процессах. Однако мутации в эффектор-связывающем элементе Os11N3 (OsSWEET14) TAL были сделаны путем слияния эффекторов TAL с нуклеазами ( TALEN ). Геномно-редактированные растения риса с измененными сайтами связывания Os11N3 оставались устойчивыми к Xanthomonas oryzae pv. oryzae , но все еще обеспечивали нормальную функцию развития. [1]
Устойчивость, основанная на подавлении РНК, является мощным инструментом для создания устойчивых культур. Преимущество РНК-интерференции как новой генной терапии против грибковых, вирусных и бактериальных инфекций растений заключается в том, что она регулирует экспрессию генов посредством деградации информационной РНК , репрессии трансляции и ремоделирования хроматина посредством малых некодирующих РНК. Механистически процессы подавления направляются продуктами обработки триггера двухцепочечной РНК ( дцРНК ), которые известны как малые интерферирующие РНК и микроРНК . [53]
Влияние температуры на устойчивость к вирусам
Температура существенно влияет на устойчивость растений к вирусам. Например, растения с геном N табака развивают толерантность к вирусу табачной мозаики (TMV), но становятся системно инфицированными при температуре выше 28 °C. Аналогично, растения Capsicum chinense, несущие ген Tsw, могут стать системно инфицированными вирусом пятнистого увядания томата (TSWV) при 32 °C. В случае вируса некротического желтого пятна свеклы (BNYVV) растения, экспрессирующие ген BvGLYR1, показали более высокое накопление вируса при 22 °C по сравнению с 30 °C, что указывает на то, что температура влияет на эффективность этого гена в устойчивости к вирусам.
Среди тысяч видов фитопатогенных микроорганизмов только небольшое меньшинство обладает способностью инфицировать широкий спектр видов растений. Большинство патогенов вместо этого проявляют высокую степень специфичности к хозяину. Часто говорят, что виды растений, не являющиеся хозяевами, проявляют нехозяинную устойчивость . Термин «устойчивость хозяина» используется, когда вид патогена может быть патогенным для вида хозяина, но определенные штаммы этого вида растений сопротивляются определенным штаммам вида патогена. Причины устойчивости хозяина и нехозяинной устойчивости могут перекрываться. Круг хозяев патогена определяется, среди прочего, наличием соответствующих эффекторов, которые позволяют колонизировать конкретного хозяина. [5] Круг хозяев патогена может измениться довольно внезапно, если, например, способность патогена синтезировать токсин или эффектор, специфичный для хозяина, приобретается путем перетасовки/мутации генов или горизонтального переноса генов . [54] [55]
Местные популяции часто характеризуются значительным разнообразием генотипов и рассредоточенными популяциями (рост в смеси со многими другими видами растений). Они также претерпели коэволюцию фитопатогенов . Следовательно, пока новые патогены не внедряются/не развиваются, такие популяции обычно демонстрируют лишь низкую частоту серьезных эпидемий заболеваний . [56]
Монокультурные сельскохозяйственные системы обеспечивают идеальную среду для эволюции патогенов, поскольку они предлагают высокую плотность целевых образцов со схожими/идентичными генотипами. [56] Рост мобильности, обусловленный современными транспортными системами, обеспечивает патогенам доступ к большему количеству потенциальных целей. [56] Изменение климата может изменить жизнеспособный географический ареал видов патогенов и привести к тому, что некоторые заболевания станут проблемой в районах, где ранее эти заболевания были менее важными. [56]
Эти факторы делают современное сельское хозяйство более подверженным эпидемиям болезней. Обычные решения включают постоянную селекцию на устойчивость к болезням, использование пестицидов, использование пограничных инспекций и ограничений на импорт растений, поддержание значительного генетического разнообразия в генофонде сельскохозяйственных культур (см. разнообразие сельскохозяйственных культур ) и постоянное наблюдение для ускорения инициирования соответствующих ответов. Некоторые виды патогенов обладают гораздо большей способностью преодолевать устойчивость растений к болезням, чем другие, часто из-за их способности быстро развиваться и широко распространяться. [56]
Каштановая гниль была впервые замечена на американских каштановых деревьях, которые росли в том, что сейчас известно как Бронксский зоопарк, в 1904 году. В течение многих лет после этого инцидента велись споры о том, какова была личность патогена, а также о надлежащем подходе к его контролю. Самые ранние попытки решить проблему с каштаном включали химические решения или физические методы. Они пытались использовать фунгициды, обрезать ветви деревьев, чтобы остановить инфекцию, и полностью удалить зараженные деревья из мест обитания, чтобы не позволить им заразить другие. Все эти стратегии оказались безуспешными. Были даже введены карантинные меры, которым помогло принятие Закона о карантине растений. Каштановая гниль все еще оказалась огромной проблемой, поскольку она быстро распространялась по густонаселенным лесам каштановых деревьев. В 1914 году рассматривалась идея вызвать у деревьев устойчивость к гнили с помощью различных средств и механизмов разведения. [57]